副猪嗜血杆菌lgtF基因缺失株的构建及其部分生物学特性
2015-03-22曾泽,何欢,岳华,汤承,张斌
曾 泽,何 欢,岳 华,汤 承,张 斌
(西南民族大学 生命科学与技术学院,成都 610041)
副猪嗜血杆菌lgtF基因缺失株的构建及其部分生物学特性
曾 泽,何 欢,岳 华,汤 承,张 斌*
(西南民族大学 生命科学与技术学院,成都 610041)
lgtF基因编码的葡萄糖基转移酶在脂寡糖(LOS)的合成过程中负责增加一个葡萄糖合成庚糖I,在部分革兰阴性菌中是重要的毒力相关基因,但lgtF基因在副猪嗜血杆菌(Haemophilusparasuis,HPS)中的作用还不清楚。本研究利用遗传操作方法构建HPS SC096的lgtF基因缺失株(ΔlgtF)。通过热酚法分别提取缺失株与野生株的LOS,将提取的LOS进行SDS-PAGE和银染。比较缺失株与野生株的生长曲线、抗血清中补体杀菌能力以及对宿主细胞——猪血管内皮细胞(PUVEC)和猪肾上皮细胞(PK-15)的黏附和入侵能力。结果表明与野生株相比,ΔlgtF的LOS糖链结构变短,生长速度稍微减慢,另外,ΔlgtF在兔和猪血清中抗补体杀菌能力明显降低(P<0.05),对PUVEC和PK-15细胞的黏附入侵能力明显降低(P<0.05)。以上结果表明lgtF基因是HPS的一个毒力相关基因。
副猪嗜血杆菌;lgtF基因;缺失株;毒力相关基因
副猪嗜血杆菌(Haemophilusparasuis,HPS) 属于巴斯德菌科(Pastteurellaceae)嗜血杆菌属(Haemophilus),能引起猪的多发性浆膜炎、关节炎以及脑膜炎为主要特征的猪革拉泽病(Gläser’s disease)[1-2]。HPS感染猪群会引起较高的发病率和死亡率,对养猪业造成巨大的经济损失[2]。HPS分为15个血清型,而且不同血清型间毒力有明显差异[1,3]。研究发现LOS参与HPS对宿主细胞的黏附作用,并能促进炎性因子 IL-6 和IL-8的表达[4-5],证实LOS参与了HPS致病过程,是一个重要的毒力因子。
LOS是革兰阴性菌外膜的主要成分,在发病机制中起着重要的作用[6-9]。LOS由脂质A、2-酮-3-脱氧辛酸、庚糖和其他糖基组成[10]。单糖分析显示HPS的LOS含有葡萄糖、半乳糖、半乳糖-N等多种成分,其中葡萄糖是主要组成成分[11],这为LOS功能的研究奠定了基础。lgtF基因编码的葡萄糖基转移酶负责增加一个葡萄糖合成庚糖I,并参与LOS的合成[12-15]。研究表明在多数革兰阴性菌中lgtF基因是重要的毒力基因[13-16]。但是,lgtF基因在HPS致病过程中的作用还不清楚。本试验通过构建HPS SC096的ΔlgtF缺失株,并对其LOS结构、生长特性、抗血清杀菌能力以及对细胞的黏附和入侵能力进行研究,以确定lgtF基因在HPS致病过程中的作用。
1 材料与方法
1.1 菌种、质粒、细胞
副猪嗜血杆菌SC096分离株、质粒pK18mobsacB和pHV1249由华南农业大学廖明教授馈赠。质粒pMD-19T购自TaKaRa公司。PUVEC和PK-15细胞由本实验室保存。
1.2 主要仪器和试剂
恒温金属浴购自博日公司;CO2培养箱购自Thermoforma公司;高速离心机5804购自Eppendorf 公司;普通PCR仪、核酸蛋白电泳仪powerpac universalTM、凝胶成像系统VersaDoc2000购自Bio-Rad 公司。TSA(胰蛋白胨大豆琼脂)、TSB(胰蛋白胨大豆肉汤)购自青岛海博试剂有限公司;新生牛血清购自郑州佰安生物工程有限公司;NAD(烟酰胺腺嘌呤二核苷酸)购自北京博奥拓达科技有限公司,DMEM培养基和胎牛血清购自Gibco公司,卡那霉素、氨苄霉素、红霉素均购自上海生工公司,pMD-19T载体、感受态DH5α,ExTaq、T4连接酶购自宝生物工程(大连)有限公司;Gel extraction kit试剂盒,Cycle-pure kit试剂盒和Plasmid Mini kit试剂盒购自宝生物工程(大连)有限公司。
1.3 引物设计
根据NCBI(GenBank:CP001321.1)已发布的HPS SH0165中lgtF的序列,利用Primer Premier 5.0设计所用引物(表 1),各引物均由上海生物工程公司合成。引物中下划线部分为酶切位点。
1.4 缺失株的构建
用引物P1/P2 从HPS SC096菌株的基因组中扩增lgtF基因的上臂片段(481 bp),用引物P3/P4 从SC096菌株的基因组中扩增lgtF基因的下臂片段(484 bp)。以上下臂片段为模板用引物P1/P4进行重叠序列延伸PCR,将lgtF基因上下臂连接起来,纯化回收,克隆转化到pMD19-T载体获得质粒pZZ001。用Hind Ⅲ和EcoR Ⅰ对质粒pZZ001进行双酶切,纯化回收,克隆转化到pK18mobsacB并获得质粒pZZ002,将863 bp的红霉素抗性片段转入到质粒pZZ002获得质粒pZZ003,用已优化过的自然转化方法[17]将质粒pZZ003转入HPS SC096株获得lgtF基因缺失株。
表1 本研究所用的引物序列
Table 1 Sequences of primers used in this study
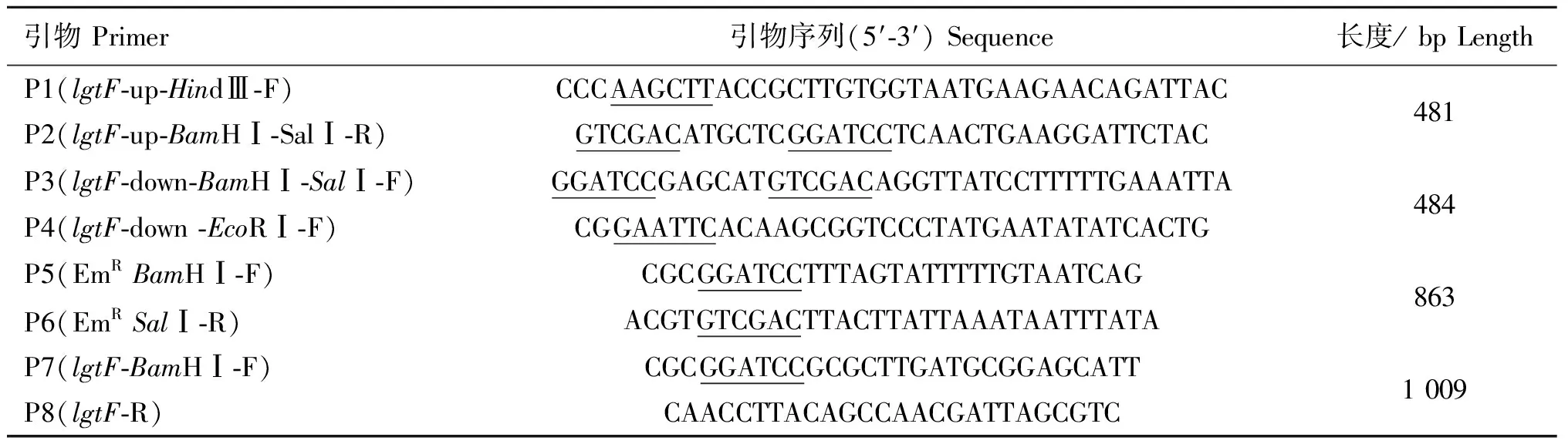
引物Primer引物序列(5′⁃3′)Sequence长度/bpLengthP1(lgtF⁃up⁃HindⅢ⁃F)P2(lgtF⁃up⁃BamHⅠ⁃SalⅠ⁃R)CCCAAGCTTACCGCTTGTGGTAATGAAGAACAGATTACGTCGACATGCTCGGATCCTCAACTGAAGGATTCTAC481P3(lgtF⁃down⁃BamHⅠ⁃SalⅠ⁃F)P4(lgtF⁃down⁃EcoRⅠ⁃F)GGATCCGAGCATGTCGACAGGTTATCCTTTTTGAAATTACGGAATTCACAAGCGGTCCCTATGAATATATCACTG484P5(EmRBamHⅠ⁃F)P6(EmRSalⅠ⁃R)CGCGGATCCTTTAGTATTTTTGTAATCAGACGTGTCGACTTACTTATTAAATAATTTATA863P7(lgtF⁃BamHⅠ⁃F)P8(lgtF⁃R)CGCGGATCCGCGCTTGATGCGGAGCATTCAACCTTACAGCCAACGATTAGCGTC1009
下划线部分为酶切位点
Restriction sites are underlined
1.5 LOS提取与SDS-PAGE
采用热酚法[18]分别提取HPS SC096株与ΔlgtF缺失株的LOS,将提取的LOS进行SDS-PAGE(5%浓缩胶,18%分离胶)并银染[19]分析。
1.6 生长曲线的测定
将HPS SC096株与ΔlgtF缺失株接种于TSB液体培养基,37 ℃培养12 h左右作为种子液。再将上述种子液按培养基总体积的1% 接种于事先预热到37 ℃的TSB液体培养基,于37 ℃,180 r·min-1振荡培养,每个样本设置3个平行。其间每隔1 h取样进行平板菌落计数,用分光光度计测定培养基的OD600 nm值,并将结果绘制成曲线。
1.7 抗血清中补体杀菌试验
根据已描述的抗血清杀菌实验方法[15],取100 μL新鲜的猪血清和兔血清或56 ℃灭活30 min的猪血清和兔血清,分别与100 μL 细菌(1×108CFU·mL-1)混合;取180 μL新鲜的猪血清和兔血清或56 ℃灭活30 min的猪血清和兔血清分别与20 μL 细菌(1×108CFU·mL-1)混合,37 ℃,150 r·min-1振荡培养1 h,10倍稀释后涂布在TSA 平板(含NAD和血清)上,每个样本设置3个平行。细菌存活率即为在新鲜血清中存活的细菌除以在灭活血清中的存活率。
1.8 细胞黏附入侵试验
为了确定细菌对细胞的黏附效果,参考文献[20]方法将猪血管内皮细胞(PUVEC)和猪肾上皮细胞(PK-15)接到24孔细胞培养板,加入含10%的胎牛血清的DMEM培养基,5% CO237 ℃培养24 h。用107CFU的菌液感染细胞,37 ℃培养2 h,用PBS清洗细胞3次,用0.1 mL 0.25%胰酶37 ℃消化细胞10 min,再加入0.9 mL TSB将细胞取出,10倍稀释后涂布在TSA 平板(含NAD和血清)上,每个样本设置3个平行。
为了确定细菌对细胞的入侵效果,参考文献[20]将猪血管内皮细胞(PUVEC)和猪肾上皮细胞(PK-15)接到24孔细胞培养板,加入含10%的胎牛血清的DMEM培养基,5% CO237 ℃培养24 h。用107CFU的菌液感染细胞,37 ℃培养2 h,用PBS清洗细胞3次,加入含 20 μg·mL-1的庆大霉素的DMEM 37 ℃培养2 h,用PBS清洗细胞3次,用0.1 mL 0.25%胰酶37 ℃消化细胞10 min,再加入0.9 mL TSB将细胞取出,10倍稀释后涂布在TSA 平板(含NAD和血清)上,每个样本设置3个平行。
1.9 数据统计
数据通过SPSS Statistics软件进行独立样本t检验分析差异显著性,P<0.05表明差异显著。
2 结 果
2.1 缺失株ΔlgtF的构建与验证
用质粒pZZ003与HPS SC096株进行自然转化,用含Em的TSA平板(含血清和NAD)进行筛选,获得Em抗性的接合子。用引物P5/P6和P7/P8检测ΔlgtF缺失株(图1A、1B)。当用引物P5/P6分别对野生型SC096株和ΔlgtF缺失株基因组进行扩增时,电泳图1A显示ΔlgtF缺失株能被扩增出一条750到1 000 bp之间条带,与预期的863 bp的红霉素抗性片段一致。当用引物P7/P8分别对野生型SC096株和ΔlgtF缺失株基因组进行扩增时,电泳图1B显示野生型SC096株能被扩增出一条大约1 000 bp条带,与预期的1 009 bp的lgtF基因片段一致。从图1C可以看出ΔlgtF缺失株是由红霉素抗性片段取代野生型SC096株中lgtF基因目的片段而成。
2.2 野生株与缺失株ΔlgtF的LOS结构及生长特性的比较
为了比较HPS SC096株与ΔlgtF缺失株LOS的不同,将提取的野生株和ΔlgtF的LOS经SDS-PAGE并银染后得到图2A。银染图显示ΔlgtF缺失株的LOS泳动明显快于野生株LOS,这表明ΔlgtF缺失株LOS的相对分子质量有所减小,LOS的糖链结构有所缩短,即表明HPS SC096缺失掉lgtF基因后LOS的糖链结构缩短。HPS SC096株与ΔlgtF缺失株的生长曲线图(图2B)显示ΔlgtF缺失株的生长速度略低于野生株的生长速度。
2.3 野生株与ΔlgtF缺失株抗血清杀菌能力比较
为了研究HPS的lgtF基因是否参与了抗血清杀菌的作用,对野生型SC096株和ΔlgtF缺失株的抗血清杀菌能力进行了比较。结果表明在50%和90%的血清中,野生型SC096株具有高水平的抵抗血清杀菌能力(图3)。在50%和90%血清中,与野生型SC096株相比ΔlgtF缺失株细菌存活率大约降低了1.5和2倍(P<0.05)。这表明HPS SC096缺失掉lgtF基因后抗血清杀菌能力明显降低。

A.引物P5/P6鉴定;B.引物P7/P8鉴定; C.ΔlgtF缺失株和野生型SC096株模式图;M.DNA相对分子质量标准;1.野生型SC096株;2.ΔlgtF缺失株;3.阴性对照A.Identification by primer P5 and P6;B.Identification by primer P7 and P8;C.Characterization and construction of ΔlgtF mutant and wild-type SC096;M.DL2000 DNA marker;1.Wild-type SC096;2.ΔlgtF mutant;3.Negative control图1 ΔlgtF缺失株的鉴定Fig.1 Identification of ΔlgtF mutant strain

A.LOS的银染图;1.野生型SC096;2.ΔlgtF缺失株;B.生长曲线,误差线代表三次重复试验之间的标准误A.LOS profiles;1.Wild-type SC096 strain;2.ΔlgtF mutant;B.Growth curve,error bars represent the standard deviation from three independent experiments图2 野生株与ΔlgtF缺失株的LOS SDS-PAGE银染图及生长曲线Fig.2 LOS profiles and growth curve of wild-type SC096 strain and ΔlgtF mutant
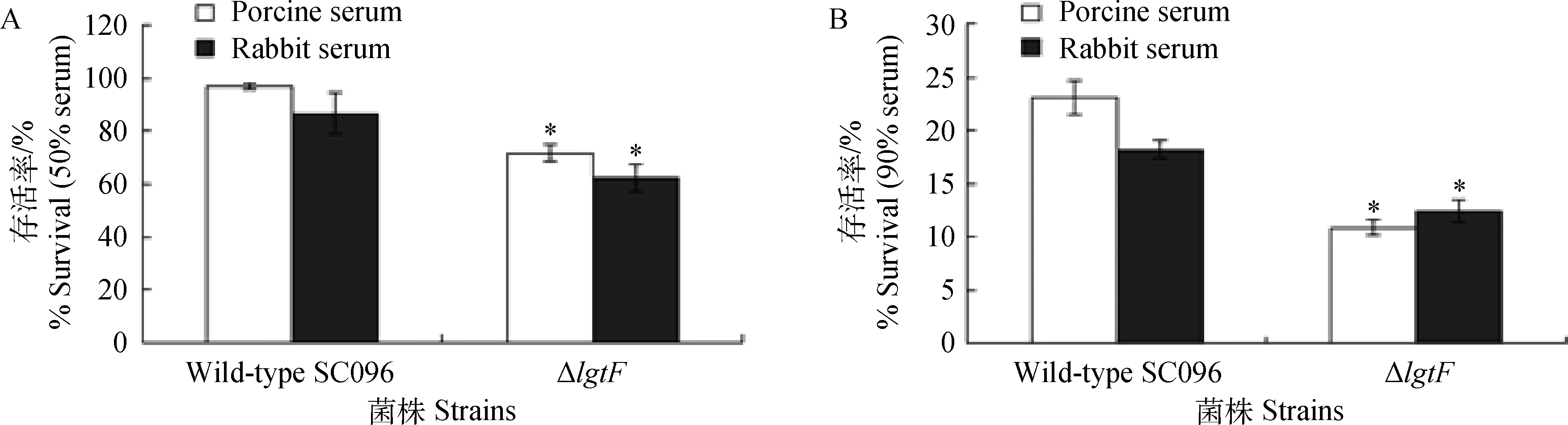
A.50%猪和兔血清;B.90%猪和兔血清;*.与野生型SC096株相比差异显著(P<0.05),误差线代表三次重复试验之间的标准误A.50% porcine and rabbit sera;B.90% porcine and rabbit sera;*.Significant difference (P<0.05) between strains.Error bars represent the standard deviation from three independent experiments图3 野生型SC096株和ΔlgtF缺失株在猪和兔血清中抗血清杀菌作用Fig.3 Survival of wild-type SC096 strain and the ΔlgtF mutant in porcine and rabbit sera
2.4 野生株与ΔlgtF缺失株对细胞黏附入侵能力比较
为了研究lgtF基因在HPS对细胞黏附入侵中发挥的作用,对ΔlgtF缺失株和野生型SC096株的黏附、入侵水平进行了比较(图4)。发现ΔlgtF缺失株对PK-15 和 PUVEC细胞的黏附水平明显的降低(P<0.05),相对于野生型SC096株,ΔlgtF缺失株的黏附量降低2倍。而且,ΔlgtF缺失株对PK-15 和 PUVEC细胞的入侵量也表现出明显的降低(P<0.05),相对于野生型SC096株,ΔlgtF缺失株的入侵水平大约降低2倍。这表明HPS SC096缺失掉lgtF基因后对细胞的黏附入侵能力明显降低。

*.与野生型SC096株相比差异显著(P<0.05),误差线代表三次重复试验之间的标准误*.Significant difference (P<0.05) between strains.Error bars represent the standard deviation from three independent experiments图4 野生型SC096株和ΔlgtF缺失株对PK-15和PUVEC细胞的黏附和入侵Fig.4 Adherence(A) and invasion(B) of H.parasuis wild-type SC096 and ΔlgtF mutant in PK-15 and PUVEC cells
3 讨 论
LOS除了可以保持外膜的稳定和保护细胞免受外界环境的压力之外,通常作为内毒素、黏附因子、宿主防御因子等参与多数革兰阴性菌的致病机制[21-23]。在HPS中,LOS已经被证实为重要的毒力因子[4-5,11,24]。为了进一步研究LOS成分与HPS发病机制之间的关系,本研究从HPS SC096基因组中敲除lgtF基因获得ΔlgtF缺失株。而且该ΔlgtF缺失株的LOS糖链结构明显变短,这表明在HPS中lgtF基因参与LOS的合成,这与之前的相关研究结果一致[13-15,25]。在HPS中,庚糖I已被证实参与LOS的合成[24]。推测由于缺失掉lgtF基因之后,菌体内缺乏葡萄糖基转移酶从而影响庚糖I的合成,最终导致LOS糖链结构的变短。ΔlgtF缺失株的生长速度略低于野生株的生长速度,这表明lgtF基因参与HPS SC096的生长代谢,这可能是由于HPS SC096敲除掉lgtF基因后外膜不稳定而影响了菌株的生长代谢。
抗血清杀菌作用是病原菌一种重要的毒力机制[26]。引起全身性感染的HPS具有抵抗补体介导的血清杀菌作用,这个特性有助于细菌突破机体的防御系统而在血液中存活。在HPS 中,缺失掉rfaE、CDT、rfaF和opsX基因后都会使菌株的抗血清杀菌能力明显地降低,表明rfaE、CDT、rfaF和opsX基因参与HPS的抗血清杀菌作用[20,24,27]。在流感嗜血杆菌和空肠弯曲杆菌中,缺失lgtF基因都会使菌株的抗血清杀菌能力明显降低[13,15]。在本研究中,ΔlgtF缺失株的抗血清杀菌能力与野生株相比明显降低,推测可能是由于LOS结构的不完整性影响了菌株抵抗补体介导的血清杀菌作用。这表明在HPS SC096的抗血清杀菌作用中lgtF基因起着重要的作用,因此可以推测lgtF基因在HPS SC096的毒力中扮演着重要的角色,可能是一个毒力相关基因。
对宿主细胞的黏附和入侵是病原体发病机制中的关键步骤。在HPS 中,缺失掉rfaE、CDT、rfaD、rfaF和opsX基因后都会显著降低菌株对细胞的黏附能力,这表明在HPS中rfaE、CDT、rfaD、rfaF和opsX都是重要的黏附因子[20,24,27-28]。在流感嗜血杆菌和空肠弯曲杆菌中,ΔlgtF缺失株在体内的定植能力和增殖能力都明显下降[13,29]。在本研究中,缺失lgtF基因之后菌株对PK-15和PUVEC细胞的黏附和入侵能力都明显降低,这可能是由于ΔlgtF缺失株的LOS结构不完整导致菌株的外膜结构不稳定引起的。这表明lgtF基因在HPS SC096对PK-15和PUVEC细胞的黏附和入侵过程中起重要作用,因此可以推测lgtF基因可能是HPS的黏附因子,但也可能是导致了其他黏附因子功能的下降或丧失。
4 结 论
成功构建HPS SC096的ΔlgtF缺失株。ΔlgtF缺失株的LOS糖链结构明显变短,生长速度稍微减慢;ΔlgtF缺失株的抗血清杀菌能力以及对宿主细胞的黏附和入侵能力都明显降低。以上结果表明在HPS SC096致病过程中lgtF基因可能是一个重要的毒力相关基因。
[1] CAI X,CHEN H,BLACKALL P J,et al.Serological characterization ofHaemophilusparasuisisolates from China[J].VetMicrobiol,2005,111(3-4):231-236.
[2] OLIVEIRA S,PIJOAN C.Haemophilusparasuis:new trends on diagnosis,epidemiology and control[J].VetMicrobiol,2004,99(1):1-12.
[3] KIELSTEIN P,RAPP-GABRIELSON V J.Designation of 15 serovars ofHaemophilusparasuison the basis of immunodiffusion using heat-stable antigen extracts[J].JClinMicrobiol,1992,30(4):862-865.
[4] BOUCHET B,VANIER G,JACQUES M,et al.Interactions ofHaemophilusparasuisand its LOS with porcine brain microvascular endothelial cells[J].VetRes,2008,39(5):42.
[5] BOUCHET B,VANIER G,JACQUES M,et al.Studies on the interactions ofHaemophilusparasuiswith porcine epithelial tracheal cells:limited role of LOS in apoptosis and pro-inflammatory cytokine release[J].MicrobPathog,2009,46(2):108-113.
[6] SWORDS W E,BUSCHER B A,VER STEEG II K,et al.Non-typeableHaemophilusinfluenzaeadhere to and invade human bronchial epithelial cells via an interaction of lipooligosaccharide with the PAF receptor[J].MolMicrobiol,2000,37(1):13-27.
[7] KANIPES M I,HOLDER L C,CORCORAN A T,et al.A deep-rough mutant ofCampylobacterjejuni81-176 is noninvasive for intestinal epithelial cells[J].InfectImmun,2004,72(4):2452-2455.
[8] ERWIN A L,ALLEN S,HO D K,et al.Role of lgtC in resistance of nontypeableHaemophilusinfluenzaestrain R2866 to human serum[J].InfectImmun,2006,74(11):6226-6235.
[9] HO D K,RAM S,NELSON K L,et al.IgtC expression modulates resistance to C4b deposition on an invasive nontypeableHaemophilusinfluenzae[J].JImmunol,2007,178(2):1002-1012.
[10] GOLEC M.Cathelicidin LL-37:LPS-neutralizing,pleiotropic peptide[J].AnnAgricEnvironMed,2007,14(1):1-4.
[11] PERRY M B,MACLEAN L L,GOTTSCHALK M,et al.Structure of the capsular polysaccharides and lipopolysaccharides fromHaemophilusparasuisstrains ER-6P(serovar 15) and Nagasaki(serovar 5)[J].CarbohydrRes,2013,378:91-97.
[12] HOOD D W,COX A D,WAKARCHUK W W,et al.Genetic basis for expression of the major globotetraose-containing lipopolysaccharide fromH.influenzaestrain Rd(RM118)[J].Glycobiology,2001,11(11):957-967.
[13] HOOD D W,DEADMAN M E,COX A D,et al.Three genes,lgtF,lic2C and lpsA,have a primary role in determining the pattern of oligosaccharide extension from the inner core ofHaemophilusinfluenzaeLPS[J].Microbiology,2004,150(Pt7):2089-2097.
[14] FILIATRAULT M J,GIBSON B W,SCHILLING B,et al.Construction and characterization ofHaemophilusducreyilipooligosaccharide(LOS) mutants defective in expression of heptosyltransferase III and β-1,4-glucosyltransferase:identification of LOS glycoforms containing lactosamine repeats[J].InfectImmun,2000,68(6):3352-3361.
[15] NAITO M,FRIRDICH E,FIELDS J A,et al.Effect of sequentialCampylobacterjejuni81-176 lipooligosaccharide core truncations on biofilm formation,stress survival,and pathogenesis[J].JBacteriol,2010,192(8):2182-2192.
[16] KANIPES M I,TAN X,AKELAITIS A,et al.Genetic analysis of lipooligosaccharide core biosynthesis inCampylobacterjejuni81-176[J].JBacteriol,2008,190(5):1568-1574.
[17] ZHANG B,FENG S,XU C,et al.Serum resistance inHaemophilusparasuisSC096 strain requires outer membrane protein P2 expression[J].FEMSMicrobiolLett,2012,326(2):109-115.
[18] HITCHCOCK P J,BROWN T M.Morphological heterogeneity amongSalmonellalipopolysaccharide chemotypes in silver-stained polyacrylamide gels[J].JBacteriol,1983,154(1):269-277.
[19] TSAI C M,FRASCH C E.A sensitive silver stain for detecting lipopolysaccharides in polyacrylamide gels[J].AnalBiochem,1982,119(1):115-119.
[20] ZHANG B,HE Y,XU C,et al.Cytolethal distending toxin(CDT) of theHaemophilusparasuisSC096 strain contributes to serum resistance and adherence to and invasion of PK-15 and PUVEC cells[J].VetMicrobiol,2012,157(1-2):237-242.
[21] FRIRDICH E,WHITFIELD C.Lipopolysaccharide inner core oligosaccharide structure and outer membrane stability in human pathogens belonging to the Enterobacteriaceae[J].JEndotoxinRes,2005,11(3):133-144.
[22] PLANT L,SUNDQVIST J,ZUGHAIER S,et al.Lipooligosaccharide structure contributes to multiple steps in the virulence ofNeisseriameningitidis[J].InfectImmun,2006,74(2):1360-1367.
[23] ZARANTONELLI M L,HUERRE M,TAHA M K,et al.Differential role of lipooligosaccharide ofNeisseriameningitidisin virulence and inflammatory response during respiratory infection in mice[J].InfectImmun,2006,74(10):5506-5512.
[24] XU C,ZHANG L,ZHANG B,et al.Involvement of lipooligosaccharide heptose residues ofHaemophilusparasuisSC096 strain in serum resistance,adhesion and invasion[J].VetJ,2013,195(2):200-204.
[25] KAHLER C M,CARLSON R W,RAHMAN M M,et al.Two glycosyltransferase genes,lgtF and rfaK,constitute the lipooligosaccharide ice(inner core extension) biosynthesis operon ofNeisseriameningitidis[J].JBacteriol,1996,178(23):6677-6684.
[27] ZHANG B,YU Y,ZENG Z,et al.Deletion of therfaEgene inHaemophilusparasuisSC096 strain attenuates serum resistance,adhesion and invasion[J].MicrobPathog,2014,74:33-37.
[28] ZHANG B,XU C,ZHANG L,et al.Enhanced adherence to and invasion of PUVEC and PK-15 cells due to the overexpression of RfaD,ThyA and Mip in the ΔompP2 mutant ofHaemophilusparasuisSC096 strain[J].VetMicrobiol,2013,162(2-4):713-723.
[29] MOREY P,VIADAS C,EUBA B,et al.Relative contributions of lipooligosaccharide inner and outer core modifications to nontypableHaemophilusinfluenzaepathogenesis[J].InfectImmun, 2013,81(11):4100-4111.
(编辑 白永平)
Construction and Characterization of aHaemophilusparasuisSC096 ΔlgtFMutant Strain
ZENG Ze,HE Huan,YUE Hua,TANG Cheng,ZHANG Bin*
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China)
ThelgtFencodes a glucosyltransferase responsible for adding a glucose to get heptose I in the synthesis of Lipooligosaccharide (LOS).ThelgtFgene is an important virulence-associated gene in some Gram-negative bacteria.However,the function oflgtFgene inHaemophilusparasuiswas still unknown.We constructed an ΔlgtFmutant (ΔlgtF) ofH.parasuisSC096 using a natural transformation system.The LOS ofH.parasuisSC096 strain,ΔlgtFmutant was extracted by the hot phenol-water method.The LOS was addressed by SDS-PAGE and sliver stain.The growth curve,Serum resistance activity,adhesion and invasion ability in porcine kidney epithelial cells (PK-15) and porcine umbilical vein endothelial cells (PUVEC) of wild type SC096 and ΔlgtFmutant were measured.Compared to the wild-type SC096 strain,the ΔlgtFmutant exhibited obvious truncation of LOS structure and slight growth defect.Furthermore,the mutant had a greater sensitivity to the bactericidal action of porcine and rabbit serum (P<0.05),and displayed a significantly reduced ability to adhere to and invade PK-15 and PUVEC (P<0.05).The above findings suggested that thelgtFgene is a virulence-associated gene of theH.parasuisSC096 strain.
Haemophilusparasuis;lgtFgene;mutant;virulence-associated gene
10.11843/j.issn.0366-6964.2015.11.019
2015-03-04
国家自然科学基金(31302119);四川省教育厅项目(14ZB046);公益性行业(农业)科研专项(201303034-1);西南民族大学中央高校基本科研业务费专项(2014NZYQN42)
曾 泽(1991-),女,贵州毕节人,硕士生,主要从事动物病原分子生物学,E-mail:839017291@qq.com
*通信作者:张 斌,副研究员,E-mail:binovy@sina.com
S852.613
A
0366-6964(2015)11-2056-07
