猪肾细胞源三种蛋白质对猪圆环病毒2型复制的调节作用
2015-03-22唐青海黄立平危艳武刘长明
张 辉,唐青海,黄立平,危艳武,刘长明*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/猪传染病研究室,哈尔滨 150001;2.南阳师范学院 南阳市兽医生物工程技术研究中心/昆虫生物反应器河南省工程实验室,南阳 473061)
猪肾细胞源三种蛋白质对猪圆环病毒2型复制的调节作用
张 辉1,唐青海2*,黄立平1,危艳武1,刘长明1*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/猪传染病研究室,哈尔滨 150001;2.南阳师范学院 南阳市兽医生物工程技术研究中心/昆虫生物反应器河南省工程实验室,南阳 473061)
为了验证猪肾细胞系(PK-15)源3种蛋白质基因(AP2α2、Elf4和ISCU)表达水平对猪圆环病毒2型(PCV2)复制的调节作用,采用RT-PCR扩增这3种蛋白质编码基因,构建真核表达载体;同时设计这3种蛋白质的RNAi片段,分别插入到pGPU6-GFP载体构建shRNA干扰载体。以荧光定量PCR法检测干扰效率,选取干扰效率较高的干扰载体,利用G418筛选转染真核表达载体或干扰载体后的PK-15细胞。采用酶联免疫吸附试验(ELISA)和免疫过氧化物酶单层细胞试验(IPMA)法检测PCV2 LG毒株在这些细胞中的复制效率。结果表明,Elf4蛋白和ISCU蛋白基因过表达能够显著增强PCV2的复制;而AP2α2蛋白基因过表达对PCV2的复制无显著影响。AP2α2、ISCU和Elf4这3种蛋白质基因被干扰表达后均可降低PCV2复制效率,表明这3种宿主细胞蛋白质对该病毒复制具有调节作用。
猪圆环病毒2型;复制;AP2α2;Elf4;ISCU
猪圆环病毒2型(porcine circovirus type 2,PCV2)是断奶后多系统消耗综合征(PMWS)、皮炎和肾炎综合征的主要病原[1-4]。PCV2基因组是一个环状的、长约1.7 kb单链DNA。病毒基因组包含2个主要开放阅读框(ORFs)起始于两个相反的方向,其中ORF1位于正链编码两个复制蛋白(Rep和Rep’),对通过滚环复制机制进行复制的病毒是必须的[5-6],而ORF2编码衣壳蛋白(Cap)是病毒唯一的结构成分和主要免疫原[7-11]。由于病毒基因组小,编码能力有限,因此病毒复制循环依赖于宿主细胞酶类;Rep和Cap蛋白可能不仅分别具有复制酶和病毒包装的功能,在病毒与宿主之间相互作用机制中起重要作用。I.Tischer等[12]报道PCV复制具有细胞周期依赖性的,其DNA复制发生在细胞周期的S期。E.Steiner等[13]试验表明PCV2复制效率和细胞自身的DNA复制无关。Q.Tang等[14]研究发现,PCV2的复制依赖于细胞周期S期和G2/M期,S期主要调节蛋白质Cyclin A的过表达能够抑制PCV2的复制。S.Timmusk等[15]确定转录调节因子c-myc和中间丝蛋白(类似于人类的肌肉萎缩蛋白)与PCV2 Rep相互作用。这些数据说明,宿主分子参与了PCV2基因组的复制调节过程。
作者此前采用酵母单杂交技术从PK-15细胞cDNA文库中筛选到一组与PCV2基因组颈环结构序列相互作用的宿主蛋白质[16]。在此基础上,本试验拟克隆其中3种蛋白质基因——猪配体相关的蛋白复合体α2亚基AP2α2(adaptor-related protein complex 2,alpha 2 subunit)、ETS相关的转录因子 Elf4(ETS-related transcription factor,Elf4)和铁硫簇组装酶ISCU(iron-sulfur cluster assembly enzyme,ISCU)基因,阐明这3种基因表达水平与PCV2复制效率之间的关系,为进一步研究PCV2的复制、致病性与宿主细胞蛋白质之间的作用提供科学依据。
1 材料与方法
1.1 细胞、毒株、质粒及主要试剂
猪肾细胞系(PK-15)用于PCV2增殖,细胞培养液为MEM营养液,含10%灭活胎牛血清,青、链霉素100 U(μg)·mL-1。PCV2 LG株、PCV2阳性、阴性血清和单克隆抗体(mAb)1D2为本实验室保存。pEGFP-C1真核细胞表达载体购自Clontech(Mountain View,CA,USA),大肠杆菌DH5α细胞购自天根生物技术(北京)有限公司。SYBR real-time PCR 试剂盒和PrimeScript II 1st Strand cDNA Synthesis 试剂盒购自宝生物工程(大连)有限公司。
1.2 基因克隆与序列分析
采用Trizol法提取PK-15细胞的总RNA,取2 μg总RNA,采用Prime Script Ⅱ First Strand cDNA Synthesis Kit 合成第一链cDNA。取2 μL产物采用引物AP2α2 F1/R1[根据AP2α2基因序列(GenBank No.XR_242779.2)设计]、Elf4 F/R[根据猪的Elf4基因序列(GenBank No.XM_005673902.1)设计]和ISCU F1/R1[根据猪的ISCU基因序列(GenBank No.XM_005674454.1)设计]进行PCR扩增(表1)。PCR产物经纯化后克隆至pMD18T载体,转化DH5α感受态细胞进行抗性筛选,重组质粒进行酶切鉴定和序列测定。通过GenBank中的BLAST进行核酸序列比对分析。
1.3 重组真核表达质粒的构建
根据重组质粒pMD18T-AP2α2、pMD18T- Elf4和pMD18T-ISCU基因序列分别设计3对引物AP2α2-f1/r1、Elf4-f1/r1和ISCU-f1/r1(表1),引物由北京六合华大基因科技股份有限公司合成。利用AP2α2-f1/r1、Elf4-f1/r1和ISCU-f1/r1分别扩增AP2α2、Elf4和ISCU三个基因的开放阅读框(ORF)。将PCR产物及pEGFP-C1质粒经SalⅠ和BamHⅠ双酶切后胶回收,T4连接酶连接后转化DH5α感受态细胞,将AP2α2和ISCU基因分别克隆至pEGFP-C1载体;将PCR产物及pEGFP-C1经SalⅠ和SmaⅠ双酶切后胶回收,T4连接酶连接转化DH5α感受态细胞,将Elf4基因克隆至pEGFP-C1载体,获得重组真核表达质粒pEGFP-AP2α2、pEGFP-Elf4和pEGFP-ISCU。重组质粒经双酶切和测序分析鉴定。
表1 PCR引物寡核苷酸序列设计及反应条件
Table 1 Oligonucleotide sequences of PCR primer and reaction conditions
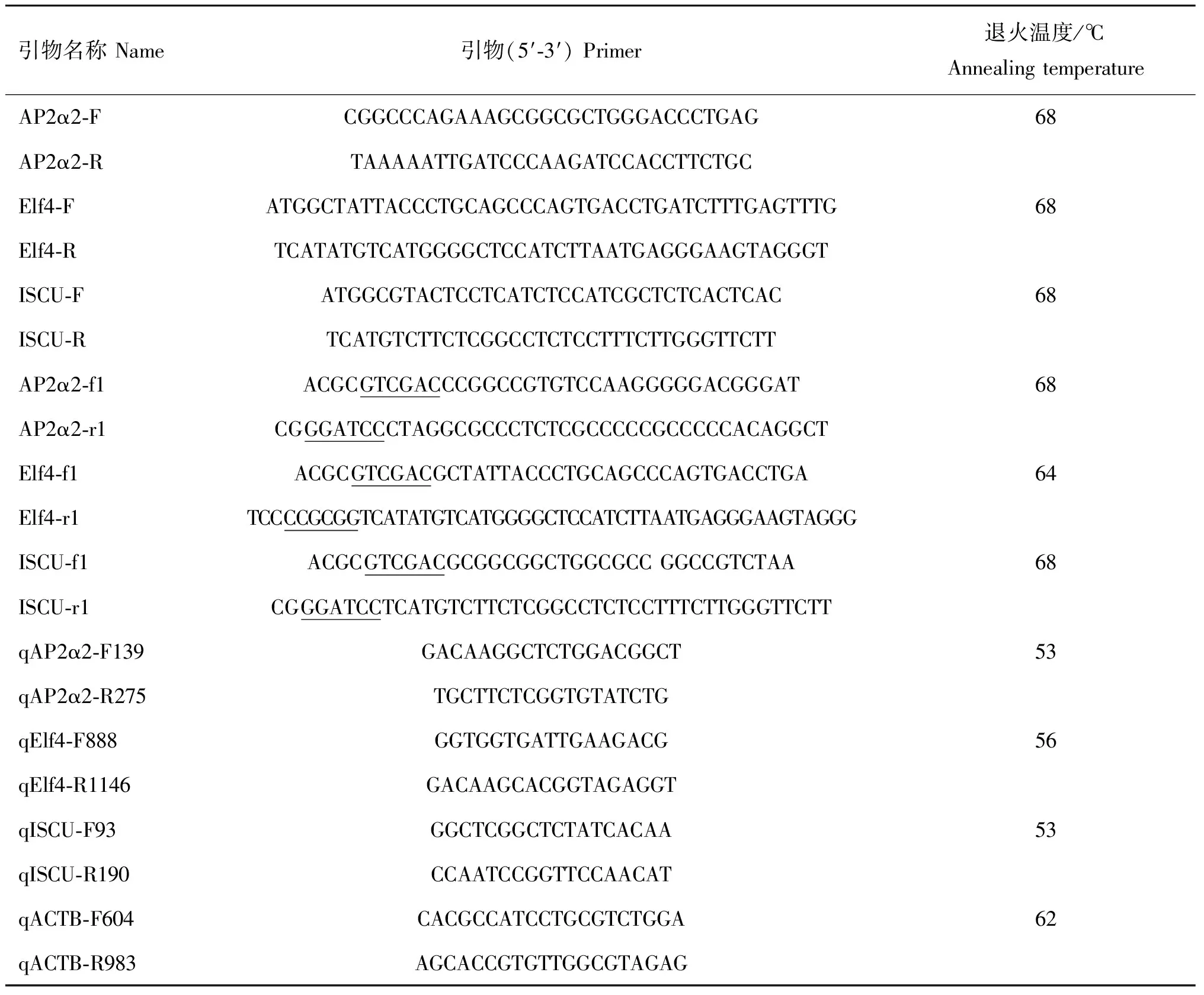
引物名称Name引物(5′⁃3′)Primer退火温度/℃AnnealingtemperatureAP2α2⁃FCGGCCCAGAAAGCGGCGCTGGGACCCTGAG68AP2α2⁃RTAAAAATTGATCCCAAGATCCACCTTCTGCElf4⁃FATGGCTATTACCCTGCAGCCCAGTGACCTGATCTTTGAGTTTG68Elf4⁃RTCATATGTCATGGGGCTCCATCTTAATGAGGGAAGTAGGGTISCU⁃FATGGCGTACTCCTCATCTCCATCGCTCTCACTCAC68ISCU⁃RTCATGTCTTCTCGGCCTCTCCTTTCTTGGGTTCTTAP2α2⁃f1ACGCGTCGACCCGGCCGTGTCCAAGGGGGACGGGAT68AP2α2⁃r1CGGGATCCCTAGGCGCCCTCTCGCCCCCGCCCCCACAGGCTElf4⁃f1ACGCGTCGACGCTATTACCCTGCAGCCCAGTGACCTGA64Elf4⁃r1TCCCCGCGGTCATATGTCATGGGGCTCCATCTTAATGAGGGAAGTAGGGISCU⁃f1ACGCGTCGACGCGGCGGCTGGCGCCGGCCGTCTAA68ISCU⁃r1CGGGATCCTCATGTCTTCTCGGCCTCTCCTTTCTTGGGTTCTTqAP2α2⁃F139GACAAGGCTCTGGACGGCT53qAP2α2⁃R275TGCTTCTCGGTGTATCTGqElf4⁃F888GGTGGTGATTGAAGACG56qElf4⁃R1146GACAAGCACGGTAGAGGTqISCU⁃F93GGCTCGGCTCTATCACAA53qISCU⁃R190CCAATCCGGTTCCAACATqACTB⁃F604CACGCCATCCTGCGTCTGGA62qACTB⁃R983AGCACCGTGTTGGCGTAGAG
引物AP2α2-f1、Elf4-f1和ISCU-f1下划线序列均为SalⅠ酶切位点,AP2α2-r1和ISCU-r1下划线序列为BamHⅠ酶切位点,Elf4-r1下划线序列为SmaⅠ酶切位点
Primer sequences underlined for AP2α2-f1,Elf4-f1 and ISCU-f1 areSalⅠenzyme recognize sites,for AP2α2-r1 and ISCU-r1 areBamH Ⅰ enzyme recognize sites,for Elf4-r1 areSmaⅠ enzyme recognize sites
1.4 shRNA表达质粒的构建
为了抑制PK-15细胞中Elf4、AP2α2和ISCU内源基因的表达,根据AP2α2、Elf4和ISCU基因序列在苏州基因制药公司Co.,Ltd(苏州)分别设计了3个shRNA表达质粒。将这3个基因片段(AP2α2-179-200、AP2α2-845-865、AP2α2-1511-1531、Elf4-47-67、Elf4-156-176、Elf4-906-927、ISCU-99-119和ISCU-292-312)分别克隆至pGPU6-GFP载体构建shRNA表达质粒pGPU6-GFP/AP2α2-179、pGPU6-GFP/AP2α2-845、pGPU6-GFP/AP2α2-1511、pGPU6-GFP/Elf4-47、pGPU6-GFP/Elf4-156、pGPU6-GFP/Elf4-906、pGPU6-GFP/ISCU-292和pGPU6-GFP/ISCU-99,插入的序列见表2。
1.5 细胞转染与稳定表达细胞系的建立
将处于指数生长期的PK-15细胞接种于6孔板,待细胞汇合度达到50%~60%时,更换新鲜的MEM 培养液,2 h后根据说明书将重组质粒通过转染试剂TurboFect(Fermentas,Glen Burnie,MD,USA)转染至PK-15细胞,将8 μL的转染试剂加到4 μg溶解的DNA中轻轻混匀,室温孵育20 min,加入到细胞中。转染48 h 后,以适当密度传代(1∶8~1∶10比例),并加入终质量浓度为1 500 μg·mL-1抗生素G418细胞培养液,连续培养。间隔2 d 更换含相同质量浓度的G418 细胞培养液1次,观察细胞生长及死亡情况。同设未转染的健康细胞为对照。待对照孔的细胞全部死亡后,将具有G418 抗性的阳性细胞持续在含有终浓度为800 μg·mL-1G418的培养液中传代培养20 d。荧光倒置显微镜下观察绿色荧光蛋白表达情况。
表2 干扰表达质粒中的插入序列
Table 2 Inserted sequences in shRNA-expressing plasmids

载体名称Plasmids插入序列(5′⁃3′)Inserts(5′⁃3′)pGPU6⁃GFP/AP2α2⁃179CACCGCAAGCTGCTCTTCATCTTCCTTCAAGAGAGGAAGATGAAGAGCAGC⁃TTGCTTTTTTGpGPU6⁃GFP/AP2α2⁃845CACCGCCTGGAGACGATTCTGAACATTCAAGAGATGTTCAGAATCGTCTCCA⁃GGCTTTTTTGpGPU6⁃GFP/AP2α2⁃1511CACCGGGAGTTTGGGAACTTGATAGTTCAAGAGACTATCAAGTTCCCAAACT⁃CCCTTTTTTGpGPU6⁃GFP/Elf4⁃47CACCGCAACGGGAATGGATGACATCCTTCAAGAGAGGATGTCAGTCCATTC⁃CGTTGCTTTTTTGpGPU6⁃GFP/Elf4⁃156CACCGCTGGACGATGTTCACAATGGTTCAAGAGACCATTGTTGAACATCGTC⁃CAGCTTTTTTGpGPU6⁃GFP/Elf4⁃906CACCGGACGAGAGAAGCGAAGTTACTTCAAGAGAGTAACTTCGCTTCTCTCG⁃TCCTTTTTTGpGPU6⁃GFP/shNCCACCGTTCTCCGAACGTGTCACGTCAAGAGATTACGTGACACGTTCGGAGAA⁃TTTTTTGpGPU6⁃GFP/ISCU⁃99CACCGCTCTATCACAAGAAGGTTGTTTCAAGAGAACAACCTTCTTGTGATAG⁃AGCTTTTTTGpGPU6⁃GFP/ISCU⁃292CACCGCAATTGCCTCCAGCTCATTATTCAAGAGATAATGAGCTGGAGGCAA⁃TTGCTTTTTTG
1.6 Western blot检测
以真核表达载体pEGFP-AP2α2、pEGFP-Elf4和pEGFP-ISCU转染PK-15细胞,经G418筛选后,取细胞经PBS洗3次;加入裂解液,200 μL·孔-1,37 ℃孵育15 min;将裂解产物12 000 g离心5 min;取上清样品进行SDS-PAGE电泳后转印硝酸纤维素膜上;用2%脱脂乳-PBS溶液封闭2 h;PBS-T(含0.05%Tween-20的0.01 mol·L-1PBS,pH7.2)洗膜3次,加入一抗(按1∶10 000比例用0.01 mol·L-1PBS稀释的抗GFP标签的单抗),在摇床上孵育1 h;弃一抗用PBS-T洗膜3次; 加入二抗(按1∶5 000比例用0.01 mol·L-1PBS稀释的DyLightTM羊抗鼠IgG)避光孵育1 h,用PBS-T洗膜3次;采用Odyssey Infrared Imaging System系统显示结果。
1.7 总RNA提取与荧光定量PCR
收集瞬时转染shRNA表达质粒的细胞,根据使用说明书采用TRIzol-苯酚-氯仿提取法分离总RNA。为了定量AP2α2、Elf4和ISCU的mRNA,使用PrimeScript II 1st Strand cDNA Synthesis试剂盒将2 μg的总RNA反转录成单链cDNA。使用SYBR real-time PCR 试剂盒在荧光定量PCR系统上对cDNA进行荧光定量PCR,PCR程序:95 ℃ 10 s,52 ℃ 20 s,40个循环;95 ℃ 5 min。每个样品通过与猪持家基因β-actin的阈值(Ct)的比值来标准化基因组含量。设计引物qAP2α2-F139/R275、qElf4-F888/R1146、qISCU-F93/R190和qACTB-F604/R983分别扩增AP2α2、Elf4、ISCU和β-actin,引物序列见表1。
1.8 过表达与抑制表达细胞系对病毒增殖影响测定
以构建的过表达细胞系pEGFP-AP2α2、pEGFP-Elf4和 pEGFP-ISCU,抑制表达细胞系 pGPU6-GFP/AP2α2-1511、pGPU6-GFP/Elf4-906和pGPU6-GFP/ISCU-99及对照组pGPU6-GFP/shNC、pEGFP-C1细胞系和PK-15细胞分别与感染复数(moi)为1个TCID50/cell的PCV2 LG株,于37 ℃孵育96 h,细胞培养物反复冻融3次,离心去除细胞碎片,收集上清测定毒价。参考文献[17],用捕获ELISA(一抗采用抗PCV2 Cap蛋白的1D2单抗)在405 nm波长下测定吸光光度值定量PCV2 LG的浓度;参考文献[18],在PK-15细胞中通过IPMA方法测定。
1.9 数据统计分析
试验数据均采用SPSS11.5软件进行平均值、标准差和差异显著性计算分析,差异显著水平为*,P<0.05,差异显著水平为**,P<0.01。
2 结 果
2.1 目的基因的扩增
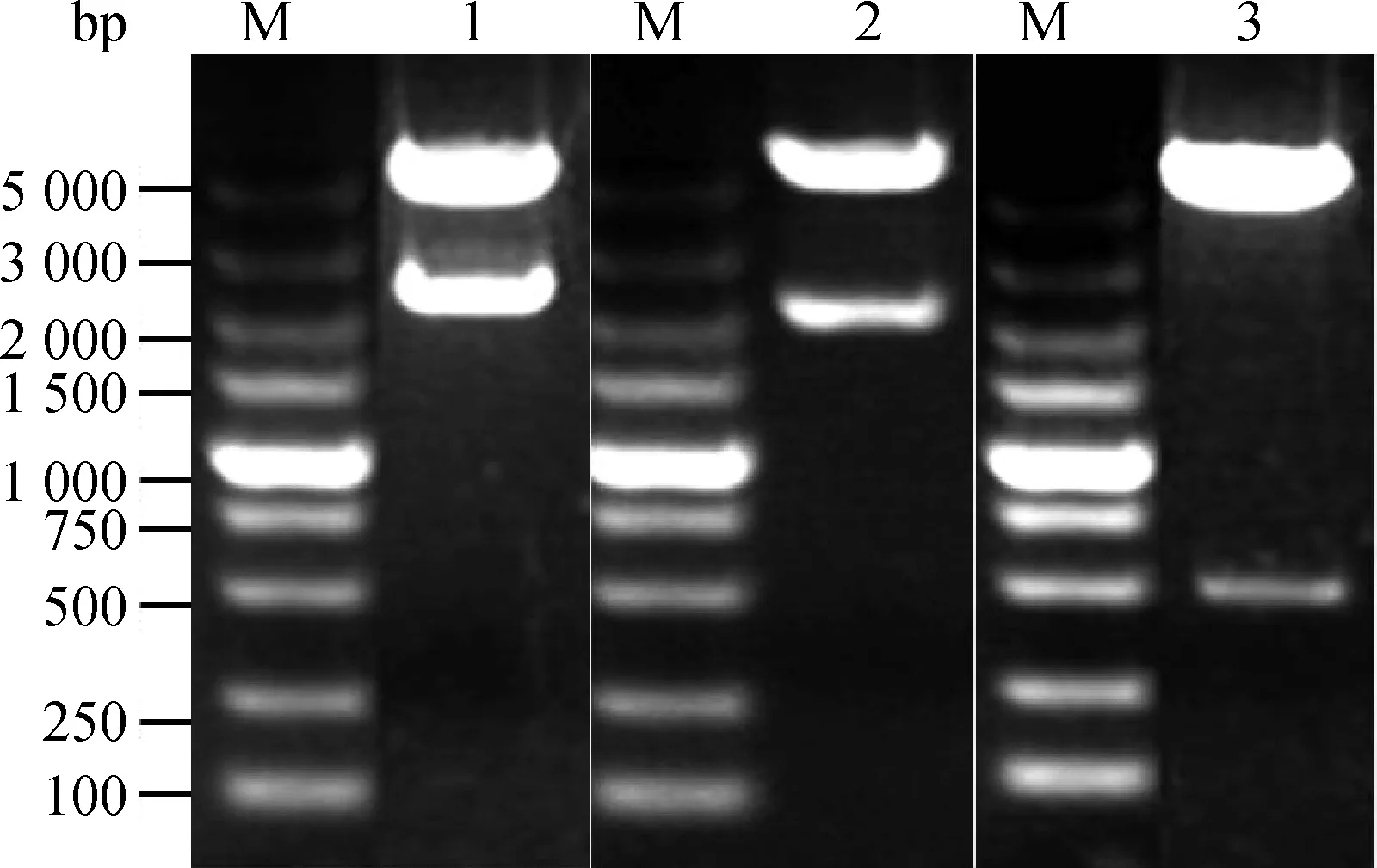
以PK-15细胞cDNA为模板,用PCR扩增出这3种蛋白质基因产物(AP2α2、Elf4和ISCU)与预期大小2 601、1 989和919 bp相一致,如图1显示的特异性条带,表明获得了这3个蛋白质的编码基因。

M.DNA相对分子质量标准;1.AP2α2基因;2.Elf4基因;3.ISCU 基因M.DNA marker;1.AP2α2 gene;2.Elf4 gene;3.ISCU gene图1 AP2α2、Elf4和ISCU基因的RT-PCR扩增Fig.1 Amplification of AP2α2,Elf4 and ISCU genes by RT-PCR
2.2 重组真核表达载体的鉴定
重组载体pEGFP-AP2α2、pEGFP-Elf4和pEGFP-ISCU 双酶切和凝胶电泳图谱表明,从重组质粒中切下了与AP2α2、Elf4和ISCU序列长度一致的片段(图2),表明目的基因成功克隆至pEGFP载体。测序结果表明,克隆的AP2α2蛋白基因编码的氨基酸序列与GenBank下载序列No.XM_003122395.3同源性比对显示(图3A):第20位氨基酸异亮氨酸突变为苏氨酸;68位氨基酸序列缺失谷氨酸;805位氨基酸后插入17个氨基酸序列。克隆的Elf4蛋白基因编码的氨基酸序列与GenBank下载的序列No.XP_003135417.1同源性比对,仅发生3处单个氨基酸突变:213位氨基酸苯丙氨酸突变为丝氨酸;392位氨基酸苏氨酸突变为异亮氨酸;603位组氨酸突变为精氨酸(图3B)。克隆的ISCU蛋白基因序列与GenBank下载的No.XP_003359187.1完全一致(图3C)。
M.DNA相对分子质量标准;1.重组载体pEGFP-AP2α2经Sal Ⅰ和BamHⅠ双酶切;2.重组载体pEGFP-Elf4经SalⅠ和SmaⅠ双酶切;3.重组载体pEGFP-ISCU经SalⅠ和SmaⅠ双酶切M.DNA marker;1.Recombinant plasmid pEGFP-AP2α2 digested by SalⅠ and BamHⅠ;2.Recombinant plasmid pEGFP-Elf4 digested by SalⅠ and SmaⅠ;3.Recombinant plasmid pEGFP-ISCU digested by SalⅠ and SmaⅠ图2 重组表达载体pEGFP-AP2α2、pEGFP-Elf4和pEGFP-ISCU的双酶切鉴定Fig.2 Identification of the recombinant plasmid of pEGFP-AP2α2,pEGFP-Elf4 and pEGFP-ISCU by enzymes digestion
2.3 AP2α2、Elf4和ISCU蛋白质表达的Western blot检测
将重组载体pEGFP-AP2α2、pEGFP-Elf4和pEGFP-ISCU转染PK-15细胞,经G418筛选后得到稳定表达AP2α2、Elf4和ISCU 的细胞系。Western blot检测表明,AP2α2、Elf4、ISCU和EGFP融合蛋白质的相对分子质量大小依次约为120、100和46 ku(图4)。而EGFP大小约为30 ku,推断猪AP2α2、Elf4和ISCU蛋白质大小依次为90、70和16 ku。
2.4 shRNA干扰效果分析
采用荧光定量PCR检测AP2α2、Elf4和ISCU的干扰效率,pGPU6-GFP/AP2α2-179、pGPU6-GFP/AP2α2-845和pGPU6-GFP/AP2α2-1511细胞中AP2α2 mRNA的相对转录量依次为1.0、0.7和0.5(图5A),其中pGPU6-GFP/AP2α2-1511的干扰效率为50%;pGPU6-GFP/Elf4-47、pGPU6-GFP/Elf4-156和pGPU6-GFP/Elf4-906细胞中Elf4 mRNA的相对转录量依次为0.23、1.0和0.15(图5B),其中pGPU6-GFP/Elf4-47和pGPU6-GFP/Elf4-906的干扰效率分别为77%和85%; pGPU6-GFP/ISCU-99和pGPU6-GFP/ISCU-292细胞中ISCUmRNA的相对转录量分别为0.30和0.39(图5C),二者的干扰效率分别为70%和61%。因此分别选取干扰效率较高的pGPU6-GFP/APα2-1511、pGPU6-GFP/Elf4-906和pGPU6-GFP/ISCU-99 shRNA转染PK-15细胞,经G418筛选后得到稳定抑制转录AP2α2、Elf4和ISCU的细胞系。

A~C.AP2α2、Elf4 和 ISCU推导蛋白质序列依次与GenBank参考序列比对A-C.Results of comparisons of amino acid sequence (AP2α2,Elf4 and ISCU ) with the reference sequences from GenBank,respectively图3 AP2α2、Elf4和ISCU蛋白质氨基酸序列比对Fig.3 Comparisons of amino acid sequence of AP2α2,Elf4 and ISCU
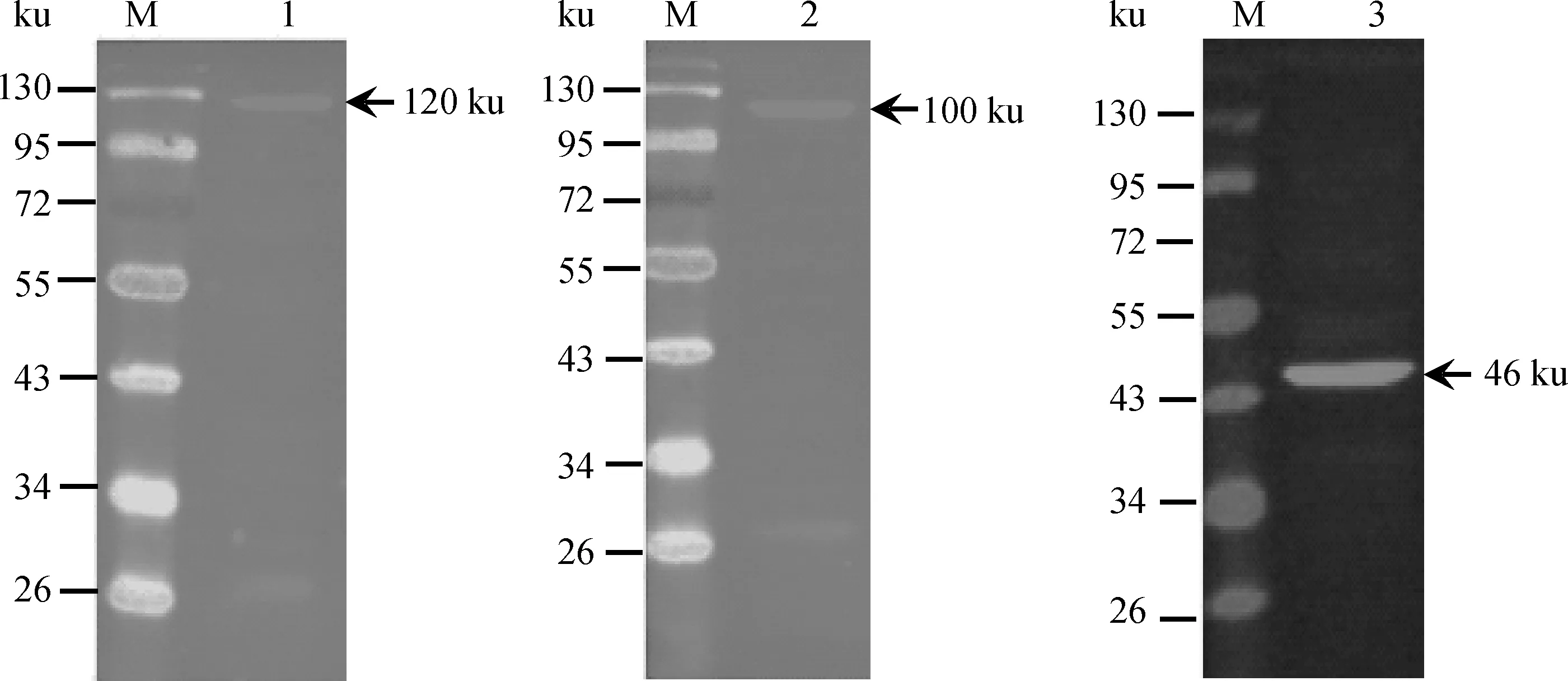
M.蛋白质相对分子质量标准; 1~3.融合蛋白EGFP-AP2α2、EGFP-Elf4和EGFP-ISCUM.Protein marker;1-3.EGFP-AP2α2,EGFP-Elf4 and EGFP-ISCU fusion proteins,respectively图4 稳定细胞系中EGFP-EAP2α2、EGFP-Elf4和EGFP-ISCU融合蛋白质表达的Western blot鉴定Fig.4 Identification of fusion protein EGFP-AP2α2,EGFP-Elf4 and EGFP-ISCU expressed in stable cell lines by Western blot
2.5 三种蛋白质过表达对PCV2复制的影响
采用IPMA和ELISA方法检测PCV2 LG毒株在不同细胞株中的增殖效率,如图6所示,PCV2 LG的复制效率在转染pEGFP-ISCU的细胞系中极显著增强 (P<0.01),转染pEGFP-Elf4后的细胞系中也有显著增加(P<0.05)。而相对于对照组PK-15和pEGFP-C1细胞系,AP2α2的过表达对PCV2 LG的复制没有显著影响。
2.6 三种蛋白质沉默表达对PCV2复制的影响
ELISA和IPMA检测结果(图7)均显示,AP2α2和ISCU沉默表达均能极显著地抑制PCV2 LG的增殖(P<0.01);如图7A所示,相对于对照组PK-15和pGPU6-GFP/shNC,抑制Elf4的表达并没有影响PCV2 LG的复制水平,而IPMA测定结果显示,PCV2 LG在上述干扰细胞中的复制效率均极显著降低(P<0.01) (图7B)。
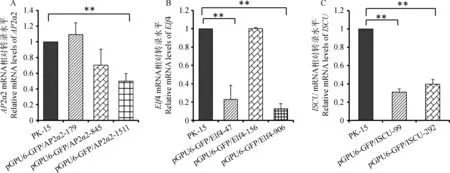
A~C.AP2α2 mRNA、Elf4 mRNA和ISCU mRNA在不同shRNA干扰细胞系中的相对转录量A-C.AP-2α2 mRNA,Elf4 mRNA and ISCU mRNA levels in different shRNA expression cell lines图5 shRNA干扰细胞系中mRNA的相对转录量Fig.5 Relative mRNA levels in different shRNA expression cell lines
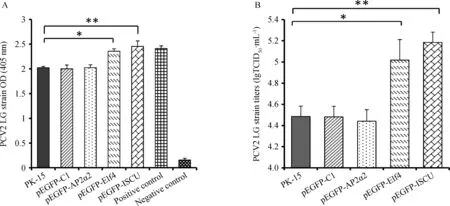
A.捕获ELISA方法测定PCV2 LG的含量;B.IPMA方法测定PCV2 LG毒价A.Detection of PCV2 LG by capture-ELISA; B.Titration of PCV2 LG by IPMA图6 过表达AP2α2、Elf4或ISCU后对PCV2复制的影响Fig.6 The effect of AP2α2,Elf4 or ISCU overexpression on PCV2 propagation
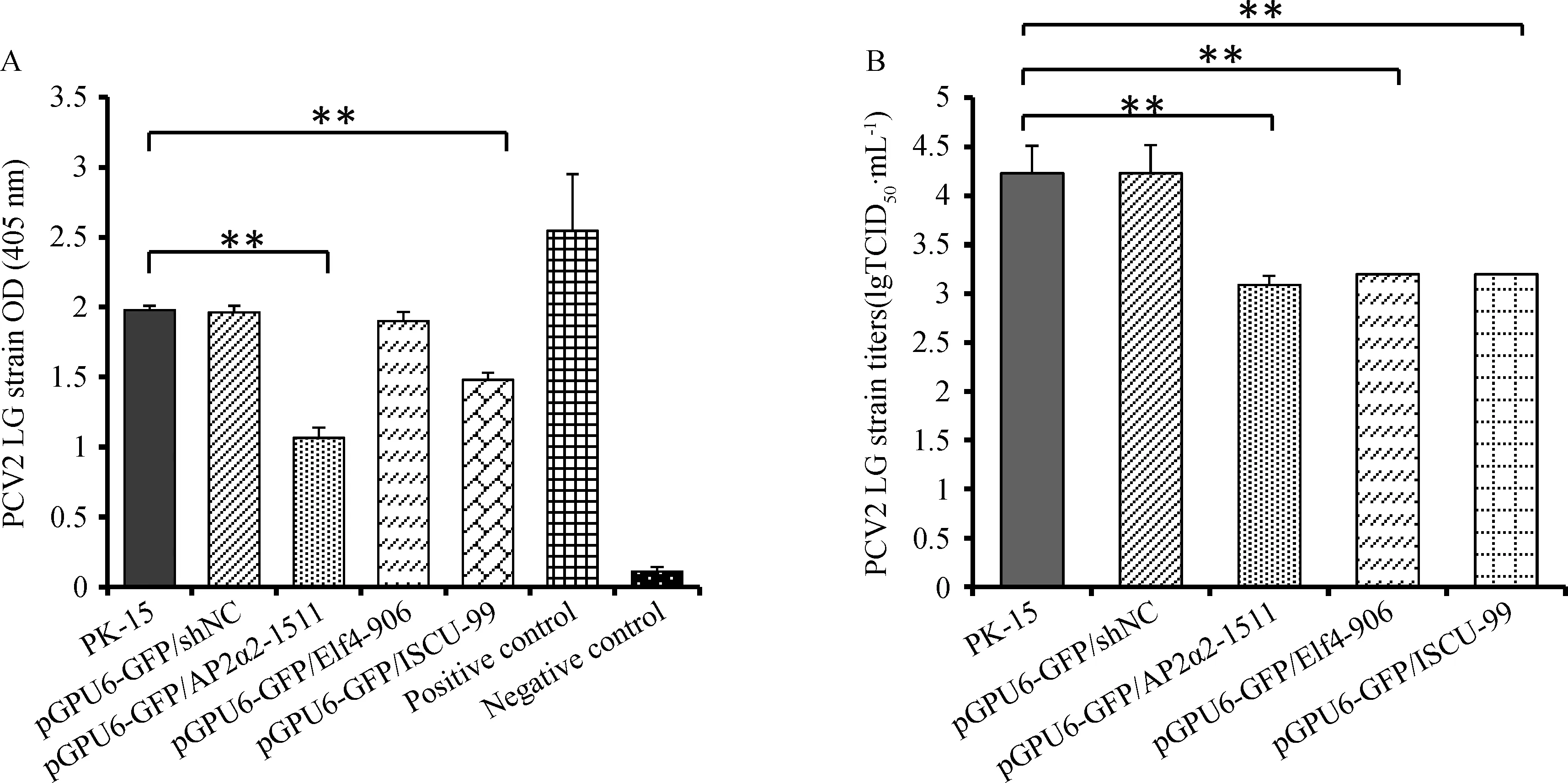
A.ELISA方法测定PCV2 LG的含量;B.IPMA捕获方法测定PCV2 LG的毒价A.Detection of PCV2 LG by capture-ELISA; B.Titration of PCV2 LG by IPMA图7 AP2α2、Elf4或者ISCU沉默表达对PCV2复制的影响Fig.7 The influence of AP2α2,Elf4 or ISCU down-regulation by shRNA on PCV2 propagation efficiency
3 讨 论
鉴于PCV2基因组小,编码蛋白质能力有限,推测该病毒复制需要宿主细胞源酶类分子的参与,究竟哪些蛋白质参与其中尚不清楚。前期以酵母单杂交技术筛选出3种PK-15细胞源宿主蛋白质(AP2α2、ETS-4和ISCU)与PCV2基因组颈环结构序列相互作用。为进一步阐明这3种蛋白质基因表达水平对PCV2复制调节的作用,本研究从PK-15细胞中克隆AP2α2、Elf4和ISCU基因,构建针对AP2α2、Elf4和ISCU基因的过表达和抑制表达细胞系,旨在阐明这3种蛋白质编码基因的表达水平与PCV2复制的相关性。
PCV2在过表达细胞系pEGFP-AP2α2和抑制表达细胞系pGPU6-GFP/AP2α2-1511中的增殖滴度检测结果表明,AP2α2蛋白在PK-15细胞中过表达对PCV2复制影响不显著;而采用shRNA降低细胞内源性AP2α2的表达量,干扰病毒复制效率达50%以上,极显著地抑制了PCV2复制(P<0.01)。AP2蛋白复合体含有4个亚基(α2、β2、μ2和σ2),其主要功能是作为配体将受体蛋白与网格蛋白连接,在细胞内物质转运中起重要作用[19]。AP2α已被证明能够负调节1型人免疫缺陷病毒(HIV-1)的复制效率,采用siRNA干扰AP2α的表达能够显著上调HIV的复制,这可能与该蛋白质妨碍了HIV基因组DNA正常进入细胞核有关[20],且AP2α介导的HIV复制调控可能与未知的HIV-1基因组的DNA片段有关[21]。R.Chaudhuri等发现,HIV-1 Nef蛋白与AP2-网格蛋白互作加速CD4内吞,从而下调巨噬细胞和T细胞受体CD4的表达,这是激发HIV-1感染者转变为AIDS的重要原因之一[22]。其过表达对PCV2的复制没有影响,被干扰后反而有抑制作用。据此推测,该蛋白质可能与PCV2基因组的转运相关,可能是AP2α2负责将PCV2基因组由细胞质转运到细胞核。正常情况下,一定数量病毒感染细胞后,细胞内AP2α2足够把溶酶体中脱去衣壳蛋白的PCV2裸露DNA运输到细胞核中,一旦被RNAi之后,其运输能力受限,导致PCV2复制被抑制。
PCV2在Elf4蛋白过表达细胞系中的复制显著增强。反之,以shRNA沉默细胞内源性Elf4蛋白表达,干扰病毒复制效率达85%以上,表明PCV2的复制被显著抑制。采用ELISA方法检测结果表明,PCV2的复制没有受到显著影响。Elf4是一个转录激活因子,能够起始多种基因的转录,该蛋白质还与自然杀伤细胞的形成和天然免疫功能有关[23]。最近研究发现,Elf4在Ⅰ型干扰素IFNα/β应答反应中起重要调节作用[24],这对机体的抗病毒感染防御十分重要[25]。Rep蛋白是PCV2基因组复制的主要复制酶[6,26-27],有报道表明,干扰PCV2和PCV1Rep基因后,病毒在PK-15细胞中的增殖能力显著下降[28]。综合本研究数据,作者推测Elf4蛋白功能有可能是通过促进PCV2 Rep蛋白的转录作用来提高PCV2复制效率。令人感兴趣的是,鉴于ELISA测定值代表Cap蛋白含量,不是感染性的病毒粒子,推测Cap蛋白的转录与Elf4蛋白表达量无关。
PK-15细胞源ISCU蛋白过表达能够显著增强PCV2复制;而采用shRNA降低细胞内源性ISCU的表达量,干扰病毒复制效率达70%以上,表明其能够极显著地抑制PCV2复制。ISCU为铁硫簇组装酶,属于一种金属酶,它在电子传递、底物结合与激活等方面起关键作用,且参与基因表达的转录和翻译调控[29-30]。T.Finsterbusch等研究证明有3种宿主细胞蛋白质(ZNF265、TDG和VG5Q)与Rep蛋白发生互作,这些蛋白质与病毒基因转录调节相关[31]。据此推测,ISCU蛋白可能直接调控PCV2基因的转录,亦可能通过催化、调节Rep蛋白的酶活性实现PCV2 复制的调控。
本研究阐明了PK-15细胞源AP2α2、Elf4和ISCU3个基因表达量对PCV2复制的调节作用,三者可能在PCV2复制过程中不同的关键环节以不同的方式进行调控,具体调节分子机制需要进一步研究。
[1] GRAU-ROMA L,CRISCI E,SIBILA M,et al.A proposal on porcine circovirus type 2 (PCV2) genotype definition and their relation with postweaning multisystemic wasting syndrome (PMWS) occurrence[J].VetMicrobiol,2008,128(1-2):23-35.
[2] AN D J,ROH I S,SONG D S,et al.Phylogenetic characterization of porcine circovirus type 2 in PMWS and PDNS Korean pigs between 1999 and 2006[J].VirusRes,2007,129(2):115-122.
[3] THOMSON J,SMITH B,ALLAN G,et al.PDNS,PMWS and porcine circovirus type 2 in Scotland.Porcine dermatitis and nephropathy syndrome.Post-weaning multisystemic wasting syndrome[J].VetRec,2000,146(22):651-652.
[4] SEGALÉS J,SITJAR M,DOMINGO M,et al.First report of post-weaning multisystemic wasting syndrome in pigs in Spain[J].VetRec,1997,141(23):600-601.
[5] CHEUNG A K.A stem-loop structure,sequence non-specific,at the origin of DNA replication of porcine circovirus is essential for termination but not for initiation of rolling-circle DNA replication[J].Virology,2007,363(1):229-235.
[6] STEINFELDT T,FINSTERBUSCH T,MANKERTZ A.Rep and Rep′ protein of porcine circovirus type 1 bind to the origin of replicationinvitro[J].Virology,2001,291(1):152-160.
[7] DING J,ZHANG C,GAO M,et al.Enhanced porcine circovirus Cap protein production by Pichia pastoris with a fuzzy logic DO control based methanol/sorbitol co-feeding induction strategy[J].JBiotechnol,2014,177:35-44.
[8] FORT M,SIBILA M,NOFRARAS M,et al.Porcine circovirus type 2 (PCV2) Cap and Rep proteins are involved in the development of cell-mediated immunity upon PCV2 infection[J].VetImmunolImmunopathol,2010,137(3-4):226-234.
[9] MARTELLI P,FERRARI L,MORGANTI M,et al.One dose of a porcine circovirus 2 subunit vaccine induces humoral and cell-mediated immunity and protects against porcine circovirus-associated disease under field conditions[J].VetMicrobiol,2011,149(3-4):339-351.
[10] NAWAGITGUL P,MOROZOV I,BOLIN S R,et al.Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J].JGenVirol,2000,81(Pt 9):2281-2287.
[11] WANG Y,LU Y,LIU D,et al.Enhanced Th1-biased immune efficacy of porcine circovirus type 2 Cap-protein-based subunit vaccine when coadministered with recombinant porcine IL-2 or GM-CSF in mice[J].ApplMicrobiolBiotechnol,2015,99(3):1155-1163.
[12] TISCHER I,PETERS D,RASCH R,et al.Replication of porcine circovirus:induction by glucosamine and cell cycle dependence[J].ArchVirol,1987,96(1-2):39-57.
[13] STEINER E,BALMELLI C,HERRMANN B,et al.Porcine circovirus type 2 displays pluripotency in cell targeting[J].Virology,2008,378(2):311-322.
[14] TANG Q,LI S,ZHANG H,et al.Correlation of the cyclin A expression level with porcine circovirus type 2 propagation efficiency[J].ArchVirol,2013,158(12):2553-2560.
[15] TIMMUSK S,FOSSUM C,BERG M.Porcine circovirus type 2 replicase binds the capsid protein and an intermediate filament-like protein[J].JGenVirol,2006,87(Pt 11):3215-3223.
[16] 张 辉,唐青海,危艳武,等.与猪圆环病毒2型基因组茎环结构相互作用的宿主细胞蛋白的筛选[J].中国兽医科学,2013,43(12):1211-1216. ZHANG H,TANG Q H,WEI Y W,et al.Screening of the host proteins interacting with porcine circovirus type 2 genome stem-loop structure[J].ChineseVeterinaryScience,2013,43(12):1211-1216.(in Chinese)
[17] HUANG L,LU Y,WEI Y,et al.Construction and biological characterisation of recombinant porcine circovirus type 2 expressing the V5 epitope tag[J].VirusRes,2011,161(2):115-123.
[18] LIU C,WEI Y,ZHANG C,et al.Construction and characterization of porcine circovirus type 2 carrying a genetic marker strain[J].VirusRes,2007,127(1):95-99.
[19] BUROKER N E,HUANG J Y,BARBOZA J,et al.The adaptor-related protein complex 2,alpha 2 subunit (AP2α2) gene is a peroxisome proliferator-activated receptor cardiac target gene[J].ProteinJ,2012,31(1):75-83.
[20] KITAGAWA Y,KAMEOKA M,SHOJI-KAWATA S,et al.Inhibitory function of adapter-related protein complex 2 alpha 1 subunit in the process of nuclear translocation of human immunodeficiency virus type 1 genome[J].Virology,2008,373(1):171-180.
[21] SAPSUTTHIPAS S,KITAGAWA Y,TOKUNAGA K,et al.Viral factors involved in adapter-related protein complex 2 alpha 1 subunit-mediated regulation of human immunodeficiency virus type 1 replication[J].SoutheastAsianJTropMedPublicHealth,2011,42 (2):311-319.
[22] CHAUDHURI R,LINDWASSER O W,SMITH W J,et al.Downregulation of CD4 by human immunodeficiency virus type 1 Nef is dependent on clathrin and involves direct interaction of Nef with the AP2 clathrin adaptor[J].JVirol,2007,81(8):3877-3890.
[23] MAROULAKOU I G,BOWE D B.Expression and function of Ets transcription factors in mammalian development:a regulatory network[J].Oncogene,2000,19(55):6432-6442.
[24] SZABO A,RAJNAVOLGYI E.Finding a fairy in the forest:ELF4,a novel and critical element of type I interferon responses[J].CellMolImmunol,2014,11(3):218-220.
[25] YOU F,WANG P,YANG L,et al.ELF4 is critical for induction of type I interferon and the host antiviral response[J].NatImmunol,2013,14(12):1237-1246.
[26] MANKERTZ A,HILLENBRAND B.Replication of porcine circovirus type 1 requires two proteins encoded by the viral rep gene[J].Virology,2001,279(2):429-438.
[27] STEINFELDT T,FINSTERBUSCH T,MANKERTZ A.Demonstration of nicking/joining activity at the origin of DNA replication associated with the rep and rep′ proteins of porcine circovirus type 1[J].JVirol,2006,80(13):6225-6234.
[28] SUN M,LIU X,CAO S,et al.Inhibition of porcine circovirus type 1 and type 2 production in PK-15 cells by small interfering RNAs targeting the Rep gene[J].VetMicrobiol,2007,123(1-3):203-209.
[29] TSAOUSIS A D,GENTEKAKI E,EME L,et al.Evolution of the cytosolic iron-sulfur cluster assembly machinery in Blastocystis species and other microbial eukaryotes[J].EukaryotCell,2014,13(1):143-153.
[30] BANCI L,BRANCACCIO D,CIOFI-BAFFONI S,et al.[2Fe-2S].cluster transfer in iron-sulfur protein biogenesis[J].ProcNatlAcadSciUSA,2014,111(17):6203-6208.
[31] FINSTERBUSCH T,STEINFELDT T,DOBERSTEIN K,et al.Interaction of the replication proteins and the capsid protein of porcine circovirus type 1 and 2 with host proteins[J].Virology,2009,386(1):122-131.
(编辑 白永平)
Regulation Effect of Three Proteins Derived from Porcine Kidney Cells on Porcine Circovirus Type 2 Replication
ZHANG Hui1,TANG Qing-hai2*, HUANG Li-ping1,WEI Yan-wu1,LIU Chang-ming1*
(1.DivisionofSwineInfectiousDiseases,StateKeyLaboratoryofVeterinaryBiotechnology,HarbinVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Harbin150001,China;2.CenterforNanyangVeterinaryBiologicalEngineeringTechnology,HenanProvincialEngineeringLaboratoryofInsectBio-reactor,NanyangNormalUniversity,Nanyang473061,China)
To investigate the regulative effect of expression level of three proteins gene (AP2α2,Elf4 andISCU) derived from porcine kidney cell line (PK-15) on porcine circovirus type 2 (PCV2) propagation efficiency,the genes of three proteins were amplified by RT-PCR and then three eukaryotic expression vectors were constructed.The RNAi fragments of these proteins were designed and cloned into pGPU6-GFP vector to construct shRNA vectors respectively.The efficiency of interference was determined by real-time PCR and three shRNA expression plasmids with higher efficiency of interference were determined.The PK-15 cells transfected with eukaryotic expression vectors or shRNA were screened by antibiotics of G418.The propagation efficiency of strains PCV2 LG in the cell lines was investigated using a capture enzyme-linked immunosorbent assay (ELISA) and an immunoperoxidase monolayer assay (IPMA).The results showed that Elf4 and ISCU overexpression increased PCV2 replication.In contrast,overexpression of AP2α2 exhibited no significant influence on PCV2 replication.In contrast,AP2α2,ISCU and Elf4 down-regulation by shRNA resulted in decreased PCV2 propagation,which demonstrated that these three proteins play a regulative role in PCV2 replication.
porcine circovirus type 2; replication;AP2α2;Elf4;ISCU
10.11843/j.issn.0366-6964.2015.11.017
2014-12-19
国家自然基金青年基金(31101837)
张 辉(1987-),女,山东泰安人,博士生,主要从事动物病毒学研究
*通信作者:唐青海,E-mail:qinghaitang109@126.com;刘长明,E-mail:lcm@hvri.ac.cn,Fax:0451-82733132
S852.659.2
A
0366-6964(2015)11-2040-10
