黄曲霉毒素B1对雏鸡免疫器官影响的病理学观察
2015-03-22于正强陈科杰
于正强,陈 瑾,彭 西,方 静,陈科杰,何 杨
(1.四川农业大学动物医学院,成都 611130;2.西昌市农牧局,西昌 615000)
黄曲霉毒素B1对雏鸡免疫器官影响的病理学观察
于正强1#,陈 瑾2#,彭 西1*,方 静1,陈科杰1,何 杨1
(1.四川农业大学动物医学院,成都 611130;2.西昌市农牧局,西昌 615000)
为探明黄曲霉毒素B1对雏鸡免疫器官组织学及超微结构的影响,将100只1日龄艾维茵健康公雏随机分为4组,分别喂以对照日粮和AFB1日粮(AFB1Ⅰ、Ⅱ、Ⅲ组日粮中AFB1添加量分别为0.15、0.3和0.6 mg·kg-1),试验期21 d。结果显示,AFB1Ⅱ组和Ⅲ组雏鸡的免疫器官脏器指数显著下降(P<0.05)。AFB1组雏鸡的免疫器官组织学损伤表现:胸腺皮质区网状细胞周围见较多细胞核碎片;法氏囊淋巴滤泡内细胞核碎片增多,滤泡髓质区淋巴细胞减少;脾白髓区细胞核碎片增多。超微病理学观察,胸腺、法氏囊和脾内淋巴细胞线粒体肿胀,以染色质边移为特征的凋亡细胞数目增多。结果表明,摄食含0.15~0.6 mg·kg-1AFB1的日粮,可不同程度地抑制雏鸡免疫器官的发育,致免疫器官中的淋巴细胞数量减少、细胞核碎片增多。
黄曲霉毒素B1;胸腺;法氏囊;脾;凋亡;肉鸡
黄曲霉毒素B1(Aflatoxins B1,AFB1),是由黄曲霉菌及寄生曲霉菌产生的次生代谢产物[1],是当前毒性和致癌性最强的物质之一[2]。除引起动物急性肝损伤和肝癌[3],AFB1还可导致多脏器损伤,生产性能下降和抗病能力降低[4-5]。近年来,AFB1对免疫系统的影响受到普遍关注,有关其导致免疫抑制的报道较多,AFB1主要引起畜禽巨噬细胞和淋巴细胞功能受损、淋巴细胞亚群百分率及抗体滴度下降[6-7]。家禽对AFB1较为敏感,即使摄食较低水平AFB1,也会抑制鸡淋巴细胞增殖与活性,导致免疫能力低下[8]。因尚未见有饲料中梯度水平AFB1对鸡免疫器官组织病理学影响的系统研究资料,本试验以1日龄艾维茵肉鸡为研究对象,阐明AFB1日粮致雏鸡免疫器官组织和超微病理学损伤的特征,以期为进一步认识免疫抑制与免疫器官组织学变化之间的关系提供参考依据。
1 材料与方法
1.1 实验动物与日粮
试验选用1日龄艾维茵健康公雏100只购于温江正大畜禽有限公司。
基础日粮以玉米-豆粕为主配制而成,其中蛋白质含量、能量以及维生素和微量元素添加量均参照肉鸡NRC(2004)的营养标准。AFB1日粮的配制方法:分别将1.5、3和6 mg AFB1固体粉末溶于30 mL甲醇中,再将30 mL溶液逐级混进10 kg基础日粮中,然后将混有甲醇的日粮置于37 ℃烘箱中烘干,待甲醇挥发后取出。对照组日粮配制:取30 mL甲醇混入10 kg基础日粮后,以同样方法烘干。由此方法配制而成的对照组、AFB1Ⅰ组、AFB1Ⅱ组和AFB1Ⅲ组日粮中,AFB1的浓度分别为0、0.15、0.3和0.6 mg·kg-1。
1.2 试验的总体设计和动物处理
100只1日龄艾维茵健康公雏,按初始体重无差异原则随机分为4组,每组25只,其中对照组雏鸡采食基础日粮,AFB1Ⅰ、Ⅱ、Ⅲ组雏鸡采食日粮中AFB1的浓度分别为0.15、0.3和0.6 mg·kg-1。试验在四川农业大学兽医院基础实验楼试验场进行。所有试验肉鸡均采用网上平养。试验开始前对鸡舍进行清理并先后采用甲醛熏蒸法、高锰酸钾和石灰消毒法进行全面消毒。采用红外灯加温,第一周室温保持在33 ℃左右,以后每周降2 ℃,相对湿度控制在65%~67%。采用连续光照,自然通风,自由采食和饮水。定期打扫圈舍卫生,试验期为21 d。
1.3 临床观察
试验期间,每天观察鸡的采食、饮水及精神状况,并记录临床症状。试验第7、14和21天,对各组鸡只称重,统计各组间的体重和料肉比差异,并对鸡只的精神状态及生长发育状态对比照相记录。
1.4 病理学观察
1.4.1 免疫器官脏器指数 试验的第7、14和21天每组随机抽取5只剖杀,立即取胸腺、法氏囊和脾,去除其周围脂肪和结缔组织后,用电子天平称其净重,根据如下公式计算脏器指数。
脏器指数=(脏器净重/空腹体重)×100%
1.4.2 组织学观察 剖杀尸检后,取鸡的胸腺、法氏囊和脾,固定于4%的多聚甲醛溶液中,脱水包埋,石蜡切片,HE染色后于Olympus显微镜下观察,并用Nikon数码显微照相机记录组织病理变化。
1.4.3 超微结构观察 试验第21天,每组各剖杀3只雏鸡,取胸腺、法氏囊和脾,用双面刀片修成1 mm×1 mm×3 mm细条后,固定于2.5%的戊二醛中,丙酮脱水,环氧树脂包埋,切片染色后透射电镜下观察记录超微结构的病理变化。
1.5 数据处理
2 结 果
2.1 临床观察
试验期间AFB1Ⅰ组鸡均未出现明显临床症状,AFB1Ⅱ、Ⅲ组鸡饮欲增加,食欲下降,鸡精神沉郁,嗜眠,羽毛松乱而无光泽,同时较对照组生长发育迟缓;体重检测结果显示,7日龄,各组间差异不显著(P>0.05);14日龄,AFB1Ⅱ组鸡平均体重显著低于对照组(P<0.05);21日龄,AFB1Ⅲ组鸡体重显著低于对照组(P<0.05),见表1。料肉比统计结果显示,7日龄和14日龄,各组间差异不显著(P>0.05);21日龄,AFB1Ⅱ、Ⅲ组料肉比显著高于对照组(P<0.05);AFB1Ⅱ、Ⅲ组全期累积料肉比显著高于对照组(P<0.05)。见表2。
2.2 剖解变化及免疫器官脏器指数
7日龄,与对照组比较,AFB1各组鸡无明显眼观变化。14日龄开始,与对照组比较,AFB1Ⅱ、Ⅲ组鸡免疫器官出现肉眼变化,表现为胸腺与脾体积减小,颜色加深;法氏囊体积减小,颜色加深。到21日龄时,AFB1Ⅱ、Ⅲ组雏鸡免疫器官体积减小的病变更明显。
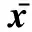

Table 1 Changes of body weight in chickens (±s,n=5)g
“*”表示与对照组相比差异显著(P<0.05),“**” 表示与对照组相比差异极显著(P<0.01)。表2、3与本表相同
“*” represent difference (P<0.05) between the group and control group,“**” represent significantly difference (P<0.01) between the group and control group.The same as the table 2 and table 3

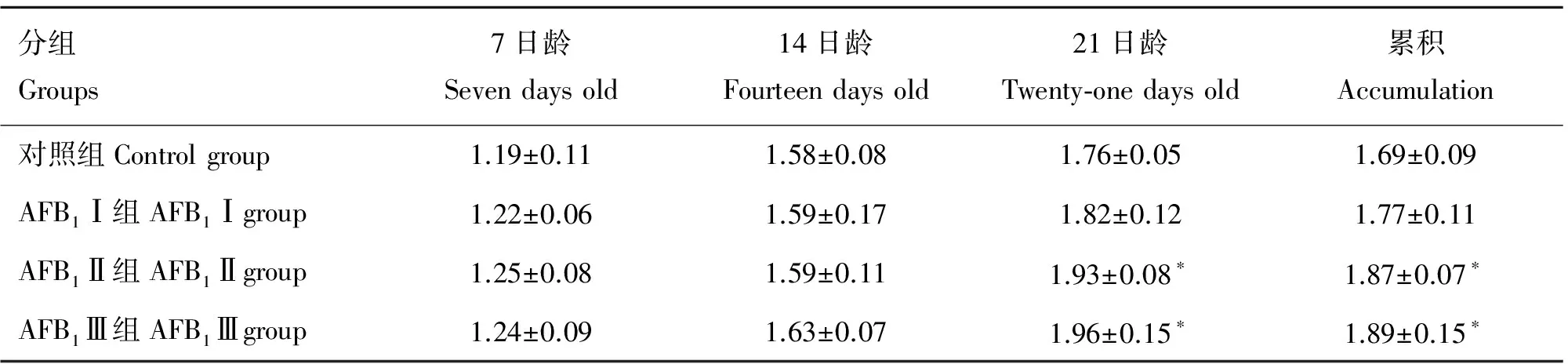
分组Groups7日龄Sevendaysold14日龄Fourteendaysold21日龄Twenty⁃onedaysold累积Accumulation对照组Controlgroup1.19±0.111.58±0.081.76±0.051.69±0.09AFB1Ⅰ组AFB1Ⅰgroup1.22±0.061.59±0.171.82±0.121.77±0.11AFB1Ⅱ组AFB1Ⅱgroup1.25±0.081.59±0.111.93±0.08∗1.87±0.07∗AFB1Ⅲ组AFB1Ⅲgroup1.24±0.091.63±0.071.96±0.15∗1.89±0.15∗
对雏鸡胸腺、法氏囊及脾进行脏器指数统计的结果显示,7日龄和14日龄时,AFB1各组与对照组相比差异均不显著(P>0.05);21日龄时,AFB1Ⅱ组雏鸡的胸腺及脾的脏器指数显著低于对照组(P<0.05),AFB1Ⅲ组雏鸡的胸腺、法氏囊及脾的脏器指数均显著低于对照组(P<0.05),见表3。
2.3 病理组织学变化
组织学观察结果显示,与对照组比较,3个AFB1组雏鸡的胸腺、法氏囊和脾出现程度不同的病理变化,并表现为剂量效应关系。
正常雏鸡的胸腺皮质区的网状细胞形态清晰,周围偶见有少量细胞核碎片,皮质和髓质区的毛细血管数量少(图1a)。AFB1组胸腺淤血表现为髓质区毛细血管扩张充血及数量相对增多(图1b);增多的细胞核碎片主要位于胸腺皮质区的网状细胞核周围,且导致网状细胞核形态不清(图1c、d)。
雏鸡法氏囊的正常形态学结构表现为淋巴滤泡皮髓质分界清晰,细胞均匀排列,其中散见有少量细胞核碎片(图1e)。AFB1组雏鸡法氏囊的病变特征是,淋巴滤泡髓质区的淋巴细胞明显减少、排列较稀疏,皮质及髓质均见有大量小空洞,细胞核碎片显著增多,且主要位于空洞内(图1f、g)。21日龄时,AFB1Ⅲ组一只雏鸡的法氏囊淋巴滤泡数量减少、体积缩小,滤泡之间大量纤维结缔组织增生(图1h)。
正常雏鸡的脾白髓区淋巴细胞排列均一。AFB1组雏鸡的脾红髓区淤血,脾小结及动脉周围淋巴鞘见有一定量空洞,细胞核碎片增多,且主要位于空洞内(图1i、j、k 和l)。
对胸腺、法氏囊和脾的主要病变进行统计(表4),结果显示,7日龄时,AFB1Ⅰ组未见有明显的病变,AFB1Ⅱ、Ⅲ组1/5或2/5出现病变,随试验期延长,3个AFB1组的病变率逐渐升高,至21日龄时,AFB1Ⅱ组的病变率为2/5~4/5,AFB1Ⅲ组的病变率为4/5。该结果显示,饲粮中AFB1会导致雏鸡免疫器官的病理损伤,胸腺和脾的病变特征:淤血及细胞核碎片增多;法氏囊的病变特征:细胞核碎片增多及淋巴细胞数量减少。
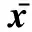

Table 3 Changes of organ index of immune organ (±s)g·kg-1
表4 胸腺、法氏囊和脾主要病变的发生率(n=5)
Table 4 Incidence of major lesions in thymus,bursa of Fabricius and spleen (n=5)

组织Tissues病理损伤PathologicalLesions时间Time对照组ControlGroupAFB1Ⅰ组AFB1ⅠgroupAFB1Ⅱ组AFB1ⅡgroupAFB1Ⅲ组AFB1Ⅲgroup胸腺Thymus淤血Congestioninredpulp细胞核碎片增多Nuclearfragmentationincreased7日龄7days0/50/51/51/514日龄14days0/50/52/54/521日龄21days0/51/53/54/57日龄7days0/50/52/53/514日龄14days0/51/52/52/521日龄21days0/51/54/54/5法氏囊BursaofFabricius细胞核碎片Nuclearfragmentationappeared7日龄7days0/50/51/52/514日龄14days1/51/51/52/521日龄21days0/51/52/54/5脾Spleen淤血Congestioninredpulp细胞核碎片增多Nuclearfragmentationincreased7日龄7days0/50/51/53/514日龄14days0/51/51/53/521日龄21days1/52/54/55/57日龄7days0/51/51/51/514日龄14days0/52/52/52/521日龄21days0/51/53/54/5
a.对照组胸腺;b.AFB1 Ⅲ组胸腺,髓质区淤血;c.AFB1Ⅱ组,胸腺皮质区出现少量空洞及细胞核碎片(→); d.AFB1 Ⅲ组,胸腺皮质区出现大量空洞及细胞核碎片(→);e.对照组雏鸡的法氏囊;f.AFB1 Ⅲ,法氏囊淋巴滤泡髓质区细胞排列稀疏;g.AFB1 Ⅲ组,法氏囊大量空洞及细胞核碎片(→);h.AFB1 Ⅲ组,法氏囊间质结缔组织增生; i.对照组脾;j.AFB1 Ⅲ组,脾红髓区淤血;k.AFB1 Ⅲ组,脾动脉周围淋巴鞘淋巴细胞减少;l.AFB1 Ⅲ组,脾动脉周围淋巴鞘形成空洞a.Thymus of the chicken in control group;b.Thymus of the chicken in AFB1 group Ⅲ.Congestion in medulla;c.Thymus of the chicken in AFB1 group Ⅱ.A few vacuoles and nuclear debris were found in cortex (→);d.Thymus of the chicken in AFB1 group Ⅲ.More vacuoles and nuclear debris in cortex (→);e.Bursa of Fabricius of the chicken in control group;f.Bursa of Fabricius of the chicken in AFB1 group Ⅲ.Sparse medulla of follicles;g.Bursa of Fabricius of the chicken in AFB1 group Ⅲ.Vacuoles and nuclear debris (→);h.Bursa of Fabricius of the chicken in AFB1 group Ⅲ.Proliferated connective tissue in the mesenchymal of bursa;i.Spleen of the chicken in control group;j.Spleen of the chicken in AFB1 group Ⅲ.Congestion in red pulp;k.Spleen of the chicken in AFB1 group Ⅲ.Lymphocytes were decreased in periarterial lymphatic sheath;l.Spleen of the chicken in AFB1 group Ⅲ.Vacuoles in the periarterial lymphatic sheath图1 21日龄雏鸡的胸腺、法氏囊和脾病理组织学变化(HE染色400×)Fig.1 Thymus,bursa of Fabricius and spleen were in the chicken from the four groups at 21 days old (HE,400×)
2.4 超微结构变化
2.4.1 胸腺 与对照组比较,AFB1Ⅲ组雏鸡的胸腺中的淋巴细胞核周隙扩张,线粒体肿胀,嵴断裂溶解,甚至消失呈空泡状(图2a、b);凋亡细胞数量增多,凋亡细胞的染色质或浓缩边移形成月牙形或花环状贴于核膜下,或聚集成不规则团块状。凋亡细胞常位于网状细胞附近或被吞噬于网状细胞的细胞质内(图2c)。
2.4.2 法氏囊 与对照组比较,凋亡细胞数量增多。凋亡细胞核染色质凝聚边移形成马蹄形、月牙形等,部分网状细胞内见有被吞噬的凋亡细胞(图2d、e、f)。
2.4.3 脾 与对照组(图2g)比较,AFB1Ⅲ组雏鸡的脾中淋巴细胞的核周隙扩张和线粒体肿胀(图2h)。脾内凋亡的淋巴细胞和浆细胞染色质凝聚边移,呈花环形或月牙形(图2i)。
3 讨 论
3.1 雏鸡生长状况及临床症状观察
AFB1为一类致癌物质,高剂量导致急性死亡,低剂量长期暴露导致慢性中毒,畜禽表现生长不良,免疫能力低下,饲料转化率降低,死亡率增加,蛋鸡产蛋率下降等[9]。试验期间,AFB1Ⅱ、Ⅲ组(0.3、0.6 mg·kg-1)鸡出现食欲下降、饮欲增加的临床症状;体重和料肉比的统计结果表明,AFB1Ⅱ、Ⅲ组鸡只饲料转化率降低,生长发育受到抑制。A.Marchioro等[10]用AFB1处理科宝肉鸡结果显示生长抑制、体重下降,本试验结果与其一致。雏鸡采食量下降可能与饲料品质恶化,适口性下降有关[11]。引起雏鸡体重减轻、生长抑制的可能原因:摄入的黄曲霉毒素一方面可破坏肠道上皮细胞的完整性和通透性,影响消化酶的分泌,进而影响营养物质的消化吸收[12-13];另一方面可导致肾上腺皮质激素、生长激素等合成紊乱,引起营养成分体内代谢障碍[14]。
a.对照组胸腺; b.AFB1Ⅲ组,胸腺核周隙明显扩张;c.AFB1Ⅲ组,胸腺两个凋亡的淋巴细胞;d.对照组法氏囊;e.AFB1Ⅲ组,法氏囊细胞凋亡;f.AFB1Ⅲ组,法氏囊网状细胞内吞噬有凋亡细胞;g.对照组脾;h.AFB1Ⅲ组,脾淋巴细胞核周隙扩张,线粒体呈空泡状(→);i.AFB1Ⅲ组,脾浆细胞凋亡a.Thymus of the chicken in control group;b.Thymus of the chicken in AFB1 group Ⅲ.Dilated perinuclear cisternae;c.Thymus of the chicken in AFB1 group Ⅲ.Two apoptotic thymocytes;d.Bursa of Fabricius of the chicken in control group;e.Bursa of Fabricius of the chicken in AFB1 group Ⅲ.Apoptotic cell in bursa of Fabricius;f.Bursa of Fabricius of the chicken in AFB1 group Ⅲ.Apoptotic cells swallowed by reticular cell;g.Spleen of the chicken in control group;h.Spleen of the chicken in AFB1 group Ⅲ.Dilated perinuclear cisternae and vacuolated mitochondrial in lymphocytes (→);i.Spleen of the chicken in AFB1 group Ⅲ.Apoptotic plasmocyte in spleen图2 21日龄雏鸡的胸腺、法氏囊和脾的超微结构Fig.2 The thymus,bursa of Fabricius and spleen in the chicken from the control and AFB1 groups at 21 days of age
3.2 AFB1对雏鸡免疫器官的形态学损伤
试验结束时,AFB1Ⅱ、Ⅲ组(0.3、0.6 mg·kg-1)雏鸡胸腺、法氏囊和脾的脏器指数下降。M.Manafi等[15]研究发现,肉鸡日粮中AFB1含量为0.5 mg·kg-1时,胸腺和法氏囊的脏器指数显著低于对照组。F.C.Quist等[16]研究发现,火鸡日粮中AFB1含量超过0.1 mg·kg-1时,脾的脏器指数显著低于对照组。本试验结果与上述研究结果一致,表明AFB1对雏鸡免疫器官的生长发育有一定的抑制作用。
组织学观察结果显示,雏鸡采食含AFB10.3和0.6 mg·kg-1的日粮后,3个免疫器官均出现细胞核碎片增加以及淋巴细胞减少的病理变化。N.A.Omar[17]对小鼠脾的研究结果显示,AFB1可导致脾中淋巴细胞减少以及形成空洞,本试验中脾的病变与之相符。细胞核碎片的增多表明采食AFB1会导致免疫器官中的坏死淋巴细胞数量增多,超微病理学观察结果证实淋巴细胞主要以凋亡的方式死亡,本研究采用流式细胞术亦检测到AFB1组脾细胞的凋亡率升高[18]。坏死细胞增多可能引起淋巴细胞减少和实质萎缩[19-20],并导致免疫器官的脏器指数下降。在胸腺和脾中还观察到淤血的病变,提示AFB1会导致胸腺和脾的血液循环障碍,进而导致细胞病变。AFB1Ⅲ组一只雏鸡的法氏囊还出现间质结缔组织增生的现象,这可能是较多量细胞坏死后机体的修复性反应,该结果还提示同种属动物的不同个体对饲料中AFB1的敏感性存在差异。结构是功能的基础,免疫器官出现病理损伤,雏鸡的细胞和体液免疫功能必然下降。
超微结构的观察显示,AFB1可引起免疫器官核膜扩张;线粒体肿胀,嵴断裂消失或形成空泡;淋巴细胞发生凋亡的频率增高,凋亡细胞表现为染色质凝聚边移形成月牙形或花环状贴于核膜下,凋亡细胞多位于网状细胞周围或被网状细胞吞噬。L.Rainbow等[21]对小鼠脾的研究也表明,AFB1引起脾淋巴细胞核膜扩张、线粒体嵴断裂消失的病变。这些超微变化表明AFB1主要引起膜系统的损伤。大量的研究表明,AFB1能引起过多的脂质过氧化反应[22-24],脂质过氧化产生的自由基攻击细胞膜系统,引起细胞膜、线粒体或内质网损伤;线粒体损伤后可触发依赖于线粒体调控的Caspase途径而引起细胞凋亡[25]。凋亡细胞主要位于网状细胞周围且凋亡细胞能够被网状细胞吞噬,这与组织学观察到细胞核碎片主要位于网状细胞周围的现象相吻合,表明坏死或凋亡的淋巴细胞可能被网状内皮细胞吞噬清除。
4 结 论
雏鸡饲料中AFB1含量达0.15~0.6 mg·kg-1时,可不同程度地抑制雏鸡免疫器官的发育,导致胸腺、法氏囊和脾组织中淋巴细胞数量减少,细胞核碎片与凋亡细胞数目增多。
[1] CONY P J,BHATNAGAR D.Variability among atoxigenic aspergillus flavus strains in ability to prevent aflatoxin contamination and production of aflatoxin biosynthetic pathway enzymes[J].ApplEnvironMicrobiol,1994,60(7):2248-2251.
[2] 侯然然,张敏红.霉菌毒素对畜禽的危害及其防控方法的研究进展[J].中国畜牧兽医,2007,34(1):13-16. HOU R R,ZHANG M H.Damage of mycotoxins on animals and advances in study on methods of revention[J].ChinaAnimalHusbandry&VeterinaryMedicine,2007,34(1):13-16.(in Chinese)
[3] AGUILAR F,HUSSAIN S P,CERUTTI P.Aflatoxin B1induces the transversion of G-T in codon 249 of the p53 tumor suppressor gene in human hepatocytes[J].ProcNatlAcadSciUSA,1993,90(18):8586-8590.
[4] 史莹华,许梓荣,王成章.黄曲霉毒素对猪生长性能及免疫和抗氧化指标的影响[J].中国兽医学报,2007,27(5):733-736. SHI Y H,XU Z R,WANG C Z.Effects of aflatoxin on growth performance and immunology and antioxidant indexes in pigs[J].ChineseJournalofVeterinaryScience,2007,27(5):733-736.(in Chinese)
[5] JIANG Y,JOLLY P E,ELLIS W O,et al.Aflatoxin B1albumin adduct levels and cellular immune status in Ghanaians[J].IntImmunol,2005,17(6):807-814.
[6] GHOSH R C,CHAUHAN H V,JHA G J.Suppression of cell-mediated immunity by purified aflatoxin B1in broiler chicks[J].VetImmunolImmunopathol,1991,28(2):165-172.
[7] CORRIER D E.Mycotoxicosis:mechanisms of immunosuppression[J].VetImmunolImmunopathol,1991,30(1):73-87.
[8] THAXTON J P,TUNG H T,HAMILTON P B.Immunosuppression in chickens by aflatoxin[J].PoultSci,1974,53(2):721-725.
[9] 石达友,李鹏飞,郭铭生,等.不同剂量黄曲霉毒素B1对雏鸭生长性能的影响[J].中国兽医杂志,2010,46(4):22-23. SHI D Y,LI P F,GUO M S,et al.Effects of different doses of aflatoxin B1on growth performance in ducklings[J].ChineseJournalofVeterinaryMedicine,2010,46(4):22-23.(in Chinese)
[10] MARCHIORO A,MALLMANN A,DIEL A,et al.Effects of aflatoxins on performance and exocrine pancreas of broiler chickens[J].AvianDis,2013,57(2):280-284.
[11] KRYUKOV V,KRIVSTOV V,KRUPIN V,et al.Effect of aflatoxin on protein utilization by broilers[J].Pticeprvodsvo,1992,3:13-15.
[12] 刘艳丽,汪铭书,程安春,等.人工感染黄曲霉毒素雏鸭的病理学动态变化[J].中国兽医科学,2006,36(5):396-400. LIU Y L,WANG M S,CHENG A C,et al.Pathological development of ducklings infected experimentally with aflatoxin[J].VeterinaryScienceinChina,2006,36(5):396-400.(in Chinese)
[13] ZHANG S,PENG X,FANG J,et al.Effects of aflatoxin B1exposure and sodium selenite supplementation on the histology,cell proliferation,and cell cycle of jejunum in broilers[J].BiolTraceElemRes,2014,160(1):32-40.
[14] HSIEH D P H.Mode of action of mycotoxins[M].Mycotoxins in food.Cambridge:Academic Press,1987:149-176.
[15] MANAFI M,UMAKANTHA B,ALI M N,et al.Study of the combination effects of aflatoxin and T-2 toxin on performance parameters and internal organs of commercial broilers[J].GlobalVet,2012,8(4):393-396.
[16] QUIST C F,BOUNOUS D I,KILBURN J V,et al.The effect of dietary aflatoxin on wild turkey poults[J].JWildlDis,2000,36(3):436-444.
[17] OMAR N A.Effect of some aflatoxins on a lymphatic organ (spleen) of male albino rats (histopathological study)[J].EgyptHospMed,2012,48(7):357-367.
[18] CHEN J,CHEN K,YUAN S,et al.Effects of aflatoxin B1on oxidative stress markers and apoptosis of spleens in broilers[J].ToxicolIndHealth,2013,0748233713500819.
[19] HASANZADEH S,HOSSEINI E,REZAZADEH L.Effects of aflatoxin B1on profiles of gonadotropic (FSH and LH),steroid (testosterone and 17β-estradiol) and prolactin hormones in adult male rat[J].IranJVetRes,2011,12(4):332-336.
[20] ORTATATLI M,OGUZ H,HATIPOGLU F,et al.Evaluation of pathological changes in broilers during chronic aflatoxin (50 and 100 ppb) and clinoptilolite exposure[J].ResVetSci,2005,78(1):61-68.
[21] RAINBOW L,MAXWELL S M,HENDRICKSE R G.Ultrastructural changes in murine lymphocytes induced by aflatoxin B1[J].Mycopathologia,1994,125(1):33-39.
[22] YANG X J,LU H Y,LI Z Y,et al.Cytochrome P450 2A13 mediates aflatoxin B1-induced cytotoxicity and apoptosis in human bronchial epithelial cells[J].Toxicology,2012,300(3):138-148.
[23] MEKI A R,ABDEL-GHAFFAR S K,EL-GIBALY I.Aflatoxin B1induces apoptosis in rat liver:protective effect of melatonin[J].NeuroEndocrinolLett,2001,22(6):417-426.
[24] BERNABUCCI U,COLAVECCHIA L,DANIELI P P,et al.Aflatoxin B1and fumonisin B1affect the oxidative status of bovine peripheral blood mononuclear cells[J].ToxicolInVitro,2011,25(3):684-691.
[25] ABRAHAM M C,SHAHAM S.Death without caspases,caspases without death[J].TrendsCellBiol,2004,14(4):184-193.
(编辑 白永平)
Effect of Aflatoxin B1on Pathological Changes of Immune Organs in Broilers
YU Zheng-qiang1#,CHEN Jin2#,PENG Xi1*,FANG Jing1,CHEN Ke-jie1,HE Yang1
(1.CollegeofVeterinaryMedicine,SichuanAgricuturalUniversity,Chengdu611130,China; 2.AnimalHusbandryBureauofXichang,Xichang615000,China)
The aim of the current study was to investigate the histopathological and ultrastructural changes caused by dietary AFB1in broilers.One hundred one-day-old avian male broilers were randomly divided into four equal groups and were fed for 21 days as follows:a control diet and three AFB1addition diets containing 0.15,0.3 and 0.6 mg·kg-1AFB1,respectively.The results showed that the relative weight of the three organs were lower than those of the control group (P<0.05).Histopathologically,in the AFB1groups,there were increased nuclear debris around the reticulocytes in the cortex of the thymus;the number of lymphocytes was decreased in the medulla,and increased nuclear debris can be observed in the lymphoid follicle of the Bursa of Fabricius;more nuclear debris appeared around lymphoid follicles and lymphatic sheath in the chicken spleens.The ultrastructural changes were mitochondria swelling and increased apoptotic cells characterized as chromatin margination in the lymphocytes of the three immune organs.These results indicated that when the contents of dietary AFB1were from 0.15 to 0.6 mg·kg-1,the development of immune organs could be inhibited,and the major lesions of the three immune organs were the decrease of lymphocytes and the increase of nuclear debris.
aflatoxin B1;thymus;bursa of Fabricius;spleen;apoptosis;broilers
10.11843/j.issn.0366-6964.2015.08.022
2014-11-12
“教育部长江学者和创新团队发展计划”创新团队(IRT 0848);四川省科技厅资助项目(2013FZ0072)
于正强(1990-),男,重庆荣昌人,硕士,主要从事动物病理学研究,E-mail:mine_yzq@163.com;陈 瑾(1988-),女,四川冕宁人,硕士,主要从事动物病理学研究, E-mail:chenjin19880808@126.com。于正强、陈瑾为并列第一作者
*通信作者:彭 西(1973-),教授,E-mail:pengxi197313@163.com
S852.35;S856.9
A
0366-6964(2015)08-1447-08
