应用生物信息学预测牛新microRNA及验证
2015-03-22崔晓钢杨少华张胜利孙东晓
崔晓钢,杨少华,谢 岩,张胜利,张 勤,孙东晓
(中国农业大学动物科技学院,农业部动物遗传育种与繁殖重点实验室,畜禽育种国家工程实验室,北京 100193)
应用生物信息学预测牛新microRNA及验证
崔晓钢,杨少华,谢 岩,张胜利,张 勤,孙东晓*
(中国农业大学动物科技学院,农业部动物遗传育种与繁殖重点实验室,畜禽育种国家工程实验室,北京 100193)
本研究旨在通过比较基因组学和结构序列分析方法预测牛基因组中的新miRNAs并进行试验验证。根据miRNA 分子序列具有一定保守性,将人、小鼠、绵羊、猪和狗5种哺乳动物已知的miRNA 分子与NCBI中牛的全基因组序列(UMD3.1)对比,获得牛miRNAs;随机选取部分预测的miRNAs进行实时荧光定量PCR(qRT-PCR)验证。结果,基于物种间序列同源比对共计预测到44条新的牛miRNAs,选取其中4条miRNAs,通过qRT-PCR方法,发现他们在泌乳期中国荷斯坦牛乳腺、心、子宫和肝组织中均有表达。结果表明,基于比较基因组学和生物信息学预测新的miRNA 分子可行,为奶牛基因表达调控及其性状形成机制研究提供了前期基础。
牛;miRNA;预测;生物信息学
microRNAs(miRNAs)是一类大约18~24 nt左右的非编码RNA小分子,通过与靶基因mRNA的3′非翻译区(3′UTR)完全或不完全互补配对从而抑制靶基因的翻译过程,在多种生物学过程起重要调控作用[1]。大多数miRNAs位于基因间,但也有一些miRNAs位于内含子。基因间的miRNAs首先由细胞内RNA聚合酶Ⅱ和RNA聚合酶Ⅲ Drosha加工形成70~80 nt具有发夹状结构的pre-miRNA(前体miRNA)[1-2];随后pre-miRNA被exportin 5转移至细胞质, 而后被RNA聚合酶Ⅲ Dicer识别剪切为22 nt左右的成熟miRNA;成熟的miRNA与一些特别的蛋白结合形成沉默复合体(RNA-induced silencing complex,RISC),RISC通过与靶mRNA的3′UTR结合发挥抑制其翻译作用[2-3]。
目前,在动物中已经有超过5 000 条的miRNAs分子被确定并被收录到公开的miRNA 数据库中,即miRBase(http://microrna.sanger.ac.uk/)。该数据库中已有798条牛的miRNAs前体被收录。最初发现的牛miRNA为lin-4和let-7,通过基因筛选获得[3],由于效率低下,目前已不采用此方法。之后,人们通过直接克隆获得miRNAs:首先分离纯化得到小分子量RNA,然后分别在其5′和3′端连接RNA接头,根据接头序列设计逆转录引物进行逆转录反应,得到cDNA 单链并进行PCR 扩增,挑选单克隆测序[4],其缺点是很难克隆到表达量很低的miRNAs,一些大RNA分子降解的碎片同样有可能被分离克隆[5-6]。陈海漩等[7]2008年通过分子克隆从牛脑和肝组织中得到了13条新的miRNAs。研究发现,miRNA在不同物种间具有高度的序列保守性[8]。因此,基于不同物种间已知miRNAs这种保守性,可以应用生物信息学预测新的miRNAs。这种方法具有速度快和通量大的特点,能够获得一些表达量低且无法克隆到的miRNAs。但是,通过这种方法获得的候选miRNAs必须通过后续试验验证,如分子克隆、Nothern杂交和qRT-PCR。陈海璇等[7-8]通过生物信息学方法获得了147条牛的候选miRNAs和11条山羊的候选miRNAs;穆松等[9]通过生物信息学方法得到了17条牛的候选miRNAs。
近几年,随着miRBase数据库的不断更新,已知miRNA数量大幅度增长。miRNA预测的生物信息学方法主要有比较基因组方法、结构序列分析方法和机器学习方法。赵东宇等[10]根据预测效果与理论基础综合分析以上3类方法并进行比较发现预测效果准确性依次为65%、80%和90%。但是,机器学习方法需要一定的计算机基础。鉴于此,本研究通过比较基因组学和结构序列分析方法预测牛的新miRNA 分子,并通过实时荧光定量PCR技术进行验证,为研究奶牛重要性状基因表达调控及其性状形成机制提供有价值的前期基础。
1 材料与方法
1.1 miRNAs和ESTs序列的获得
人、小鼠、绵羊、猪、狗和牛6个物种的miRNA序列来自miRBase数据库(http://miRNA.sanger.ac.uk;版本:20.0)。牛的EST和mRNA序列来自美国国家生物技术信息中心的GenBank数据库(http://www.ncbi.nlm.nih.gov/)。
1.2 miRNA分子的预测
miRNA预测步骤:将下载得到的miRNA 分子序列与NCBI中牛的全基因组序列(UMD3.1)进行在线Blast比对,寻找存在0~3 个碱基差异的同源序列并删除重复和表达蛋白的序列;利用mFold 3.1软件,选取包含miRNA 序列的100 nt 左右的片段进行预测二级结构,获得可形成发夹结构的序列并与miRNA 前体数据库对比,确定是否为可能的新miRNA 分子或miRNA 基因。 按照下列原则[11-12]预测新的miRNAs分子:①与成熟的miRNA只能存在0~3个碱基差异;②前体能折叠成发夹的二级结构;③发夹结构必须有较小的自由能;④A+U含量在30%~70%;⑤与其互补序列的差异不能多于6个;⑥不能存在环状结构。
1.3 靶基因预测
采用在线软件TargetScan 6.2(http://www.targetscan.org/)和PicTar(http://pictar.mdc-berlin.de/)对本研究得到的miRNAs预测靶基因,TargetScan中有牛mRNA:miRNA互作关系,直接应用该互作关系进行预测;Pictar没有反刍动物数据,因此,本研究基于人的mRNA:miRNA互作关系进行预测,将预测的人靶基因与牛该基因3′UTR进行比对,若预测靶点完全匹配即确定此基因为牛miRNA的靶基因;最后将两个软件的预测结果进行交集。
对上述预测得到的靶基因,利用KOBAS2.0在线软件和KEGG pathday公共数据库进行通路和GO分析。
1.4 实时荧光定量PCR验证
采集泌乳期中国荷斯坦牛乳腺、心、子宫和肝4种组织样品,快速放入液氮保存。使用TRIzol试剂盒(Invitrogen)分别提取乳腺、心、子宫和肝组织样品总RNA。随机选取4条预测得到的新miRNAs,采用茎环引物实时荧光定量PCR(qRT-PCR)方法验证其成熟miRNA序列是否存在,即利用其茎环结构的特异反转录引物进行cDNA合成;反转录试剂为Taqman®Transcription Kit 200 Reactions反转录酶试剂盒(ABI),miRNA特异引物由北京六合华大基因科技有限公司合成;以cDNA作为模板,用miRNA的特异引物和通用下游引物(表1)进行qRT-PCR反应,以U6 snoRNA(广东锐博生物)作为内参基因;miRNA qRT-PCR扩增体系20 μL:SYBR Green buffer 9 μL、ddH2O 7.4 μL、上下游引物各0.8 μL(200 μmoL·L-1)、cDNA2 μL;反应程序:95 ℃ 10 min,45个循环(95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s),72 ℃ 6 min。
采用2-ΔΔCt法对3个重复样本进行相对miRNA表达分析。利用SAS v8.02软件对不同组织的miRNA相对表达量进行显著性差异分析,显著性水平为P<0.05。
2 结 果
2.1 新miRNAs分子筛选
本研究从miRBase数据库中下载了人、小鼠、绵羊、猪和狗5种哺乳动物共3 767条miRNAs分子;在NCBI上与牛全基因组序列(UMD3.1)进行Blast,得到具有0~6个碱基差异同源性序列共2 606条(表2),其中仅存在0~3 个碱基差异且不表达蛋白质的序列共796条;下载上述796条序列,选取包含有miRNA 序列的100 nt 左右的片段,通过mFold在线软件http://mfold.rna.albany.edu/?q=mfold/RNA-Folding-Form预测得到可能的发夹结构1 481个;按照材料与方法1.2预测原则筛选发夹结构,得到44条牛新miRNAs 分子,各项参数见表3。
图1展示了上述44条牛新miRNAs分子的二级结构,其成熟序列均在发夹状结构的一条臂上,且与其互补序列的差异小于6个碱基,自由能为-229.80~-69.90 kJ·mol-1(表3),均符合miRNA预测原则,可能为牛的新miRNAs分子。
表1 4个牛新miRNAs qRT-PCR 所用引物
Table 1 Primers for qRT-PCR validation of 4 predicted bovine miRNAs

miRNA名称Name茎环特异引物Stem⁃LoopRTprimer引物Primer退火温度/℃Tmssc⁃miR⁃9⁃2CTCAACTGGTGTCGTGGAGTCGGC⁃AATTCAGTTGAGF:TGGGTTGGGCTTCTTTGGTTATCTR:CTCAACTGGTGTCGTGGAGTC60hsa⁃miR⁃7CTCAACTGGTGTCGTGGAGTCGG⁃CAATTCAGTTGAGF:GGGTCTGGGTGGAAGACTAGTR:CTCAACTGGTGTCGTGGAGTC60mmu⁃miR⁃467cCTCAACTGGTGTCGTGGAGTCG⁃GCAATTCAGTTGAGF:GGTCGGGTAAGTGCGTGCATR:CTCAACTGGTGTCGTGGAGTC60cfa⁃miR⁃143CTCAACTGGTGTCGTGGAGTCG⁃GCAATTCAGTTGAGF:GGTTCTGGGTGAGAGAAGCACR:CTCAACTGGTGTCGTGGAGTC60U6ForwardssD0904071006(引物编号)60U6ReversessD0904071007(引物编号)60
表2 同源比对筛选miRNA结果
Table 2 The results of miRNA Blast
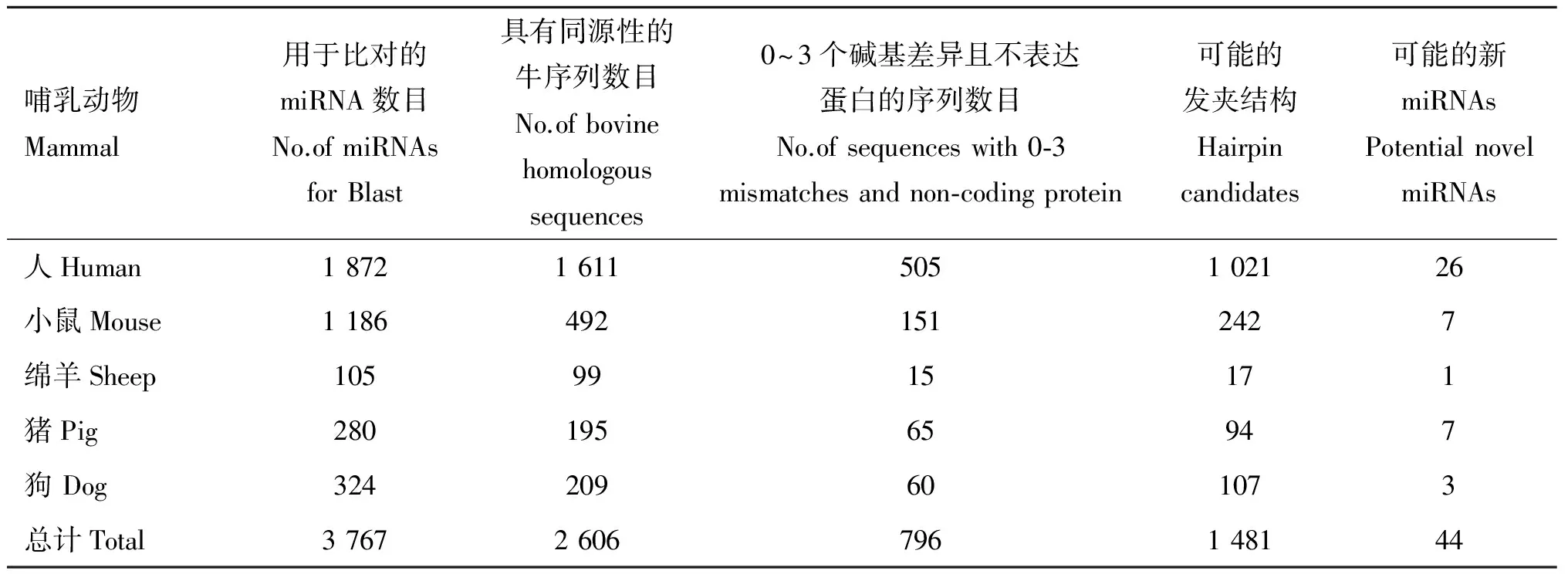
哺乳动物Mammal用于比对的miRNA数目No.ofmiRNAsforBlast具有同源性的牛序列数目No.ofbovinehomologoussequences0~3个碱基差异且不表达蛋白的序列数目No.ofsequenceswith0⁃3mismatchesandnon⁃codingprotein可能的发夹结构Hairpincandidates可能的新miRNAsPotentialnovelmiRNAs人Human18721611505102126小鼠Mouse11864921512427绵羊Sheep1059915171猪Pig28019565947狗Dog324209601073总计Total37672606796148144
表3 预测到的新miRNAs
Table 3 The results of predicted novel miRNAs

新miRNAsNovelmiRNAs折叠自由能/(kJ·mol-1)Foldingfreeenergy成熟miRNA序列MaturemiRNAsequence成熟miRNA长度/ntThelengthofmaturemiRNAhsa⁃let⁃7e-143.57UGAGGUAGGAGGUUGUAUAGUU22hsa⁃miR⁃7-153.20UGGAAGACUAGUGAUUUUGUUGU23hsa⁃miR⁃9-141.48UCUUUGGUUAUCUAGCUGUAUGA23hsa⁃miR⁃24-141.48UGCCUACUGAGCUGAUAUCAGU22hsa⁃miR⁃24-116.79UGCCUACUGAGCUGAUAUCAGU22hsa⁃miR⁃29b⁃2-128.51CUGGUUUCACAUGGUGGCUUAG22hsa⁃miR⁃29b⁃2-128.50CUGGUUUCACAUGGUGGCUUAG22hsa⁃miR⁃147-125.99GUGUGUGGAAAUGCUUCUGC20hsa⁃miR⁃191-187.11CAACGGAAUCCCAAAAGCAGCUG23hsa⁃miR⁃345-83.30GCUGACUCCUAGUCCAGGGCUC22hsa⁃miR⁃425-157.39AAUGACACGAUCACUCCCGUUGA23hsa⁃miR⁃450a-140.64UUUUGCGAUGUUCCUAAUAU22hsa⁃miR⁃486⁃3p-184.18CGGGGCAGCUCAGUACAGGAU21hsa⁃miR⁃486⁃5p-184.60UCCUGUACUGAGCUGCCCCGAG22hsa⁃miR⁃568-100.88AUGUAUAAAUGUAUACACAC20hsa⁃miR⁃671⁃3p-178.74UCCGGUUCUCAGGGCUCCACC21hsa⁃miR⁃671⁃5p-229.80AGGAAGCCCUGGAGGGGCUGGAG23hsa⁃miR⁃2054-77.02CUGUAAUAUAAAUUUAAUUUAUU23hsa⁃miR⁃4292-157.39CCCCUGGGCCGGCCUUGG18hsa⁃miR⁃4294-150.27GGGAGUCUACAGCAGGG18hsa⁃miR⁃4479-133.11CGCGCGGCCGUGCUCGGAGCAG22hsa⁃miR⁃4516-128.51GGGAGAAGGGUCGGGGC17hsa⁃miR⁃4674-69.90CUGGGCUCGGGACGCGCGGCU21hsa⁃miR⁃4680⁃5p-88.32AGAACUCUUGCAGUCUUAGAUGU23hsa⁃miR⁃4716⁃3p-164.50AAGGGGGAAGGAAACAUGGAGA22hsa⁃miR⁃4753⁃3p-92.09UUCUCUUUCUUUAGCCUUGUGU22mmu⁃miR⁃467c-137.30UAAGUGCGUGCAUGUAUAUGUG22mmu⁃miR⁃467e-103.81AUAAGUGUGAGCAUGUAUAUGU22mmu⁃miR⁃467g-106.74UAUACAUACACACACAUAUAU22mmu⁃miR⁃671⁃5p-229.80AGGAAGCCCUGGAGGGGCUGGAG23mmu⁃miR⁃1898-113.02AGGUCAAGGUUCACAGGGGAUC22mmu⁃miR⁃3107-184.60UCCUGUACUGAGCUGCCCCGAG22mmu⁃miR⁃3473-117.20UGGAGAGAUGGCUCAGCA18oar⁃miR⁃370⁃5p-128.92CAGGUCACGUCUCUGCAGUUAC22ssc⁃let⁃7e-143.57UGAGGUAGGAGGUUGUAUAGUU22ssc⁃miR⁃9⁃1-141.90UCUUUGGUUAUCUAGCUGUAUGA23ssc⁃miR⁃9⁃1-158.23UCUUUGGUUAUCUAGCUGUAUGA23ssc⁃miR⁃9⁃2-158.23UCUUUGGUUAUCUAGCUGUAUGA23ssc⁃miR⁃374b⁃5p-146.50AUAUAAUACAACCUGCUAAGUG21ssc⁃miR⁃421-138.13CCUCAUUAAAUGUUUGUUGAAUGA24ssc⁃miR⁃421-140.64CCUCAUUAAAUGUUUGUUGAAUGA24cfa⁃miR⁃9-158.23UCUUUGGUUAUCUAGCUGUAUGA23cfa⁃miR⁃143-135.20UGAGAUGAAGCACUGUAGCUC21cfa⁃let⁃7c-143.57UGAGGUAGUAGGUUGUAUGGUU22

图1 候选miRNAs前体分子二级结构预测Fig.1 Prediction of secondary structure of pre-miRNA molecule
2.2 qRT-PCR验证
从44个候选miRNAs分子中随机选取hsa-miR-7、 ssc-miR-9-2、 mmu-miR-467c和cfa-miR-143进行qRT-PCR验证,结果如图2所示,4个miRNAs分子在泌乳期中国荷斯坦牛乳腺、心、子宫和肝中均有表达,证实为真实的牛miRNAs。如图2所示,差异显著检验结果表明,cfa-miR-143在心组织的mRNA表达量与其他3个组织间差异显著(P<0.05),其他3个miRNAs在这4个组织中的mRNA表达量差异不显著(P>0.05)。

A.ssc-miR-9-2在牛4个组织表达情况;B.hsa-miR-7在牛4个组织表达情况;C.mmu-miR-467c在牛4个组织表达情况;D.cfa-miR-143在牛4个组织表达情况。*.P<0.05A.The expression of ssc-miR-9-2 in 4 tissues of lactating Chinese Holstein cows;B.The expression of has-miR-7 in 4 tissues of lactating Chinese Holstein cows;C.The expression of mmu-miR-467c in4 tissues of lactating Chinese Holstein cows;D.The expression of cfa-miR-143 in 4 tissues of lactating Chinese Holstein cows.*.P<0.05图2 4个牛新miRNAs qRT-PCR验证结果Fig.2 The results of qRT-PCR validation of 4 predicted bovine miRNAs
2.3 靶基因预测
采用TargetScan和PicTar软件分别对44个miRNAs进行了靶基因预测,分别得到9 526和5 658个靶基因,二者共有的靶基因为4 524个。
利用KOBAS2.0在线软件和KEGG 通路对4 524个靶基因进行通路和GO分析,显著富集的信号通路包括: MAPK信号通路、Wnt 信号通路、PI3K-Akt 信号通路、TGF-beta 信号通路、ErbB 信号通路(P<0.05为显著富集的信号通路)等;显著富集的GO条目包括:序列特异性DNA结合、细胞发育、解剖结构形态、DNA结合转录调节区域、核酸结合调节区域(P<0.05为显著富集的GO条目)等。
3 讨 论
由于miRNA序列很短,在基因组中找到匹配序列的概率较大,仅仅搜索相似序列将会产生大量的假阳性结果,如果结合这些相似序列的侧翼序列可能形成二级结构来进一步筛选,能大大减少假阳性率[13]。由表3可以看出,本研究得到的发夹结构有很多,因此我们在对发夹结构筛选中要求严格符合上述预测原则以减少假阳性率。本研究通过生物信息学预测到44条牛新的候选miRNAs。在对这44 条miRNAs的前体分子进行分析的时候,我们发现两条序列相似的miRNAs分子可由不同的前体分子产生,如表4中的hsa-miR-24、hsa-miR-29b-2、ssc-miR-421、ssc-miR-9-1,其形成的两条发夹结构均符合miRNA的预测原则,而且这8条发夹结构自由能较小,这些miRNAs各项指标均符合预测标准,可以推测它们同样是存在的。这些miRNAs分子前体处于基因序列的不同位置,具有某些miRNA基因成簇排列的特性[14-15]。P.Landgraf等[16]发现,有的前体分子能同时产生多条miRNAs分子且符合miRNA筛选原则,说明同一前体分子在特定条件下通过特定的剪切方式产生不同miRNAs分子,本研究由于严格遵守筛选原则,并未发现由同一前体形成的多条miRNAs分子。
在相同的条件下,qRT-PCR结果显示,4个新预测miRNAs分子在奶牛乳腺、心、子宫和肝中均有表达,但具有组织特异表达的特点。本研究通过对子宫中不同miRNAs表达量的分析,发现miRNA表达量不同,M.Castoldi 等[17]研究发现,在同一组织中,不同的miRNA的表达量完全不同,与本研究结果一致。
本研究对3 767条miRNAs分子进行比对,最后只获得44条候选miRNAs分子,与芯片技术相比得率较低。芯片技术通过杂交可以发现大量的miRNAs分子,但是无法直接得到miRNA的前体序列、基因位置以及可能的靶基因等信息。通过生物信息学,能够弥补芯片技术的不足,还可预测其靶基因,成本低。该研究证实,通过miRNA的保守性和物种之间基因组的同源性,用生物信息学筛选和寻找新的miRNA候选序列的方法能够在较短时间里寻找出一定量的新miRNAs分子,速度快、通量大,为我们以后寻找更多的miRNAs提供了新思路、新途径。
随着各物种中miRNAs的大量分离和鉴定,miRNAs功能鉴定成为了一项重要课题,而靶基因预测成为了这项课题的重要环节。自2003年起,各种靶基因预测软件被相继开发。尽管有多种靶基因预测软件的辅助,但miRNA靶基因鉴定仍然存在一定困难。这些软件各有特点,预测结果各不相同,而且一个miRNA会预测到上百甚至上千个靶基因[18-19]。有研究表明,TargetScan和PicTar均把miRNAs种子序列与靶基因的互补以及保守性作为一个重要特征,两者预测结果相似程度达80%~90%,PicTar被证明是与试验验证结果相符程度最高的软件[20]。为提高靶基因预测准确性,本研究同时采用TargetScan和PicTar软件进行预测,并进行并集。
由显著富集的信号通路和GO条目可以看出,本研究鉴定得到的miRNA靶基因主要参与了蛋白合成、脂肪代谢以及核酸形成。结合这些信息,为进一步研究miRNA及其靶基因调控通路以及奶牛重要性状形成的遗传机制提供了依据。
总体来说,本研究通过miRNA的保守性和物种之间基因组的同源性,通过生物信息学筛选,然后qRT-PCR验证寻找牛新的miRNA是一种行之有效的方法,为奶牛基因表达调控及其性状形成机制研究提供了前期基础。
[1] LEE Y,AHN C,HAN J,et al.The nuclear RNase III Drosha initiates microRNA processing[J].Nature,2003,425:415-419.
[2] HUTVAGNER G.Small RNA asymmetry in RNAi:Function in RISC assembly and gene regulation[J].FEBSLett,2005,579:5850-5857.
[3] PASQUINELLI A E,REINHART B J,SLACK F,et al.Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA[J].Nature,2000,408(6808):86-89.
[4] LU C,TEJ S S,LUO S,et al.Elucidation of the small RNA component of the transcriptome[J].Science,2005,309(5740):1567-1569.
[5] LAI E C,TOMANCAK P,WILLIAMS R W,et al.Computational identification of drosophila microRNA genes[J].GenomeBiol,2003,4(7):R42.
[6] BEREZIKOV E,CUPPEN E,PLASTERK R H.Approaches to microRNA discovery[J].NatGenet,2006,38:S2-S7.
[7] 陈海漩,严忠海,龙健儿,等.应用生物信息学寻找山羊新的microRNA分子及其实验验证[J].遗传,2008,30(10):1326-1332. CHEN H X,YAN Z H,LONG J E,et al.Computational and experimental identification of novelmicroRNAs in goat[J].Hereditas,2008,30(10):1326-1332.(in Chinese)
[8] LAGOS-QUINTANA M,RAUHUT R,LENDECKEL W,et al.Identification of novel genes coding for small expressed RNAs[J].Science,2001,294(5543):853-858.
[9] 穆 松,钟金城,陈智华,等.牛基因组中新的microRNA预测及分析[J].中国草食动物,2010,30(1):8-11. MU S,ZHONG J C,CHEN Z H,et al.Prediction and analysis of novel miRNA in cattle[J].ChinaHerbivores,2010,30(1):8-11.(in Chinese)
[10] 赵东宇,王 岩,罗 迪,等.生物信息学中的MicroRNA预测研究[J].吉林大学学报(信息科学版),2008,26(3):276-280. ZHAO D Y,WANG Y,LUO D,et al.Advances of microRNA prediction in bioinformatics[J].JournalofJilinUniversity(InformationScienceEdition),2008,26(3):276-280.(in Chinese)
[11] ZHANG B,PAN X,COBB G P,et al.Plant microRNA:A small regulatory molecule with big impact[J].DevBiol,2006,289(1):3-16.
[12] QIU C X,XIE F L,ZHU Y Y,et al.Computational identification of microRNAs and their targets in Gossypium hirsutum expressed sequence tags[J].Gene,2007,395(1-2):49-61.
[13] XIE F L,HUANG S Q,GUO K.et al.Computational identification of novel microRNAs and targets in Brassica napus[J].FEBSLett,2007,581(7):1464-1474.
[14] XU S,WITMER P D,LUMAYAG S,et al.MicroRNA transcriptome of mouse retina and identification of a sensory organ-specific miRNA cluster[J].JBiolChem,2007,282(34):25053-25066.
[15] ROYO H,CAVAILLÉ J.Non-coding RNAs in imprinted geneclusters[J].BiolCell,2008,100(3):149-166.
[16] LANDGRAF P,RUSU M,SHERIDAN R,et al.A mammalian microRNA expression atlas based on small RNA library sequencing[J].Cell,2007,129(7):1401-1414.
[17] CASTOLDI M,SCHMIDT S,BENES V,et al.miChip:an array-based method for microRNAexpression profiling using locked nucleic acid captureprobes[J].NatProtoc,2008,3(2):321-329.
[18] VEGH P,FOROUSHANI A B,MAGEE D A,et al.Profiling microRNA expression in bovine alveolar macrophages using RNA-seq[J].VetImmunolImmunopathol,2013,155(4):238-244.
[19] LAWLESS N,FOROUSHANI A B,MCCABE M S,et al.Next generation sequencing reveals the expression of a unique miRNA profile in response to a gram-positive bacterial infection[J].PLoSONE, 2013,8(3):e57543.
[20] RAJEWSKY N.microRNA target prediction in animals[J].NatGenet,2006,38(Suppl):S8-13.
(编辑 郭云雁)
Computational and Experimental Identification of Novel MicroRNAs in Bovine by Bioinformatics
CUI Xiao-gang,YANG Shao-hua,XIE Yan,ZHANG Sheng-li,ZHANG Qin,SUN Dong-xiao*
(NationalEngineeringLaboratoryforAnimalBreeding,KeyLaboratoryofAnimalGenetics,BreedingandReproductionofMinistryofAgriculture,CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity,Beijing100193,China)
This study aimed to predict novel miRNAs of bovine by comparative genomics and bioinformatics analysis.According to the conservation of miRNAs sequence,we compared the known miRNAs in human,mouse,sheep,pig and dog with the bovine genome sequence (UMD3.1) in NCBI to predict novel miRNAs,some of which were validated by qRT-PCR.A total of 44 novel miRNAs of bovine were obtained.Four of these were randomly selected to be validated.It was found that the 4 predicted miRNAs were expressed in mammary gland,cardiac muscle,uterus and liver of lactating Chinese Holstein cows.The methodology provides an alternative approach to predict the novel miRNAs and provide a groundwork for gene expression and trait formation mechanisms in dairy cattle.
bovine;miRNA;prediction;bioinformatics
10.11843/j.issn.0366-6964.2015.08.006
2014-04-30
863课题(2013AA102504);现代农业产业技术体系北京市奶牛创新团队
崔晓钢(1985-),男,山西太原人,博士,主要从事动物分子数量遗传学研究,Tel:010-62732768,E-mail:398304310@qq.com
*通信作者:孙东晓,教授,E-mail:sundx@cau.edu.cn
S823.2
A
0366-6964(2015)08-1317-08
