猪冷冻精子的细胞凋亡及凋亡途径初步研究
2015-03-22戴建军吴彩凤张树山吴鋆龙张德福
王 昕,戴建军,吴彩凤,张树山,吴鋆龙,张德福
(1.上海海洋大学水产与生命学院,上海 201306; 2.上海市农业科学院畜牧兽医研究所,上海 201106; 3.上海农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
猪冷冻精子的细胞凋亡及凋亡途径初步研究
王 昕1,2,3,戴建军1,2*,吴彩凤1,2,张树山1,2,吴鋆龙1,2,3,张德福1,2*
(1.上海海洋大学水产与生命学院,上海 201306; 2.上海市农业科学院畜牧兽医研究所,上海 201106; 3.上海农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
旨在研究低温冷冻解冻对精子细胞凋亡的影响,并探讨凋亡发生的可能相关途径。采用流式细胞仪检测解冻后精子内的ROS水平和TUNEL染色后的细胞凋亡情况,使用酶标仪检测精子内ATP含量,利用相对荧光定量PCR技术检测不同凋亡途径中相关基因的表达量变化。结果表明:冷冻后精子活力、顶体和质膜完整率显著下降(P<0.05);冷冻精子TUNEL染色后的凋亡率(80.4%)与新鲜组(9.7%)相比显著升高(P<0.05);冷冻组精子内ROS绿色荧光比率(58.2%)亦显著高于新鲜组(P<0.05);与新鲜组0.926 μmol·L-1的ATP浓度相比,冷冻组精子的ATP浓度(0.247 μmol·L-1)则显著下降(P<0.05);qRT-PCR检测结果显示,冷冻组中TNF-α、Fas、Caspase家族、P53和Bax基因相对表达量升高,其中Fas、P53、TNF-α、Caspase-8和Caspase-9等相对表达量显著升高(P<0.05);BCL-2、BIRC-5、MnSOD、CuZnSOD和SURVIVN基因相对表达量降低,其中BIRC-5、MnSOD、SURVIVN显著降低(P<0.05)。结果表明:低温冷冻解冻会使猪精子细胞发生严重的凋亡,死亡受体外源性凋亡途径和线粒体内源性凋亡途径均可能介导了冷冻后精子的凋亡。
猪;精子冷冻;细胞凋亡;凋亡途径
精子冷冻技术是现代比较常用的辅助生殖技术,可长期有效保存有价值的基因资源,提高种公畜的利用效率和地区间交流。经过近半个世纪的研究,该技术的发展水平已有很大提高,但公猪由于精子结构的特殊性,对温度变化特别敏感,导致其抗低温能力弱于其他动物[1]。研究也表明,精浆中的部分成分会导致猪冷冻精子活力降低甚至死亡[2],再加上猪每次射精和输精量均较大,现有的猪精液冷冻技术仍不能完全满足实际生产的需求,因此对冷冻导致的猪精子损伤机理研究显得尤为迫切。
线粒体内源性凋亡途径和死亡受体外源性凋亡途径是哺乳动物细胞凋亡的两个主要途径。所有的凋亡途径都是半胱天冬酶和天冬氨酸参与的复杂过程[3-5]。线粒体内源途径主要通过活化Caspase-9,激活Caspase-3而产生Caspase的一系列级联反应;死亡受体外源途径,影响因子主要包括Fas和TNF等,产生有活性的Caspase-8激活下游Caspase级联效应。两个途径的共同参与凋亡信号的传导,引起细胞严重凋亡。猪精子冷冻后细胞的凋亡现象已有所报道,但冷冻介导的猪精子细胞凋亡途径研究则相对较少,本文通过TUNEL法检测细胞凋亡,细胞内活性氧(Reactive oxygen species,ROS)与ATP水平检测衡量线粒体功能,相对荧光定量PCR技术检测不同凋亡途径中凋亡相关基因的表达量,进而分析低温冷冻解冻猪精子的细胞凋亡现象,确定介导猪精子细胞凋亡的主要途径,为日后进一步提高冷冻效率提供理论指导。
1 材料与方法
1.1 精液采集
精液采集于上海白猪(农系)原种场。经HARMONY稀释液等温1∶1稀释之后,17 ℃保存,2 h内运回实验室。3层滤纸过滤,检测活力,活力≥0.8的精液用于低温冷冻。试验分别采用3头上海白公猪进行重复。
1.2 冷冻和解冻液配制
冷冻基础液(TCG):葡萄糖1.1 g,柠檬酸1.48 g,Tris 2.42 g,1 mL双抗,pH7.4,双蒸水定容至100 mL,0.22 μm滤器过滤后,置于4 ℃保存。冷冻I液:体积分数80%的TCG液与20%的卵黄液混合均匀。冷冻II液:体积分数91%的冷冻I液与9%的甘油混合。解冻液(BTS):葡萄糖3.7 g,二水柠檬酸钠0.6 g,碳酸氢钠0.125 g,EDTA 0.125 g,氯化钾0.075 g,1 mL双抗,双蒸水定容至100 mL。
1.3 细管冷冻精液的制作与解冻
用50 mL离心管分装好的精液,置于17 ℃恒温冰箱平衡2 h,期间多次上下颠倒混匀,在室温下800 g离心10 min后,弃上清,取沉淀与冷冻I液1∶1稀释,置于4 ℃平衡2 h;取出后加入与冷冻I液同体积的冷冻II液,置于4 ℃平衡1 h后,分装于0.25 mL的细管中,封口机封口,用液氮熏蒸法(距液氮面5 cm处熏蒸12 min)处理后,投入液氮保存。解冻时,将细管放入62 ℃水中4 s。待其溶解后取出,擦除表面水珠,并剪开两端,1∶1加入事先准备好的等体积BTS解冻液中,轻轻混匀后,置于17 ℃冰箱中备用。
1.4 精子质量检测
精子活力检测:分别取10 μL新鲜精液和冻融精液于37 ℃预热的载玻片上,从液滴一侧盖37 ℃预热的盖玻片。400×显微镜下镜检,计算精子活力。顶体完整性检测:考马斯亮蓝染色后,400×相差显微镜下随机观察200个精子,计算顶体完整率。质膜完整性检测:取50 μL精液于1 mL 37 ℃的低渗液中混匀,37 ℃水浴30 min,取10 μL液体于载玻片上,400×相差显微镜下镜检,计算质膜完整率。
1.5 TUNEL法检测细胞凋亡
一步法TUNEL细胞凋亡检测试剂盒购于碧云天生物技术研究所。每200 μL精液加入2 mL 4%的多聚甲醛,置于摇床固定1 h后取出,PBS清洗,每组各加入2 mL 0.1%Triton重悬,冰浴2 min,再用PBS清洗2遍后,加入50 μL TUNEL检测液(TdT酶8 μL,荧光标记液48 μL混匀),37 ℃避光孵育1 h后,洗涤残余TUNEL检测液,1 mL PBS悬浮精子,借助荧光显微镜初步观察绿色荧光强度,并利用流式细胞仪进行凋亡率统计(激发波长设置为450~500 nm,发射波长为515~565 nm)。
1.6 流式细胞仪检测细胞内ROS水平
活性氧ROS试剂盒购于碧云天生物技术研究所。将DCFH-DA与PBS按1∶1 000稀释成为工作液,分别加500 μL工作液与500 μL精子细胞混合后,避光置于37 ℃培养箱中,孵育20 min(每3~5 min颠倒混匀1次)。再用PBS洗涤3次,然后用流式细胞仪检测(激发波长为488 nm,发射波长为525 nm)[6-7]。
1.7 细胞内ATP浓度检测
童话大王郑渊洁说:“写童话,我不如孩子!”童话大王为什么这么说呢?大概是因为随着年龄的增长,人的认识越来越理性。人越来越成熟,而童真童趣却离我们越来越远。也许,在你三岁的时候,你会说出“风把嗓子哭哑了”这样的句子,而现在却只能说出“狂风怒吼”这样的成语……想要找回自己的童真童趣,一定有很多办法。今天老师要介绍的方法就是:在比你更小的小小孩身上去寻找自己的童年。你有三四岁的小弟弟小妹妹吗?请观察他们,记录他们的行为、他们的语言……持续观察一些日子,你一定会有所收获的。
ATP检测试剂盒购于碧云天生物技术研究所。取新鲜组和冷冻组200 μL精子样品(调整精子密度至1.5×105mL-1),各加入等体积裂解液,充分作用后,离心取上清液100 μL加入等体积ATP检测工作液,室温放置2 s后,立即用luminometer测定RLU值。标准曲线绘制时设定1.0、0.5和0.1 μmol·L-13个浓度梯度。
1.8 总RNA提取和反转录
取1 mL精液,用酸性硫氰酸胍-酚-氯仿法提取(RNAiso Plus,购于TaKaRa公司),RNase free ddH2O溶解RNA,测OD值为1.8~2.0可用。用FastQuant RT Kit(With gDNA)试剂盒进行反转录(天根生化科技有限公司),样品存放于-80 ℃保存待用。
1.9 qRT-PCR
参考NCBI获得与猪精子凋亡有关基因的cDNA序列并设计引物,GAPDH为内参基因。相关引物信息见表1,用SYBR®GreenI嵌合荧光法(SYBR Premix Ex TaqTMII试剂购于TaKaRa公司)进行Real Time PCR。反应体系:SYBR®Premix Ex Taq II(2×) 10 μL,上、下游引物各0.8 μL,ROX II 0.4 μL,cDNA模板2 μL,加ddH2O至20 μL体系。反应条件:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火34 s(Tm均为55 ℃),72 ℃延伸30 s,35个循环,退火并收集荧光,每个样品重复3次。
表1 qRT-PCR所需基因引物信息
Table 1 Primer used for qRT-PCR
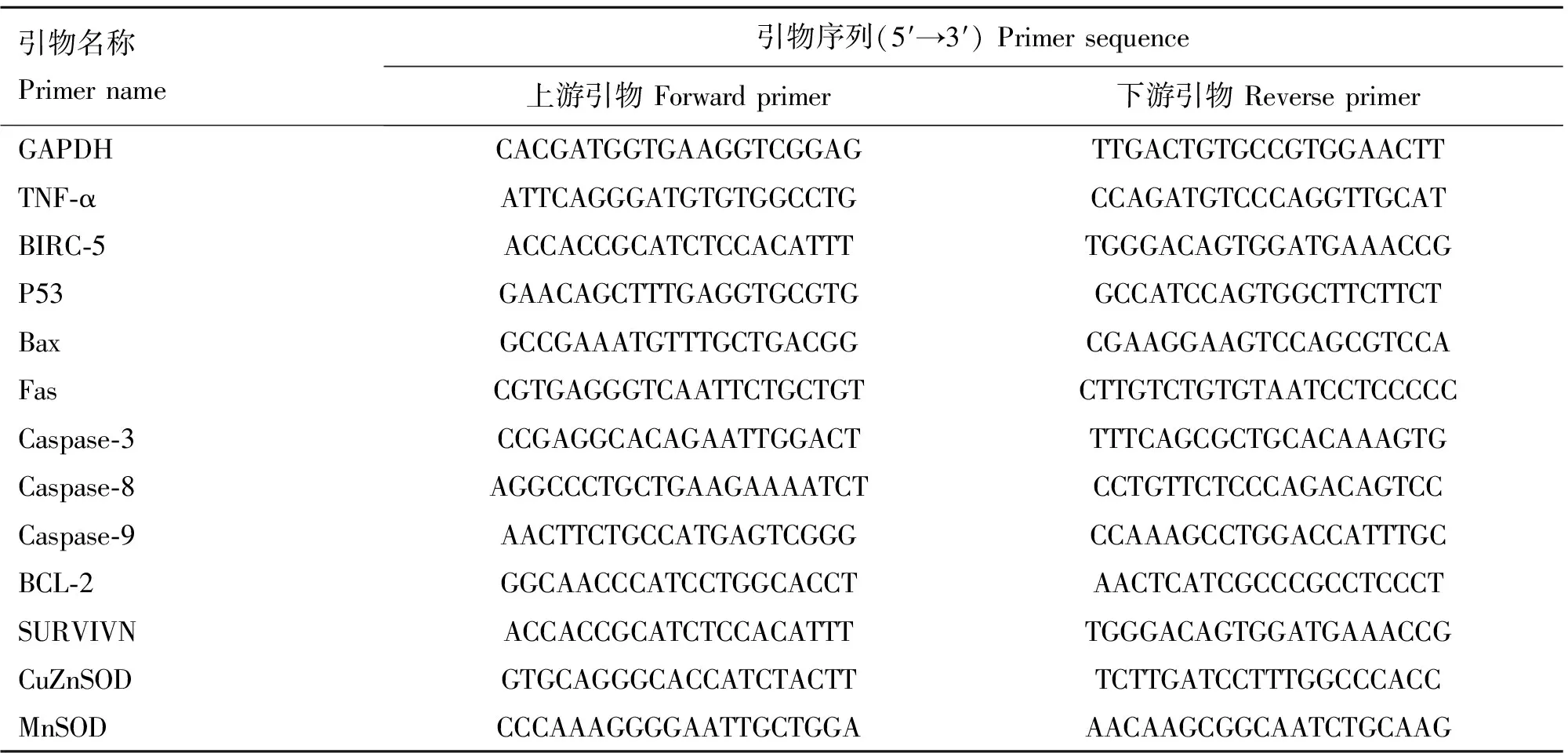
引物名称Primername引物序列(5′→3′)Primersequence上游引物Forwardprimer下游引物ReverseprimerGAPDHCACGATGGTGAAGGTCGGAGTTGACTGTGCCGTGGAACTTTNF⁃αATTCAGGGATGTGTGGCCTGCCAGATGTCCCAGGTTGCATBIRC⁃5ACCACCGCATCTCCACATTTTGGGACAGTGGATGAAACCGP53GAACAGCTTTGAGGTGCGTGGCCATCCAGTGGCTTCTTCTBaxGCCGAAATGTTTGCTGACGGCGAAGGAAGTCCAGCGTCCAFasCGTGAGGGTCAATTCTGCTGTCTTGTCTGTGTAATCCTCCCCCCaspase⁃3CCGAGGCACAGAATTGGACTTTTCAGCGCTGCACAAAGTGCaspase⁃8AGGCCCTGCTGAAGAAAATCTCCTGTTCTCCCAGACAGTCCCaspase⁃9AACTTCTGCCATGAGTCGGGCCAAAGCCTGGACCATTTGCBCL⁃2GGCAACCCATCCTGGCACCTAACTCATCGCCCGCCTCCCTSURVIVNACCACCGCATCTCCACATTTTGGGACAGTGGATGAAACCGCuZnSODGTGCAGGGCACCATCTACTTTCTTGATCCTTTGGCCCACCMnSODCCCAAAGGGGAATTGCTGGAAACAAGCGGCAATCTGCAAG
1.10 统计分析
数据采用SPSS17.0进行多重分析,以P<0.05为差异显著。qRT-PCR以GAPDH为内参基因,新鲜组和冷冻组各基因的相对表达量采用2-△△Ct法计算。
2 结 果
2.1 冷冻对精子活力、顶体和质膜完整率的影响
如表2所示,冷冻组与新鲜组精子细胞相比,精子活力(40.12vs93.20)、顶体完整率(47.00vs83.56)和质膜完整率(38.85vs82.41)均显著降低(P<0.05)。
如图1所示,绿色荧光显示精子细胞凋亡。新鲜组(图1A)TUNEL阳性精子细胞少,绿色荧光信号弱,冷冻组(图1 B)TUNEL阳性精子细胞多,绿色荧光信号强。流式细胞仪检测结果(图2)数据如表3所示,新鲜组精子细胞TUNEL阳性率为9.7%,冷冻组TUNEL阳性率为80.4%,冷冻解冻后精子细胞凋亡率显著增加(P<0.05)。
表2 冷冻对精子活力、顶体完整率和质膜完整率的影响
Table 2 Effect of cryopreservation on sperm motility,normal acrosome rate and plasma membrane integrity rate %
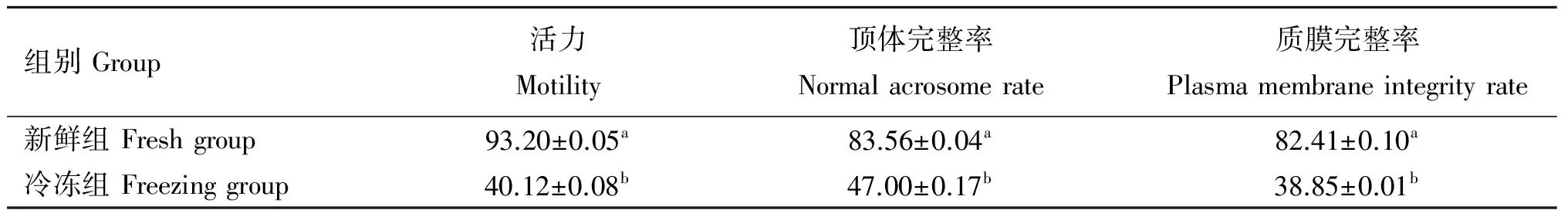
同列上标不同小写英文字母表示差异显著(P<0.05)。下同
Means in the same volumn with different small letter superscripts mean significant difference (P<0.05).The same as below
表3 流式细胞仪检测TUNEL阳性凋亡比例
Table 3 Percentage of TUNEL positive apoptosis spermatozoa by FCM analyses(%±SEM)

组别GroupsTUNEL阳性TUNELpositiveTUNEL阴性TUNELnegative新鲜组Freshgroup9.7±1.5a90.3±1.5a冷冻组Freezinggroup80.4±6.1b19.8±6.1b
2.3 冷冻对精子内ROS水平的影响
如图3所示,设置新鲜组为阴性对照(图3左曲线),比较冷冻组(图3右曲线)中ROS绿色荧光阳性比率。结果显示与阴性对照相比,冷冻组ROS绿色荧光比率(58.2%±1.27%)显著升高(P<0.05)。
2.4 冷冻对精子内ATP浓度的影响
一定范围内的荧光产生与细胞内ATP浓度成正比,可得出细胞内ATP浓度标准曲线(图4)。测得样品的RLU值后根据标准曲线分别计算新鲜组和冷冻组细胞的ATP浓度,冷冻组ATP浓度(0.247±0.04 μmol·L-1)与新鲜组(0.926±0.19 μmol·L-1)相比显著降低(P<0.05)。
2.5 猪精子细胞与凋亡有关基因mRNA实时定量PCR结果
采用GAPDH基因作为管家基因,新鲜组各基因mRNA的相对表达量均以1表示,比较冷冻组各凋亡相关基因mRNA表达变化。qRT-PCR结果表明(图5),与新鲜组相比,冷冻组BCL-2,CuZnSOD基因的相对表达量降低,MnSOD、SURVIVN、BIRC-5基因相对表达量显著降低(P<0.05);冷冻后精子Bax、Caspase-3等基因相对表达量升高,TNF-α、P53、Fas、Caspase-8、Caspase-9等基因相对表达量显著升高(P<0.05)。

A.新鲜组;B.冷冻组.绿色荧光表示TUNEL阳性,不发光表示TUNEL阴性A.Fresh group;B.Freezing group.Green fluorescent show TUNEL positive and no fluorescent show TUNEL negative图1 荧光显微镜下精子的TUNEL染色情况 400× Fig.1 TUNEL staining of spermatozoa under fluorescent microscope 400×
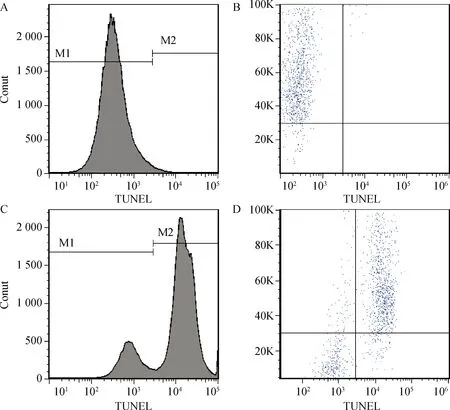
A、B.新鲜组检测图;C、D.冷冻组检测图;M1.TUNEL阴性;M2.TUNEL阳性A,B.Fresh;C,D.Freezing.M1.TUNEL negative;M2.TUNEL positive图2 流式细胞仪检测精子凋亡率Fig.2 Dot-plots and histogram analysis of spermatozoa apoptosis rate
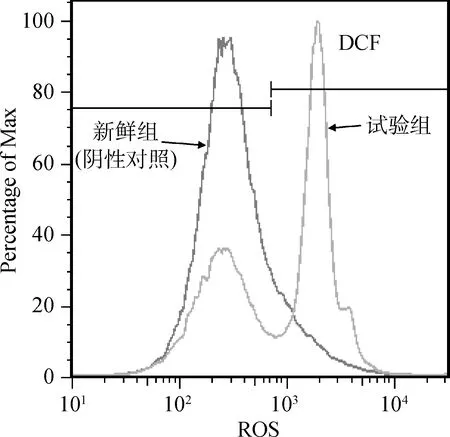
图3 流式细胞仪检测冻融精子细胞内ROS水平Fig.3 Histogram analysis of ROS levels in post-thawed spermatozoa by FCM
3 讨 论
本试验从ATP和ROS水平研究冻融精子的线粒体状态,阐述其与精子凋亡之间的联系。S.Chatterjee等[8]和C.Ortege-ferrusola等[9]在对牛和马的精子超低温冷冻后发现,冷冻可以使精子ATP浓度下降,精子发生“似凋亡”现象。U.Paash等[10]对人类精子冷冻后发现,冻精细胞内的ATP含量亦显著降低。本试验中猪精子冷冻解冻后的ATP浓度亦表现为显著下降,表明线粒体的功能在冻后受到显著影响。X.Wang等[11]研究表明,氧化应激是造成人类精子发生凋亡的一个重要原因。L.K.Thomson等[12]在人类精子冷冻研究中发现,冷冻可使精子发生明显的氧化应激反应,提升细胞内ROS水平。本研究中,猪精子冷冻后其DCF绿色荧光比率显著增加,说明在冷冻解冻过程中精子细胞内产生大量的ROS参与了调控精子细胞的凋亡过程。
G.Martin等[13]和A.M.Brum等[14]在牛和马精子冷冻过程中发现,凋亡现象主要表现有精子活力丧失,磷脂酰丝氨酸外翻(PS),Caspase活化,DNA氧化损伤等。本研究猪冷冻组精子细胞经TUNEL染色后,荧光阳性比率显著增加。表明精子细胞发生DNA断裂,DNA碎片增多,冻融精子细胞凋亡严重,与牛[13]和马[14]方面的研究结果相一致。
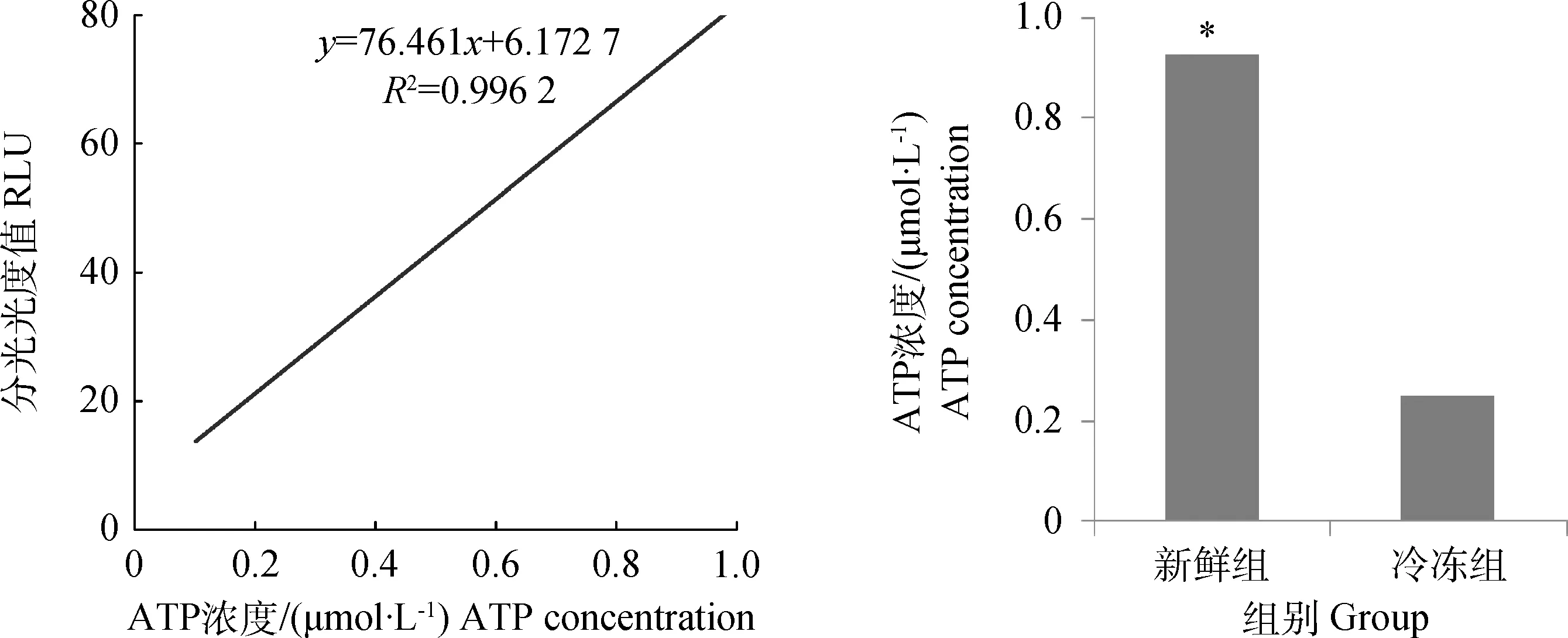
*.P<0.05图4 冷冻对猪精子ATP浓度的影响Fig.4 Effect of cryopreservation on ATP concentration of post-thawed spermatozoa
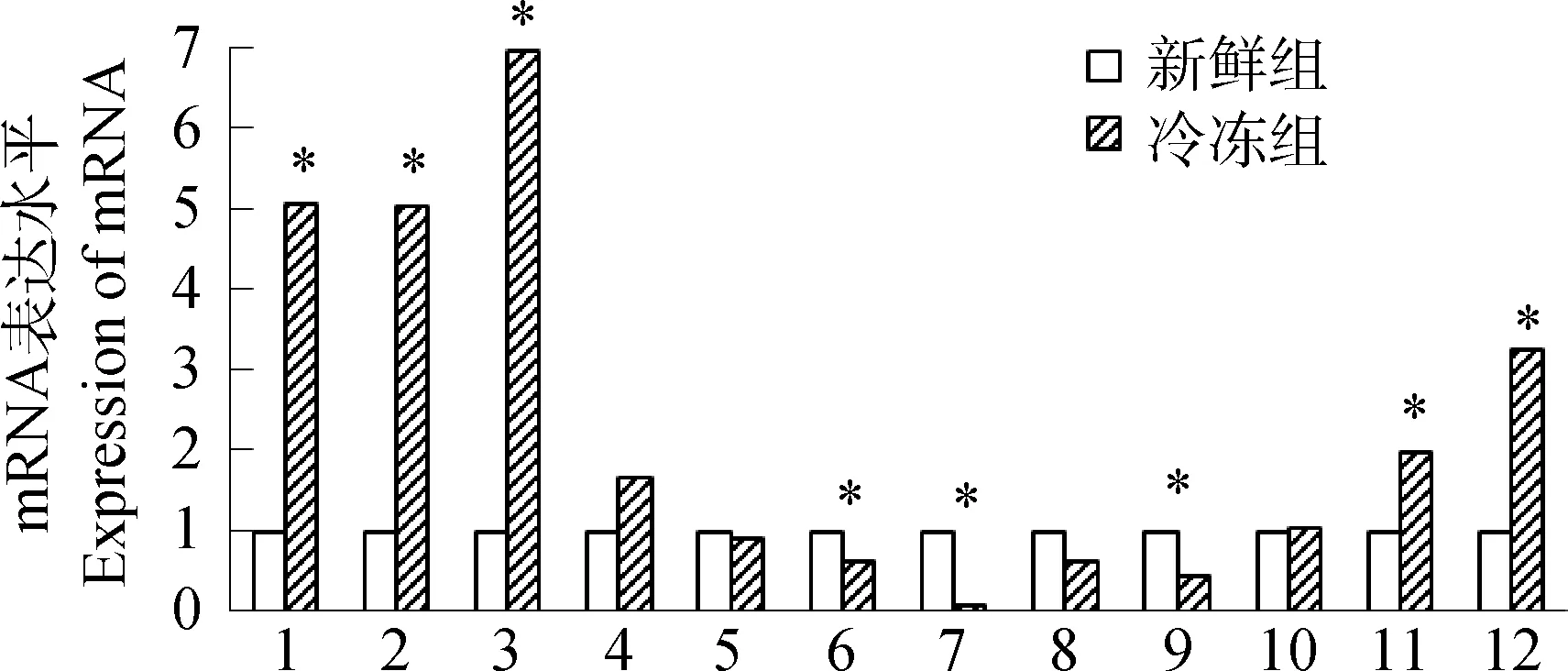
*.P<0.05.1.Fas;2.P53;3.TNF-α;4.Bax;5.BCL-2;6.BIRC-5;7.MnSOD;8.CuZnSOD;9.SURVIVN;10.Caspase-3;11.Caspase-8;12.Caspase-9图5 新鲜组和冷冻组精子细胞各基因的mRNA表达结果Fig.5 The expression of mRNA in fresh and freezing groups
细胞凋亡是由基因控制的细胞主动死亡的过程,Fas、Bax、P53基因有促进凋亡的作用,BIRC-5、BCL-2基因有抑制凋亡的作用,Caspase酶原本身需通过活化导致细胞凋亡。本研究TNF-α、Fas、Caspase-3、Caspase-8、Caspase-9、P53和Bax基因相对表达量升高,BIRC-5、BCL-2基因相对表达量降低,其中TNF-α、Fas、P53、Caspase-8和Caspase-9显著升高,结果与Y.J.Jeong等[15]的研究结果一致,说明在精子细胞凋亡过程中促凋亡因子的作用增强,抑制凋亡发生因子的作用能力减弱,最终导致凋亡现象的发生,与J.F.Kerr等在其他哺乳动物上的研究结果基本相似[16]。超氧化物歧化酶(Superoxide dismutase,SOD)能有效清除胞内ROS,抑制精子凋亡现象发生,提升精子活力。与合成SOD直接关联的MnSOD,CuZnSOD和SURVIVN等抗凋亡抗氧化基因广泛存在于真核细胞线粒体内膜中,本试验中冷冻解冻精子内MnSOD、CuZnSOD和SURVIVN等抗凋亡基因相对表达量降低,该结果与前人研究[17-18]一致,说明冷冻过程中线粒体的功能受到明显抑制,SOD相关基因表达下降,无法有效清除细胞内产生的大量ROS,导致细胞内ROS水平显著升高,ATP浓度显著下降,TUNEL阳性细胞比率显著增加,精子严重凋亡。
凋亡信号通路表明,Fas、TNF和相关Caspase(例如Caspase-8和Caspase-10)参与死亡受体外源性途径[19],本研究表明,冷冻后Fas、TNF-α和Caspase-8显著上调说明冷冻造成的精子细胞凋亡有外源性途径的参与。在线粒体介导的内源性途径中[20],细胞应激反应或凋亡信号能引起细胞色素C释放,细胞色素C作为凋亡诱导因子,能经Caspase-9酶原活化并导致下游酶活性放大(例如Caspase-3和8)而参与线粒体内源性凋亡。另外BCL-2可以通过抑制线粒体通透性转换孔开放而抑制凋亡,Bax则可以促进线粒体通透性转换孔开放而促进凋亡[21]。本研究显示精子冷冻后线粒体内源途径相关基因Caspase-9和Caspase-3表达上调,参与调节Caspase-9蛋白表达的抑制凋亡因子BCL-2下调,促凋亡因子Bax上调,均提示线粒体介导的内源性凋亡途径也参与了冻后精子细胞的凋亡。C.J.Zeng等[22]研究也与本试结果相似,表明Fas和BCL-2/Bax等基因的表达与精子凋亡有非常明显的相关性,主要是与Caspase-6/9酶被激活有关。综上表明,低温冷冻解冻过程中,线粒体内源性途径和死亡受体外源性途径均介导猪精子细胞发生凋亡,两条通路联系起来扩大了凋亡信号的传导。本试验通过研究猪精子细胞经过冷冻解冻后发生的凋亡现象和与凋亡途径有关的基因表达,证明低温是影响猪冻融精子活力下降的重要因素,初步确定介导冻融精子细胞凋亡的有效途径,为日后精子抗冻保护剂中凋亡抑制剂和抗氧化剂等的添加提供了理论参考。
[1] JOHNSON L A,WEITZE K F,FISER P,et al.Storage of boar semen[J].AnimReprodSci,2000,62(1-3):143-172.
[2] OKAZAKI T,SHIMADA M.New strategies of boar sperm cryopreservation:development of novel freezing and thawing methods with a focus on the roles of seminal plasma[J].AnimSciJ,2012,83(9):623-629.
[3] FIORE C,TREZEGUET V,LE S A,et al.The mitochondrial ADP/ATP carrier:structural,physiological and pathological aspects[J].Biochemie,1998,80(2):137-150.
[4] KINNALLY K W,ANTONSSON B.A tale of two mitochondrial channels,MAC and PTP,in apoptosis[J].Apoptosis,2007,12:857-868.
[5] RASOLA A,BERNARDI P.The mitochondrial permeability transition pore and its involvement in cell death and disease pathogenesis[J].Apoptosis,2007,12(5):815-833.
[6] CROW J P.Dichlorodihydrofluorescein and dihydrorhodamine 123 are sensitive indicators of peroxynitriteinvitro: implications for intracellular measurement of reactive nitrogen and oxygen species[J].NitricOxide:BiolChem,1997,1(2):145-157.
[7] WANG H,JOSEPH J A.Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader[J].FreeRadicBiolMed,1999,27(5-6):612-616.
[8] CHATTERJEE S,GAGNON C.Production of reactive oxygen species by spermatozoa undergoing cooling,freezing,and thawing[J].MolReprodDev,2001,59:451-458.
[9] ORTEGA-FERRUSOLA C,SOTILLO-GALAN Y,VARELA-FERNANDEZ E,et al.Detection of “Apoptosis-Like” changes during the cryopreservation process in equine sperm[J].JAndrol, 2008,29(2):213-221.
[10] PAASH U,SHARMA R K,GUPTA A K,et al.Cryopreservation and thawing is associated with varying extent of activation of apoptotic machinery in subsets of ejaculated human spermatozoa[J].BiolReprod,2004,71:1828-1837.
[11] WANG X,SHARMA R K,SIKKA S C,et al.Oxidative stress is associated with increased apoptosis leading to spermatozoa DNA damage in patients with male factor infertility[J].FertilSteril, 2003,80(3):531-535.[12] THOMSON L K,FLEMING S D,AITKEN R J,et al.Cryopreservation-induced human sperm DNA damage is predominantly mediated by oxidative stress rather than apoptosis[J].HumReprod,2009,24(9):2061-2070.
[13] MARTIN G,SABIDO O,DURAND P,et al.Cryopreservation induces an apoptosis-like mechanism in bull sperm[J].BiolReprod,2004,71:28-37.
[14] BRUM A M,SABEUR K,BALL B A.Apoptotic-like changes in equine spermatozoa separated by density-gradient centrifugation or after cryopreservation[J].Theriogenology,2008,69(9):1041-1055
[15] JEONG Y J,KIM M K,SONG H J,et al.Effect of alpha-tocopherol supplementation during boar semen cryopreservation on sperm characteristics and expression of apoptosis related genes[J].Cryobiol,2009,58(2):181-189.
[16] KERR J F,WYLLIE A H,CURRIE A R.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].BrJCancer,1972,26(2):239-257.
[17] 王明臣,郭茂锋,赵国强,等.前列腺癌及良性前列腺癌增生组织中MnSOD基因的mRNA表达水平研究[J].中国老年学杂志,2006,26(2):164-165. WANG M C,GUO M F,ZHAO G Q,et al.The study of mRNA expression of MnSOD gene in carcinoma of prostate and innocence prostate hyperplastic tissue[J].ChinaJournalofGerontology,2006,26:164-165.(in Chinese)
[18] HOLDOM M D,LECHENNE B,HAY R J,et al.Production and characterization of recombinant aspergillus fumigatus Cu,Zn superoxide dismutase and its recognition by immune human sera[J].JClinMicrobiol,2000,38(2):558-562.
[19] NAGATA S.Apoptosis by death factor[J].Cell,1997,88:355-365.
[20] LI H,ZHU H,XU C J,et al.Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis[J].Cell,1998,94:491-501.[21] SORIANO M E,SCORRANO L.Travelling bax and forth from mitochondria to control apoptosis[J].Cell,2011,145(1):15-17.
[22] ZENG C J,TANG K Y,HE L.Effects of glycerol on apoptotic signaling pathways during boar spermatozoa cryopreservation[J].Cryobiol,2014,68(3):395-404.
(编辑 程金华)
Preliminary Studies on Apoptosis and Apoptotic Pathways of Frozen Boar Spermatozoa
WANG Xin1,2,3,DAI Jian-jun1,2*,WU Cai-feng1,2,ZHANG Shu-shan1,2,WU Yun-long1,2,3,ZHANG De-fu1,2*
(1.CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China; 2.InstituteofAnimalScienceandVeterinaryMedicine,ShanghaiAcademyofAgriculturalSciences,Shanghai201106,China;3.DivisionofAnimalGeneticEngineering,ShanghaiMunicipalKeyLaboratoryofAgri-geneticsandBreeding,Shanghai201106,China)
In order to investigate the effects of cryopreservation on boar spermatozoa apoptosis and apoptotic pathway,the flow cytometry was used to detect the apoptosis state and ROS level of boar frozen spermatozoa.ATP content was measured by luminometer,and the mRNA expression level of genes involved in different apoptotic pathways were measured by real-time quantitative RT-PCR method.The results showed that the motility,normal acrosome rate and plasma membrane integrity rate of sperm after freezing were decreased greatly (P<0.05).The TUNEL-positive spermatozoa rate (80.4%) from freezing group were much higher than that of fresh group (9.7%) (P<0.05).The percentage of ROS-positive spermatozoa in freezing group (58.2%) was also obviously higher than that of fresh group (P<0.05).The cryopreservation caused a significant decrease of ATP concentration in freezing group (0.247 μmol·L-1) comparing with fresh group (0.926 μmol·L-1) (P<0.05).qRT-PCR results showed that the relative expression level from promoting apoptosis genes (TNF-α,Fas,Caspase,P53 andBax) were up-regulated,and in which the expression ofFas,P53,TNF-α,Caspase-8 andCaspase-9 increased greatly after cryopreservation (P<0.05).The relative expression level from inhibiting apoptosis genes (BCL-2,BIRC-5,MnSOD,CuZnSODandSURVIVN) were down-regulated,and in which the expression ofBIRC-5,MnSODandSURVIVNdecreased greatly (P<0.05).The results indicated that cryopreservation could lead to boar spermatozoa apoptosis.Not only extrinsic death receptor but also intrinsic mitochondrial signaling pathway might play key roles in mediating spermatozoa apoptosis after cryopreservation.
boar;spermatozoa cryopreservation;apoptosis;apoptotic pathway
10.11843/j.issn.0366-6964.2015.08.009
2015-01-05
上海市科委农业成果转化专项(123919N0700;133919N1700);国家自然科学基金(31372315);国家转基因生物新品种培育科技重大专项(2014ZX08006-005;2009ZX08006-014B)
王 昕 (1988-),女,山西太原人,硕士,主要从事动物胚胎工程研究,E-mail:winniexin1223@126.com
*通信作者:戴建军,E-mail:blackman0520@126.com;张德福,E-mail:zhangdefuzdf@163.com
S828.2
A
0366-6964(2015)08-1341-07
