山羊骨骼肌中miR-133及其靶基因的表达规律与功能研究
2015-03-22凌英会王丽娟王康岩李运生丁建平张运海章孝荣
凌英会,王丽娟,王康岩,李运生,丁建平,张运海,章孝荣*
(1.安徽农业大学动物科技学院,合肥 230036;2.安徽地方畜禽遗传资源保护与生物育种省级实验室,合肥 230036;3.安徽省羊繁育工程技术研究中心,合肥 230036)
山羊骨骼肌中miR-133及其靶基因的表达规律与功能研究
凌英会1,2,3,王丽娟1,2,王康岩1,2,李运生1,2,丁建平1,2,张运海1,2,章孝荣1,2,3*
(1.安徽农业大学动物科技学院,合肥 230036;2.安徽地方畜禽遗传资源保护与生物育种省级实验室,合肥 230036;3.安徽省羊繁育工程技术研究中心,合肥 230036)
旨在研究miR-133及其靶基因SRF在山羊骨骼肌组织和细胞中的表达情况,并探讨miR-133对SRF基因的靶向调控作用。首先利用qRT-PCR分别检测miR-133及其靶基因在初生、7月龄、18月龄的安徽白山羊和波尔山羊8个组织(心、肝、脾、肺、肾、小肠、脂肪、背最长肌)以及不同代数的山羊骨骼肌卫星细胞(F6、F9、F12)中的表达变化;采用qRT-PCR及Western印迹法检测miR-133对靶基因mRNA及蛋白质表达水平的影响。qRT-PCR检测表明,miR-133在心肌和背最长肌中的表达水平明显高于其它组织,其靶基因SRF的表达水平与其相反;miR-133在山羊骨骼肌卫星细胞中的表达水平随着细胞代数的增多而表达量增加;qRT-PCR及Western印迹法证实,miR-133对SRF蛋白表达的调控发生在转录后水平。综上表明,miR-133有望成为研究山羊骨骼肌生长发育的新型标志物;miR-133通过在转录后水平抑制SRF蛋白的表达参与调控山羊骨骼肌细胞增殖和分化,进而影响山羊骨骼肌的发育。
山羊;miR-133;靶向调控;基因表达
microRNAs(miRNAs)是一类生物中广泛存在,长20~25 bp的小分子非编码RNA,在进化过程中高度保守,转录后水平具有基因表达调控的作用[1]。miRNAs可以通过与靶基因mRNA分子的 3′UTR完全或不完全地互补配对,导致mRNA分子不稳定而使其直接降解或抑制翻译过程[2-3]。miRNAs对超过1/3的人类蛋白编码基因进行调控,在生命活动的许多方面都发挥着巨大作用[4]。同时miRNAs对肌肉质量、肌肉纤维类型和肌肉相关疾病也有很大的影响[5]。有研究表明,许多miRNAs参与调控骨骼肌增殖与分化的过程[6-7]。miR-133是肌肉特异性的miRNAs,在小鼠、猪等物种中对骨骼肌的发育有重要调控作用[8-9];miR-133能促进成肌细胞的增殖,抑制成肌细胞的分化[10]。血清反应因子(SRF)在肌肉的生长发育过程中发挥着重要作用。SRF能够通过对一系列伴侣蛋白的招募从而控制肌肉相关基因的转录,包括转录共激活剂的促血管平滑肌细胞分化因子家族的成员,促进肌肉的分化,研究发现,小鼠缺乏SRF将不能形成中胚层[11]。miR-133通过靶向作用血清反应因子(SRF),降低体内外的肌肉分化,促进肌细胞增殖[10]。
为了进一步探讨miR-133参与山羊肌肉细胞增殖与分化等生长发育机制,本研究通过进一步分析miR-133在山羊骨骼肌组织及山羊骨骼肌卫星细胞中的表达变化,筛选并验证miR-133在山羊骨骼肌发育过程中的靶基因,并对miR-133在山羊骨骼肌发育过程中可能的调控机制进行探讨。
1 材料与方法
1.1 试验材料
以合肥博大牧业科技开发有限公司种羊场的两个山羊群体24只个体作为试验材料,选取初生、3月龄、7月龄、18月龄的安徽白山羊和波尔山羊各3只。山羊从出生~成年的不同阶段的8个组织样(心、肝、脾、肺、肾、小肠、脂肪、背最长肌)为样本,每只山羊8个组织样至少取3份,迅速放于1.5 mL无RNA酶的EP管中,并立即投入液氮速冻,然后-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 细胞培养与RNA提取 采用常规方法分离山羊骨骼肌细胞,并采用差速贴壁法进行培养,收集贴壁细胞,对纯化的山羊骨骼肌细胞采用免疫荧光方法检测其特异标志蛋白Pax-7。用含10%胎牛血清和10%马血清的DMEM/F12细胞培养液,在37 ℃、5%CO2条件下培养,取处于对数生长期的细胞用于后续试验。利用TRIzol 试剂盒(TaKaRa)提取各组织样本以及细胞的总RNA,并用0.8%琼脂糖凝胶电泳检测,SMA 1000 紫外分光光度计测定其浓度和纯度后,-80 ℃保存备用。
1.2.2 引物设计与cDNA反转录 根据前期Solexa测序获取山羊的miR-133序列为靶序列。miR-133以及内参基因U6的茎环引物和特异性PCR引物由广州锐博生物公司设计并合成。另外,根据GenBank数据库中收录的绵羊和牛SRF的mRNA序列(序列号:XM-004019222和NM-001206016)用Primer 5.0软件设计目的基因的上、下游引物,引物由华大基因公司合成。各目的基因上、下游引物见表1。采用PrimerScriptTMRT Reagent Kit(TaKaRa Code:DRR037S)试剂盒,按照说明书中方法将各样品总RNA反转录成cDNA。反应体系为20 μL:总RNA(1 μg·μL-1)2 μL、5×buffer 4 μL、PrimerScript RT Enzyme Mix I 1 μL、特异性引物(5 μmol·L-1)或者Oligo dT Primer(50 μmol·L-1)1 μL,RNase水补至20 μL;反应条件为37 ℃ 15 min,85 ℃ 5 s终止反应。反应结束后,将反转录产物作10倍稀释,-20 ℃保存备用。
1.2.3 miR-133及其靶基因SRF的扩增与测序 以1.2.2反转录产物(RT产物)为模板,利用real-time PCR引物(表1)扩增目标基因,PCR反应体系为特异RT产物2 μL,10 μmol·L-1引物2 μL,2.5 mmol·L-1dNTP Mixture 2 μL,10×EXTaqbuffer 2.5 μL,5 U·μL-1TaKaRa EXTaqHS 0.15 μL,补ddH2O至25.0 μL。反应条件:94 ℃预变性30 s;94 ℃30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 5 min;4 ℃保存。PCR产物于1%琼脂糖凝胶电泳,回收,并送华大基因公司测序。
采用3′-Full RACE Core Set with PrimeScript RTase试剂盒按说明书中方法将背最长肌组织总RNA进行反转录成cDNA。使用巢式PCR方法扩增HDAC4和SRF3′UTR,特异性引物见表1。PCR条件为94 ℃预变性3 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min;4 ℃保存。取5 μLPCR反应产物进行1%的琼脂糖凝胶电泳,确认3′RACE PCR扩增产物。将得到明亮条带的PCR产物直接送华大基因公司测序。
表1 扩增及定量PCR引物
Table1 Primers used in the study

引物Primer序列(5′⁃3′)SequenceSRFForward:CAGACCTGCCTCAACTCGC,Reverse:GCCTGCTGCCCTATCACASRF3′UTR1stouterforward:AATGAGTGCCACCGGCTTTG,2stouterforward:CCCTCCTTTCCCATCACCSRFreal⁃timePCRForward:CCCTCCTTTCCCATCACC,Reverse:GCCGCTGCCTGTACTCTTGAPDHreal⁃timePCRForward:CACAGTCAAGGCAGAGAAC,Reverse:TACTCAGCACCAGCATCA
1.2.4 miR-133及其靶基因在山羊骨骼肌组织和细胞中表达水平检测 使用标准SYBR Green 实时定量PCR检测试剂盒(罗氏公司)。15 μL PCR反应体系:cDNA模板(RT产物)2 μL,real-time PCR 引物(10 μmol·L-1)0.9 μL,SYBR Green Mix 7.5 μL,ddH2O补至15 μL。PCR反应:95 ℃预变性10 min;95 ℃ 15 s,60 ℃复性和延伸1 min,40个循环; PCR产物熔解曲线的反应条件:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 1 min。
1.2.5 细胞转染与Western blot检测 设置4个梯度:50、100、150和200 nmol·L-1,对细胞转染48 h后,在荧光显微镜下观察转染效果,确定转染条件。在转染前1 d,6孔板每孔接种3×105个山羊骨骼肌卫星细胞,转染当天细胞密度约为50%。采用Promega公司FUGENHD转染试剂进行miR-1和 miR-133 mimics、miRNA阴性对照mimics、FUGENHD转染,转染48 h,进行细胞总RNA和蛋白质抽提。
提取细胞总蛋白质,定量,与上样缓冲液按比例混匀,100 ℃加热变性5 min;8%和12%SDS-PAGE电泳后,电转移至PVDF膜上,5%脱脂牛奶室温封闭1 h;加入一抗,室温孵育2 h,TBST洗涤2次,TBS洗涤1次,每次10 min。加入二抗,4 ℃孵育过夜,TBST洗涤2次,TBS洗涤1次,每次10 min,在暗室中显色、压片、显影、定影。
1.2.6 统计分析 利用ABI Step-one software v2.2对数据进行比较分析。定量PCR,miR-133及其靶基因是以U6为内参基因来校正cDNA模板的质量。利用2-△△Ct法[12]计算目的基因在不同组织中的相对表达量:△Ct=Ct Target-CtU6;△△Ct=△Ct Target-△CtCalibrator。每个定量PCR反应均进行4次生物学重复,数据以“平均值±标准误(mean±SE)”表示。利用SPSS 17.0 软件对miR-1和miR-133以及靶基因HDAC4和SRF在不同时期组织中的相对表达量进行差异显著性分析。P<0.05表示差异显著。
2 结 果
2.1 miR-133以及靶基因(SRF)的获得
山羊骨骼肌特异性RT产物为模板,目的基因的引物进行PCR扩增山羊骨骼肌miR-133和SRF基因,并利用3′RACE方法扩增,以目的基因的引物进行套式PCR扩增山羊骨骼肌SRF3′UTR基因,并用1%琼脂糖凝胶进行电泳检测。依据本课题组前期采用Solexa测序方法获得miR-133的成熟序列[13],进行分析显示,PCR产物测序发现SRF3′UTR与miR-133种子序列的结合位点为UGGUC(5′ UUGGUCCCCUUCAACCAGCUGU3′)。
2.2 miR-133及其靶基因(SRF)在山羊不同时空中的表达规律
2.2.1 miR-133在安徽白山羊和波尔山羊不同时空中的表达规律 试验数据经SPSS 17.0 单因素方差分析,LSD和Duncan多重比较。miR-133在不同月龄安徽白山羊和波尔山羊中的表达数值见图1,图1表明,miR-133在心和骨骼肌组织中有较高的表达量,而和其他组织中的表达相比有极显著的差异(P<0.01)。
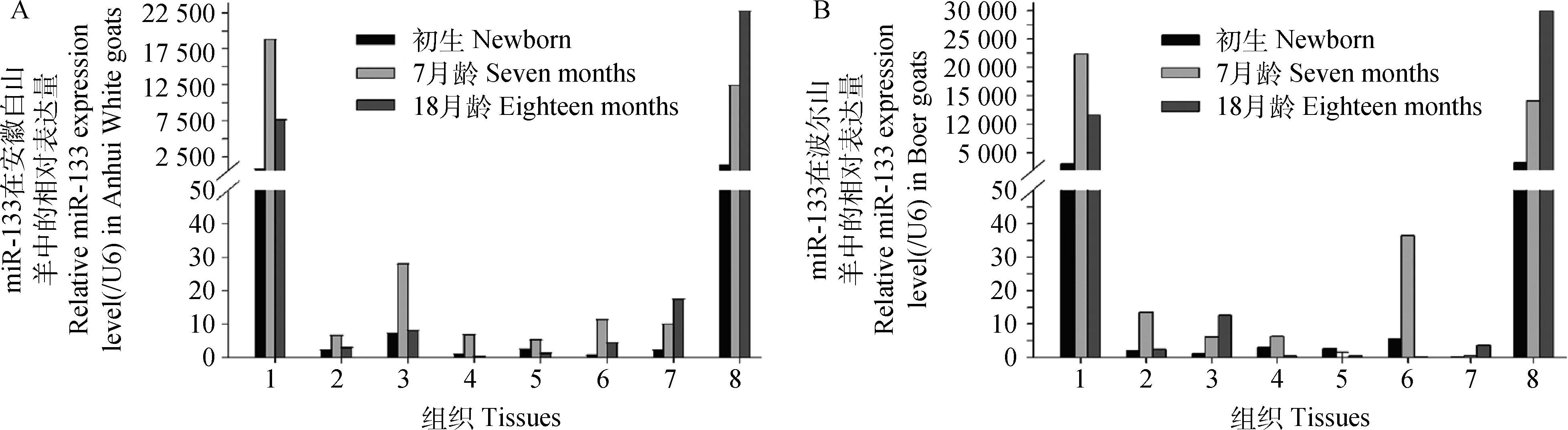
1.心;2.肝;3.脾;.4.肺;5.肾;6.小肠;7.脂肪;8.背最长肌。下同1.Heart;2.Liver;3.Spleen;4.Lung;5.Kidney;6.Small intestine;7.Fat;8.Longissimus dorsi.The same as below图1 miR-133在安徽白山羊(A)和波尔山羊(B)不同组织中的表达谱Fig.1 miR-133 expression in different tissues of Anhui White goats(A)and Boer goats(B)
2.2.2SRF在安徽白山羊和波尔山羊不同时空中的表达规律SRF在不同月龄安徽白山羊和波尔山羊两个山羊品种心、肝、脾、肺和肾、小肠、脂肪和背最长肌8个组织的表达情况见图2。从图2可以看出,SRF在不同月龄安徽白山羊和波尔山羊各组织中广泛表达,但在同一时期不同组织的表达存在差异。在安徽白山羊和波尔山羊的8种组织中,表达量较低的为背最长肌和心,这与miR-133在两种山羊的背最长肌和心中的表达是相反的。
图2 SRF在安徽白山羊(A)和波尔山羊(B)不同组织中的表达谱Fig.2 SRF expression in different tissues of Anhui White goats(A) and Boer goats(B)
2.2.3 miR-133在安徽白山羊和波尔山羊骨骼肌发育过程中的表达分析 如图3所示,miR-133在安徽白山羊和波尔山羊骨骼肌发育过程中呈现不同的表达模式。从出生~18月龄,miR-133在波尔山羊中的表达量显著高于安徽白山羊(P<0.05)。
2.3 miR-133及其靶基因(SRF)在山羊骨骼肌卫星细胞中的表达规律
数据经生物统计学软件SPSS 17.0 方差分析,LSD和Duncan多重比较,miR-133及其靶基因(SRF)在不同代数(F6、F9和F12)的山羊骨骼肌卫星细胞中的表达规律见图4。miR-133在山羊骨骼卫星细胞中的表达量随细胞代数的增多表达量也随之增多,这与其在不同月龄的背最长肌中的表达趋势相似。而它的靶基因SRF在不同代数的山羊骨骼肌卫星细胞中的表达趋势与miR-133相似。
2.4 miRNA mimics转染条件的摸索
本研究对miR-133 mimics的转染条件进行摸索。转染细胞48 h后,在荧光显微镜下观察转染效果,结果发现当miRNA 阴性对照转染的最终浓度为100 nmol·L-1时,转染效率最高(表2)。在Fu-GENE HD转染试剂的使用量为10 μL,miRNA mimics终浓度为100 nmol·L-1,荧光显微镜下可以观察到转染FAM-NC的山羊骨骼肌卫星细胞中有大量细胞显示为红色,表明miRNA mimics的转染效果较好。
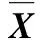
Table 2 The transfecting efficiency of FAM-NC in SSC

浓度/(nmol·L-1)Concentration染色细胞数No.ofstainedcells荧光细胞数No.offluorescentcells50401±5.07214±7.42250±3.81239±4.18161±3.92128±2.74100338±6.45466±9.85173±4.14273±5.92271±5.02117±2.93150571±10.04534±8.73520±8.14249±5.17276±4.62243±3.97200419±9.16423±8.72453±4.09202±4.78221±2.94209±5.16浓度/(nmol·L-1)Concentration染色平均细胞数Averageofstainedcells荧光平均细胞数Averageofstainedcells转染效率/%Transfectionefficiency50288±5.43176±4.0361.1100326±6.81220±4.6267.5150542±8.97256±4.5947.2200432±7.32211±4.2948.8
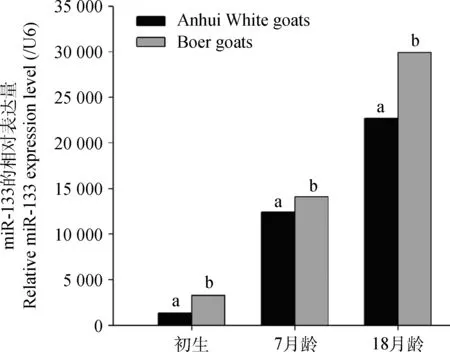
图3 miR-133在安徽白山羊和波尔山羊不同生长阶段骨骼肌中的比较分析Fig.3 Comparative analysis of miR-133 expression in skeletal muscle between Anhui White goats and Boer goats at different developmental stages
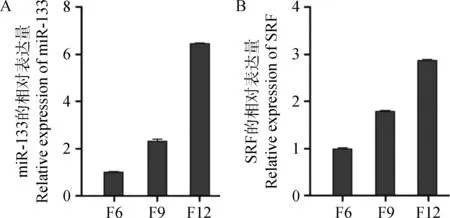
图4 miR-133(A)和SRF(B)在骨骼肌卫星细胞中的表达Fig.4 The expression level of miR-133 and SRF in SSC
2.5 miR-133 mimics瞬时转染结果
与其它对照组相比,miR-133 mimics转染组山羊骨骼肌卫星细胞中的miR-133的表达量明显上升,而NC组细胞中的miR-133未上升,从而充分说明了miR-133 mimics转染至山羊骨骼肌卫星细胞中能成功的表达miR-133(图5)。
2.6 miR-133抑制山羊骨骼肌卫星细胞SRF蛋白表达
Western印迹法结果表明,与其它组相比,采用miR-133 mimics上调山羊骨骼肌卫星细胞miR-133表达水平后,其SRF蛋白表达水平明显下降,提示miR-133能抑制山羊骨骼肌卫星细胞SRF蛋白表达(图6)。
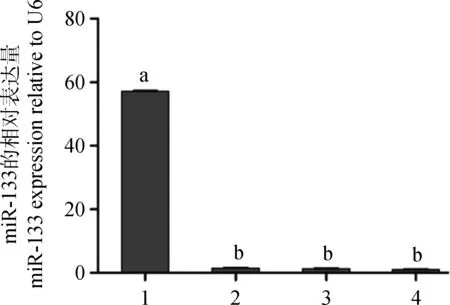
1.miR-133 mimics;2.NC;3.Mock;4.Blank.The same as below图5 SSC转染miR-133 mimics后miR-133的表达变化Fig.5 The expression of miR-133 in SSC after transfecting miR-133 mimics by real-time PCR

图6 SSC转染miR-133 mimics后SRF蛋白的变化Fig.6 Regulation of SRF protein expression by transfecting miR-133 mimics in SSC
2.7 miR-133对山羊骨骼肌卫星细胞SRFmRNA表达影响
miRNA能通过抑制靶基因的翻译或介导靶基因mRNA的降解,从而对靶基因蛋白表达发挥调控作用,为进一步明确miR-133在何种水平对SRF蛋白发挥调控作用,采用qRT-PCR方法进一步检测miR-133 mimics或miRNA阴性对照mimics转染后山羊骨骼肌卫星细胞SRFmRNA表达水平。qRT-PCR结果表明,上调miR-133表达水平对山羊骨骼肌卫星细胞SRFmRNA表达水平无明显影响(图7)。结合上述Western blot检测结果表明,miR-133通过抑制山羊骨骼肌卫星细胞SRF基因的翻译而非诱导SRFmRNA的降解抑制SRF蛋白的表达,即miR-133在转录后水平抑制SRF蛋白表达。
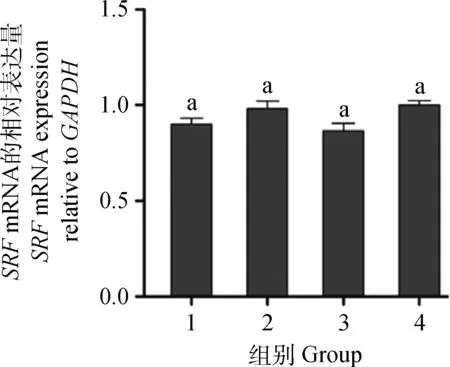
图7 转染miR-133 mimics后SRF mRNA水平的表达变化Fig.7 The expression of SRF mRNA in SSC after transfecting miR-133 mimics by real-time PCR
3 讨 论
miRNAs是一类存在较广泛且可以对基因表达进行微调控的小RNA分子,它对生物体一系列重要生命进程进行调控,包括胚胎发育、细胞增殖、细胞凋亡以及脂类代谢等[14-17],对发育过程的调控发挥着重要作用。miRNAs主要是通过与靶基因mRNA的3′UTR碱基完全或不完全互补配对,导致mRNA直接被降解,或阻断mRNA翻译进而对基因表达进行调控[18]。
miRNAs的定量表达主要有茎环反转录引物和3′端加接头两种方法,其中由于茎环反转录引物法简便、快捷、特异性好和准确性高,而被广泛运用于对miRNAs的表达研究[19-20]。而miRNA的作用机制,关键是miRNA及其靶基因的相互作用,目前主要利用生物信息学和生物学试验方法寻找并验证miRNA的靶基因[1]。采用TargetScan和PicTar预测软件,对miR-1和miR-133潜在靶基因进行预测,结果发现HDAC4和SRF基因同时被TargetScan和PicTar预测为miR-1和miR-133的靶基因。通过3′RACE试验,发现HDAC4 3′UTR有个miR-1结合位点,而SRF3′UTR有两个miR-133结合位点。另外,上调miR-1和miR-133表达水平则能下调山羊骨骼肌卫星细胞HDAC4和SRF蛋白表达水平,对HDAC4和SRFmRNA表达水平无影响。鉴于miRNA发挥作用的机制为通过翻译抑制和影响mRNA的稳定性,使其降解来下调蛋白表达,笔者认为miR-1和miR-133是在转录后水平抑制HDAC4和SRF蛋白表达。
M.Lagos-Quintana等[21]从小鼠和人的肌肉组织中克隆并鉴定出miR-1和miR-133,两个肌肉特异性表达的miRNAs[22]。miR-1和miR-133是源于同一个miRNA多顺反子,且被共同转录,但miR-1和miR-133两者发挥的作用却是相反的,miRNAs可能在调控细胞增殖和分化的平衡中起着十分重要的作用。J.F.Chen等[10]研究发现,miR-1和miR-133对骨骼肌细胞的分化成熟过程进行调控,其中miR-1能够促进骨骼肌细胞的分化过程,而miR-133却抑制分化促进成肌细胞的增殖过程。另外,Z.P.Koutsoulidout等[23]认为在骨骼肌的生长发育过程中,miR-1和miR-133的表达丰度与骨骼肌的成熟有关。miR-1和miR-133在安徽白山羊和波尔山羊骨骼肌中的表达量较高,可能对维持骨骼肌的正常功能起重要作用。另外,miR-1在安徽白山羊和波尔山羊中的表达量有随个体成熟表达减少的趋势,说明miR-1对肌肉的快速增长有着重要的作用,且有利于纤维细胞的大量复制表达,成体肌细胞的增殖和分化都衰弱时,表达量则相对减少。而miR-133随着个体的发育,表达量一直在增加,到成体时表达量最高,在成体肌细胞中发挥相当大的作用,说明成体肌细胞存在着增长的现象,需要有较高表达量的miR-133来促进其增殖。在本试验中,miR-133在安徽白山羊和波尔山羊骨骼肌发育过程中的表达变化说明miR-133可能与山羊骨骼肌的发育有关。
目前,大多数miRNAs的功能尚不清楚。因为每个miRNA靶基因的数量很多,且多个miRNAs可以同时调控1个基因的表达,因此快速且准确的预测以及鉴定miRNA的靶基因对于研究miRNA的功能至关重要。研究发现,miRNAs可以通过调控一些转录因子和信号传导因子来调节细胞的增殖和分化[24-25]。已有报道证明miR-1和miR-133能够通过调节靶基因的表达参与细胞的增殖和分化过程[10]。有研究发现miR-1和miR-133在骨骼肌细胞的分化成熟过程中呈现一定的时空表达特异性,其中miR-1是以HDAC4 为靶点促进肌生成,而miR-133是通过抑制SRF而促进成肌细胞的增殖[14]。最新研究结果显示[26],HDAC4 被磷酸化后可以解除对肌细胞增强因子2(MEF2) 的抑制作用,从而使MEF2 的转录活性增强,有利于骨骼肌细胞代谢相关基因的转录,进而对骨骼肌 IR 的发生和发展产生影响。而SRF是一种转录因子,在多个物种中广泛存在,并对细胞的生长、分化、形成和维持以及神经系统的形成等过程进行调控,尤其是在细胞骨架的构建过程中起到重要的作用[27-29]。在本研究中,HDAC4和SRF在安徽白山羊和波尔山羊的心和骨骼肌中表达量较低,而在其它组织中表达量较高,这与miR-1和miR-133在安徽白山羊和波尔山羊中表达量趋势是相反的。说明miR-1和miR-133可能是通过抑制它们的靶基因来调控骨骼肌的发育,这与J.F.Chen等[10]的观点一致。HDAC4和SRF在安徽白山羊和波尔山羊中的表达趋势与miR-1和miR-133类似,这说明miR-1和miR-133表达量的差异会影响靶基因的表达进而影响动物骨骼肌的生长与发育。另外,miR-1和miR-133在不同月龄的波尔山羊中的表达量均较高,从这些数据推测miR-1和miR-133与山羊生长发育可能具有一定的相关性。
4 结 论
本研究通过对波尔山羊和安徽白山羊不同组织中miR-133及其靶基因的表达谱分析以及在细胞和蛋白水平检测miR-133对SRF的影响,发现miR-133通过对其靶基因SRF的调控,参与山羊骨骼肌细胞增殖和分化,从而影响山羊骨骼肌的发育。
[1] 王丽娟,凌英会,张晓东,等.MicroRNA调控动物发育的研究进展[J].家畜生态学报,2012,33(6):103-106. WANG L J,LING Y H,ZHANG X D,et al.MicroRNAs regulation on animals development[J].ActaEcologiaeAnimalisDomastici,2012,33(6):103-106.(in Chinese)
[2] 潘淑娟.MicroRNA在正常和肥厚心肌中的表达与功能学研究及鉴定[D].南昌:南昌大学医学院,2009. PAN S J.The research and identification of the expression and function of microRNAs in normal and hypertrophy cardiac tissue[D].Nanchang:College of Medicine University of Nanchang,2009.(in Chinese)
[3] TOWNLEY-TILSON W H,CALLIS T E,WANG D Z.MicroRNAs 1,133,and 206:critical factors of skeletal and cardiac muscle development,function,and disease[J].IntJBiochemCellBiol,2010,42(8):1252-1255.
[4] HUANG Z P,ESPINOZA-LEWIS R,WANG D Z.Determination of miRNA targets in skeletal muscle cells[J].MethodsMolBiol,2012,798:475-490.
[5] LUO W,NIE Q,ZHANG X.MicroRNAs involved in skeletal muscle differentiation[J].JGenetGenomics,2013,40(3):107-116.
[6] CHEN J H,YIN Y L,JIANG S K,et al.Induction of microRNA-1 by myocardin in smooth muscle cells inhibits cell proliferation.Arterioscler[J].ArteriosclerThrombVascBiol,2011,31(2):368-375.
[7] YAN X C,DING L,LI Y C,et al.Identification and profiling of micrornas from skeletal muscle of the common carp[J].PLoSONE,2012,7(1):e30925.
[8] MCDANELD T G,SMITH T P,DOUMIT M E,et al.MicroRNA transcriptome profiles during swine skeletal muscle development[J].BMCGenomics,2009,10:77.
[9] PARRA P,SERRA F,PALOU A.Expression of adipose microRNAs is sensitive to dietary conjugated linoleic acid treatment in mice[J].PLoSONE,2010,5(9):e13005.
[10] CHEN J F,MANDEL E M,THOMSON J M,et al.The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J].NatGenet,2006,38(2):228-233.
[11] LI S,CZUBRVT M P,MCANALLY J,et al.Requirement for serum response factor for skeletal muscle growth and maturation revealed by tissue-specific gene deletion in mice[J].ProcNatlAcadSciUSA,2005,102(4):1082-1087.
[12] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25(4):402-408.
[13] 凌英会,张晓东,王丽娟,等.山羊肌肉组织microRNA Solexa测序与生物信息学分析[J].畜牧兽医学报,2013,44(3):481-487. LING Y H,ZHANG X D,WANG L J,et al.Solexa sequencing and bioinformatics analysis on microRNA from the goat muscle[J].ActaVeterinariaetZootechnicaSinica,2013,44(3):481-487.(in Chinese)
[14] KULKARNI S,SAVAN R,QI Y,et al.Differential microRNA regulation of HLA-C expression and its association with HIV control[J].Nature,2011,472(7344):495-498.
[15] BALEY J,LI J.MicroRNAs and ovarian function[J].JOvarianRes,2012,5(1):8.
[16] NOHATA N,HANAZAWA T,ENOKIDA H,et al.MicroRNA-1/133a and microRNA-206/133b clusters:dysregulation and functional roles in human cancers[J].Oncotarget,2012,3(1):9-21.
[17] LUO W,NIE Q,ZHANG X.MicroRNAs involved in skeletal muscle differentiation[J].JGenetGenomics,2013,40(3):107-116.
[18] PODOLSKA A,KACZKOWSKI B,BUSK P K,et al.MicroRNA expression profiling of the porcine developing brain[J].PLoSONE,2011,6:e14494.
[19] SANTIAGO G A,VERGNE E,QUILES Y,et al.Correction:analystical and clinical performance of the CDC real time RT-PCR assay for detection and typing of dengue virus[J].PLoSNeglTropDis,2013,7(1):e2311.
[20] WAGNER N M.Monitoring gene expression:quantitative real-time RT-PCR[J].MethodsMolBiol,2013,1027:19-45.
[21] LAGOS-QUINTANA M,RAUHUT R,LENDECKEL W,et al.Identification of novel genes coding for small expressed RNAs[J].Scinece,2001,294(5543):853-858.
[22] SWEETMAN D,GOLJANEK K,RATHJEN T,et al.Specific requirements of mrfs for the expression of muscle specific micrornas,miR-1,miR-206 and miR-133[J].DevBiol,2008,321(2):491-499.
[23] KOUTSOULIDOUT Z P,MASTROYIANNOPOULOSN D,FURLING J B,et al.Expression of miR-1,miR-133a,miR-133b and miR-206 increases during development of human skeletal muscle[J].BMCDevBiol,2011,11:34.
[24] HUANG Z P,ESPINOZA-LEWIS R,WANG D Z.Determination of miRNA targets in skeletal muscle cells[J].MethodsMolBiol,2012,798:475-490.
[25] WANG Z,ZANG C,CUI K,et al.Genome-wide mapping of HATs and HDACs reveals distinct functions in active and inactive genes[J].Cell,2009,138(5):1019-1031.
[26] MIANO J M.Serum response factor:toggling between disparate programs of gene expression[J].JMolCellCardiol,2003,35(6):577-593.
[27] SUN Q,CHEN G,JEFFREY W,et al.Defining the mammalian CArGome[J].GenomeRes,2006,16(2):197-207.
[28] COOPER S J,TRINKLIN N D,NQUYEN L,et al.Serum response factor binding sites differ in three human cell types[J].GenomeRes,2007,17(2):136-144.
[29] MIANO J M,LONG X,FUJIWARA K.Serum response factor:master regulator of the actin cytoskeleton and contractile apparatus[J].AmJPhysiolCellPhysiol,2007,292(1):C70-81.
(编辑 程金华)
The Expression Profiles and Function Analysis of miR-133 in Goat Skeletal Muscle Tissue and Cell
LING Ying-hui1,2,3,WANG Li-juan1,2,WANG Kang-yan1,2,LI Yun-sheng1,2,DING Jian-ping1,2,ZHANG Yun-hai1,2,ZHANG Xiao-rong1,2,3*
(1.CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei230036,China;2.LocalAnimalGeneticResourcesConservationandBiobreedingLaboratoryofAnhuiProvince,Hefei230036,China;3.EngineeringResearchCenterofReproductionandBreedinginSheepofAnhuiProvince,Hefei230036,China)
The purpose of this experiment was to study the expression of miR-133 and its target gene SRF in skeletal muscle tissue and cells in goat,and the effects of miR-133 on target gene(SRF).The qRT-PCR was used to detect different expression of miR-133 and its target gene in different tissues of newborn,7 months and 18 months old Anhui white goat and Boer goat(heart,liver,spleen,lung,kidney,small intestine,fat,longissimusdorsi) and different goat skeletal muscle satellite cells(F6,F9,F12);qRT-PCR and the Western blot was used to detect the mRNA of target gene and protein expression level.The results of qRT-PCR showed that the expression level of miR-133 in myocardium andlongissimusdorsimuscle was higher than that in other tissues,the expression level of the target geneSRFwas different from miR-133 in goat;The expression level of miR-133 in skeletal muscle satellite cells increased with the cell generations;That regulation of miR-133 onSRFprotein expression occurred at the post transcriptional level by qRT-PCR and Western blot.The results showed that miR-133 was expected to become a new marker of goat skeletal muscle growth and development;miR-133 was involved in the regulation of proliferation and differentiation of goat by inhibiting the expression ofSRFprotein in the post transcriptional level,thereby affecting the goat skeletal muscle development.
goat;miR-133;target regulating;gene expression
10.11843/j.issn.0366-6964.2015.11.005
2015-05-04
国家自然科学基金项目(31301934;31372310);安徽省自然科学基金(1308085QC54))
凌英会(1981-),男,安徽安庆人,副教授,博士,主要从事动物遗传育种与繁殖研究,E-mail:caaslyh@163.com
*通信作者:章孝荣,教授,博士生导师,主要从事动物生殖调控研究,E-mail:zhangxiaorong01@163.com
S827.2
A
0366-6964(2015)11-1944-08
