孕烷X受体应答元件萤光素酶报告基因的构建及活性检测
2015-03-21高旭东王春平杨予涛杨俊兰杨永平史国兵
冯 帆,张 帆,司 文,3,高旭东,王春平,杨予涛,杨俊兰,杨永平,史国兵
1沈阳军区总医院 药剂科,辽宁沈阳 110016;2解放军总医院 肿瘤内科,北京 100853;3南开大学医学院,天津 300192;4解放军第302医院 肝脏肿瘤诊疗与研究中心,北京 100039;5首都医科大学神经科学研究所,北京 100071
孕烷X受体应答元件萤光素酶报告基因的构建及活性检测
冯 帆1,张 帆2,司 文2,3,高旭东4,王春平4,杨予涛5,杨俊兰2,杨永平4,史国兵1
1沈阳军区总医院 药剂科,辽宁沈阳 110016;2解放军总医院 肿瘤内科,北京 100853;3南开大学医学院,天津 300192;4解放军第302医院 肝脏肿瘤诊疗与研究中心,北京 100039;5首都医科大学神经科学研究所,北京 100071
目的建立孕烷X受体(pregnane X receptor,PXR)应答元件萤光素酶报告基因,并检测其活性。方法利用化学合成方法得到五聚体PXR应答元件(everted repeat elelment-6,ER-6元件)5和(direct repeat element-3,DR-3)5序列;将五聚体PXR应答元件序列(ER6或DR3)克隆至pGL3-Promoter载体上;利用萤光素酶报告基因系统检测PXR应答元件报告基因的活性。结果PXR应答元件萤光素酶报告基因具有明确的活性。PXR激动剂茴香霉素能够剂量依赖地诱导ER6-Luc (R2=0.95;P=0.002 2)和DR3-Luc (R2=0.96;P=0.000 91)报告基因的活性,其EC50值分别为(0.11±0.04)μmol/L和(0.13±0.06) μmol/L;PXR拮抗剂酮康唑能够剂量依赖地降低茴香霉素诱导的ER6-Luc (R2=0.97;P=0.000 85)和DR3-Luc (R2=0.98;P=0.000 11)的活性,IC50值分别为(0.71±0.11)μmol/L和(1.73±0.15)μmol/L。结论成功构建了PXR应答元件报告基因,建立了PXR转录活性的检测方法。
孕烷X受体;孕烷X受体应答元件;萤光素酶报告基因;转录活性;
孕烷X受体(pregnane X receptor,PXR)是一种重要的核受体,最初仅被确定为类固醇激素受体[1-6]。PXR在消化系统肿瘤中分布广泛,其结构由N-末端结构域(N-terminal domain,N-TD)、保守的DNA结合区(DNA-binding domain,DBD)、C-末端的配体结合区(ligand binding domain,LBD)组成。PXR的LBD结构高度可变,这保证了其广谱的配体结合/应答范围[6]。PXR分布于细胞质,当与配体结合后转位至细胞核,进而启动/介导其下游基因的转录[6]。PXR的DBD包含两个锌指结构,能够和维甲酸X受体(retinoid X receptor,RXR)形成异二聚体,与其下游基因(CYP 3A4等)的启动子区所包含的PXR应答元件结合[6]。PXR结合元件分为:DRs、ERs以及IRs等不同回文序列[6]。PXR的下游基因种类多作用广,不同下游基因启动子可能具有不同的PXR应答元件模式[6]。PXR的活性受到转录调节辅因子(SRCs、NCoRs或SMRT),以及不同配体的调控[7]。随着研究的进展,多种内/外源药物/化合物都被确定是PXR的配体/激动剂[2]。这些药物能够活化PXR,诱导代谢酶(CYP 450等)及药物转运体(MDR等)的表达,对这些药物或者其他药物进行代谢和清除,最终影响治疗效果[3]。由于包括紫杉醇和丝裂霉素在内的多种化疗药物能够作为PXR的配体将其活化,因此以PXR为调控枢纽的药物代谢系统可能是肿瘤多药耐药,以及化疗药耐受的新分子机制[3]。PXR的活性受到多重因素的调控,利用萤光素酶报告基因检测系统能够快速检测PXR的活性。本研究利用化学合成方法,获得5聚体的PXR结合元件(direct repeat element-3,DR-3)5和(everted repeat elelment-6,ER-6元件)5序列,将其克隆到pGL-3Promoter载体中,利用PXR的激动剂茴香霉素及拮抗剂酮康唑检测PXR应答元件报告基因ER6-Luc和DR3-Luc的活性[4-5,8-10]。
材料和方法
1 实验材料 质粒pGL3-Prpmopter、β-gal载体和大肠埃希菌DH5α由首都医科大学杨予涛博士惠赐;HepG2细胞由本实验室保存;退火用上下游引物(寡核苷酸)(图1)由SBS公司合成(为2 OD的粉末),溶于200 μl 10 mmol/L pH=8.0 Tris缓冲液中;KpnⅠ和XhoⅠ限定性内切酶,以及T4 DNA连接酶等购自New England Biolab公司;质粒小提试剂盒、DNA胶回收试剂盒以及Luciferase报告基因试剂盒等购自Promega公司;DH5α感受态细胞购自天根公司(Qiangen);转染试剂Lipofectin AMINE2000购自Invitrogen公司;细胞培养实验室用DMEM培养基、和小牛血清购自Gibco公司;细胞培养皿及培养板等购自Corning公司;工具药物:茴香霉素和酮康唑购自美国Sigma公司,由质谱确证其结构正确,采用高效液相色谱(high performance liquid chromatography,HPLC)检测其纯度>98%,使用DMSO配制成3 mmol/L的母液,4℃保存。
2 PXR应答元件序列的克隆 在PXR下游基因CYP 3A4启动子区序列中,根据其启动子区域中包含的PXR结合位点ER6和DR3(-7836/-7208区域)设计五聚体序列,添加以XhoⅠ和KpnⅠ半酶切位点(图1),按照如下体系(表 1)和条件(表2)进行退火,按照厂商说明书,使用Promega公司DNA回收试剂盒回收所得ER6和DR3序列。

图 1 退火实验获得双链ER6和DR3元件序列所用的引物 A: DR3元件序列的引物; B ER6元件序列的引物Fig. 1 Premiers used in annealing process for double strands DR3 or ER6 sequences A: Premiers of DR3 element sequences; B: Premiers of ER6 element sequences

表 1 获得双链ER6和DR3序列的退火实验体系Tab. 1 System of annealing process to obtain the doublestrands DR3 or ER6 sequences
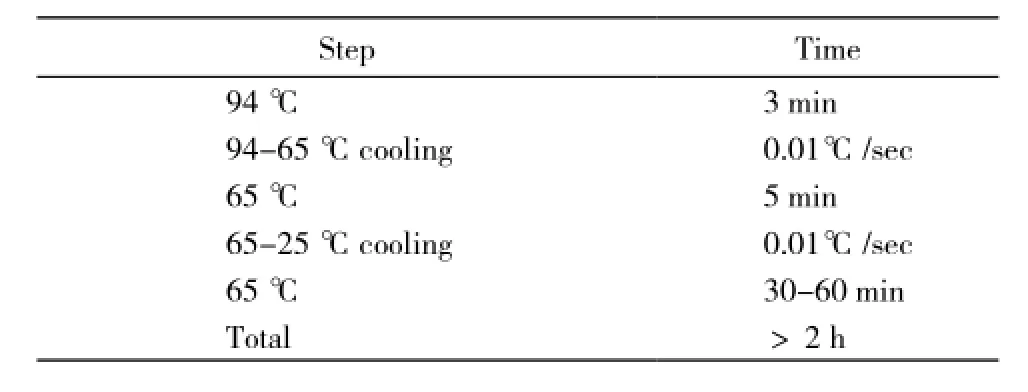
表2 获得双链ER6和DR3序列的退火实验方法Tab. 2 Methods of annealing process to obtain the double strands DR3 or ER6 sequences
3 DR3-Luc和ER6-Luc报告基因载体的构建 将pGL3-Prpmopter载体使用XhoⅠ和KpnⅠ,37℃酶切4 ~ 6 h(表3),琼脂糖凝胶电泳回收。使用T4连接酶(表4)连接PXR应答元件序列和pGL3-Prpmopter载体,16℃连接2 ~ 4 h,4℃连接过夜。将连接产物转化DH5α感受态细胞,铺板、挑菌、扩增并提取质粒,进行PCR鉴定。将PCR鉴定无误的克隆进行测序(华大公司)鉴定。
4 细胞培养及转染 使用添加10%胎牛血清的DMEM培养基培养HepG2细胞至指数增长期,用不含抗生素的DMEM培养基,将HepG2细胞种于24孔板(80% ~ 90%密度),接种24 h后,将DR3-Luc和ER6-Luc,以及内参β-gal质粒与不含血清的80 μl DMEM培养基混合;再将80 μl DMEM培养基与2.5 μl Lipoffect AMINE 2000转染试剂混合;最后将转染试剂和DNA混合,室温静置15 min,加入细胞中,转染。转染相应质粒的细胞,进行药物处理。使用1 μmol/L、0.3 μmol/L、0.1 μmol/L、0.03 μmol/L、0.01 μmol/L、0.003 μmol/L、0.001 μmol/L的系列浓度梯度的Anisomycin处理细胞,或0.3μmol/L Anisomycin预处理细胞3 ~ 5 h后,再加入10 μmol/L、3 μmol/L、1 μmol/L、0.3μmol/L、0.1 μmol/L、0.03 μmol/L、0.01 μmol/L的系列浓度梯度的Ketoconazole。
5 DR3-Luc和ER6-Luc报告基因活性的测定 基本按照王博等[11]的方法,以及Promega公司提供的Luciferase试剂盒说明书进行。细胞转染24 h后,弃去培养基,用PBS洗细胞1次,加入160 μl Promega公司提供的裂解缓冲液,放置在水平摇床上充分反应15 min,再将细胞刮下,移入1.5 ml EP管中,漩涡振荡15 min,12 000 r/min,4℃离心15 min,取上清液测定荧光素酶活性。在此基础上,用ONPG检测β-gal的活性,取前述所得上清液,约10 μl加入到450 μl含有2.7 ml/L β-巯基乙醇的Z-Buffer中,再加入100μl的0.4%邻硝基苯β-D-半乳吡喃糖苷(O-nitrophenyl-β-D-galactopyranoside,ONPG)溶液,37℃孵育,当出现浅黄色后,加入250 μl 1 mol/L的Na2CO3溶液终止,测定OD值。利用Luciferase和β-gal计算报告基因活性,在此基础上计算Luciferase的相对活性和抑制率,计算公式[12]为:
相对活性(%)=(药物处理组报告基因活性-溶剂对照组报告基因活性)/(药物最大作用组报告基因活性-溶剂对照组报告基因活性)×100%。
药物作用抑制率(%)=(激动剂处理组报告基因活性-药物处理组报告基因活性)/(激动剂处理组报告基因活性-溶剂对照组报告基因活性)×100%。
利用Origin 8.5软件在此基础上分别计算EC50和IC50值。
6 统计学分析方法 实验结果数据以-x±s表示。使用统计和绘图软件Origin 8.5中的Sigmoidal Fit模块进行回归分析,拟合药物作用的量效曲线并计算相应EC50值和IC50值;使用Polymoidal Fit模块计算药物作用曲线的R2值和P值。

表3 限定性内切酶酶切载体的实验体系Tab. 3 System of enzyme-digestion experiment for vector

表4 T4连接酶连接实验工作体系Tab. 4 System of T4 ligase experiment to obtain luciferase plasmids
结 果
1 PXR应答元件报告基因表达载体的PCR鉴定
将重组所得DR3-Luc和ER6-Luc报告基因表达载体转化大肠埃希菌DH5,挑取菌落后进行菌落PCR鉴定,与空载体相比,插入DR3(图2A)及ER6(图2B)片段后,能够得到PCR产物,而空载体则没有相应,结果均与预期相一致。
2 PXR应答元件报告基因表达载体的测序鉴定将前述所得PCR鉴定正确的ER6-Luc和DR3-Luc载体的阳性克隆进行测序分析,结果表明所得序列与目的序列相一致,无突变发生(图3)。
3 DR3-Luc和ER6-Luc报告基因的活性鉴定
PXR的激动剂茴香霉素能够剂量依赖地升高ER6-Luc(R2=0.93;P=0.004 5)和DR3-Luc(R2=0.94;P=0.011)的活性(表5)。使用PXR的拮抗剂酮康唑(表5),发现酮康唑能够剂量依赖地降低茴香霉素诱导的ER6-Luc(R2=0.97;P=0.000 85)和DR3-Luc(R2=0.98;P=0.000 11)的活性。这表明,我们成功构建了具有活性的PXR应答元件萤光素酶报告基因表达载体。

图 2 重组PXR 应答元件报告基因的PCR鉴定 A: DR3-Luc 报告基因; B: ER6-Luc报告基因Fig. 2 Identif i cation of PXR response element luciferase reporters via PCR assays A: DR3-Luc reporter; B: ER6-Luc reporter
讨 论
作为重要的核受体,PXR不仅在消化系统肿瘤中分布广泛,在乳腺癌和肺癌细胞中也有表达[13-15]。PXR在其应答基因启动子区的结合元件多样,可分为:DRs、ERs以及IRs等不同回文序列[6]。本研究选取PXR最为代表性的下游基因CYP 3A4启动子区-7836/-7208区域中的ER6和DR3结合元件,设计并化学合成其五聚体序列,克隆到pGLPromoter载体上。利用PXR的激动剂和拮抗剂处理HepG2细胞进行检测,PXR的激动剂茴香霉素能够剂量依赖地诱导ER6-Luc和DR3-Luc报告基因的活性;而PXR的拮抗剂酮康唑则能够剂量依赖地抑制茴香霉素诱导的ER6-Luc和DR3-Luc报告基因的活性,这表明本研究成功构建了PXR应答元件报告基因表达载体,在此基础上建立了PXR活性的检测方法/模型。另一方面,PXR下游基因种类多作用广,不同下游基因启动子可能具有不同的PXR应答元件模式,因此在进一步研究中建立包括IR-Luc在内的其他PXR结合元件具有重要意义[6]。
PXR的活性不仅受到转录调节辅因子(SRCs、NCoRs或SMRT),以及不同配体的调控,与其他旁路核受体的相互作用也具有重要意义[7]。PXR能够和维甲酸X受体相互作用,其活性也与肝X受体(liver X receptor,LXR)、组成型雄甾烷受体(constitutive androstane receptor,CAR)以及维生素D受体(vitamin D receptor,VDR)等存在广泛相互作用,CYP 3A4的启动子-2500区域就含有多个VDR结合位点,因此在进一步研究中克隆CARPXR,以及VDR-PXR共有应答基因启动子区的VDR/CAR应答元件亦具有重要意义[16-21]。
另一方面,肝癌具有天然的多药耐药(multidrug resistance,MDR)特性,这导致HCC患者对广谱细胞毒性化疗药都极不敏感,同时对分子靶向药物的临床应答也不确定[22-23]。由于肝是人体代谢的中心,肝癌细胞对化疗药等外源药物代谢作用非常旺盛,因而以PXR为枢纽的药物代谢和清除系统可能是肝癌等MDR的新的分子机制。除肝癌外,PXR也能够在肺癌细胞中通过诱导MDR-1等的表达,在乳腺癌细胞中通过诱导乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等的表达影响化疗药的活性[24-25]。另一方面,包括紫杉醇、丝裂霉素和喜树碱在内的多重细胞毒性化疗药物都能够作为PXR的配体,诱导其下游基因的表达[1]。此外,Harmsen等[26]亦报道,包括厄洛替尼、吉非替尼、尼洛替尼、索拉菲尼、凡德他尼等分子靶向药物(小分子蛋白激酶抑制剂)也能够作为PXR的潜在配体诱导PXR的活性,诱导MDR相关基因的表达。上述药物广泛用于肝癌、肺癌或乳腺癌的化疗,因此化疗药物对PXR活性的诱导作用可能是肿瘤化疗过程中逐渐出现的药物耐受的新分子机制。

图 3 重组PXR 应答元件报告基因的测序鉴定 A: DR3-Luc 报告基因; B: ER6-Luc报告基因Fig. 3 Identif i cation of PXR response element luciferase reporters via DNA sequencing A: DR3-Luc reporter; B: ER6-Luc reporter
本研究成功建立PXR结合/应答元件DR3和ER6的萤光素酶报告基因,建立了PXR活性的检测方法。利用DR3和ER6的萤光素酶报告基因能够快速检测PXR的活性,筛查具有对PXR激动剂样活性的药物,检测临床药物的代谢特征(PXR/ CYP 3A4诱导实验)。此外,酮康唑具有较为明确的PXR拮抗活性,也有报道指出二甲双胍也能够下调PXR介导的CYP 3A4的表达[2]。因此,本研究建立的实验方法和技术体系也为进一步研发PXR拮抗剂(有可能具有逆转MDR以及化疗药物增敏作用)奠定了坚实基础。
1 Glas J, Seiderer J, Fischer D, et al. Pregnane X receptor (PXR/ NR1I2) gene haplotypes modulate susceptibility to inflammatory bowel disease[J]. Inflamm Bowel Dis, 2011, 17(9): 1917-1924.
2 Krausova L, Stejskalova L, Wang H, et al. Metformin suppresses pregnane X receptor (PXR)-regulated transactivation of CYP3A4 gene[J]. Biochem Pharmacol, 2011, 82(11):1771-1780.
3 刘志浩,李燕.核受体对药物代谢酶和转运体的调控[J].药学学报,2012,47(12):1575-1581.
4 Istrate MA, Nussler AK, Eichelbaum M, et al. Regulation of CYP3A4 by pregnane X receptor: The role of nuclear receptors competing for response element binding[J]. Biochem Biophys Res Commun, 2010, 393(4):688-693.
5 Thompson PD, Jurutka PW, Whitfield GK, et al. Liganded VDR induces CYP3A4 in small intestinal and colon cancer cells via Dr3 and ER6 vitamin D responsive elements[J]. Biochem Biophys Res Commun, 2002, 299(5): 730-738.
6 Kakizaki S, Takizawa D, Tojima H, et al. Xenobiotic-Sensing nuclear receptors CAR and PXR as drug targets in cholestatic liver disease[J]. Curr Drug Targets, 2009, 10(11): 1156-1163.
7 Wallace BD, Betts L, Talmage G, et al. Structural and functional analysis of the human nuclear xenobiotic receptor PXR in complex with RXRα[J]. J Mol Biol, 2013, 425(14):2561-2577.
8 Heubner M, Kimmig R, Aktas B, et al. The haplotype of three polymorphisms in the SATB1 promoter region impacts survival in breast cancer patients[J]. Oncol Lett, 2014, 7(6): 2007-2012.
9 Svhmeits PC, Katika MR, Peijnenburg AA, et al. DON shares a similar mode of action as the ribotoxic stress inducer anisomycin while TBTO shares ER stress patterns with the ER stress inducer thapsigargin based on comparative gene expression profiling in Jurkat T cells[J]. Toxicol Lett, 2014, 224(3): 395-406.
10 Sil Oh E, Ok Kim C, Kim KH, et al. Effect of ketoconazole on lobeglitazone pharmacokinetics in korean volunteers[J]. Clin Ther,2014, 36(7):1064-1071.
11 王博,冯帆,张帆,等.LINE-1ORF-1p对ERα阳性乳腺癌细胞的体外影响研究[J].军医进修学院学报,2012,33(7):763-766.
12 冯帆,龙隆,李微,等.应用高内涵分析技术识别雄激素受体激动剂[J].中国药理学与毒理学杂志,2014,28(1):42-50.
13 Alternative pre-mRNA splicing in various tissues and cell lines(Rosetta/Merck Splicing Chip 1)[R/OL]. http://www.ncbi.nlm. nih.gov/geo/tools/profileGraph.cgi?ID=GDS829:174939673
14 Huang R, Murry DJ, Kolwankar D, et al. Vincristine transcriptional regulation of efflux drug transporters in carcinoma cell lines[J]. Biochem Pharmacol, 2006, 71(12): 1695-1704.
15 Raunio H, Hakkola J, Pelkonen O. Regulation of CYP3A genes in the human respiratory tract[J]. Chem Biol Interact, 2005, 151(2):53-62.
16 Sugatani J, Uchida T, Kurosawa M, et al. Regulation of pregnane X receptor (PXR) function and UGT1A1 gene expression by posttranslational modification of PXR protein[J]. Drug Metab Dispos, 2012, 40(10):2031-2040.
17 Watanabe K, Sakurai K, Tsuchiya Y, et al. Dual roles of nuclear receptor liver X receptor α (LXRα) in the CYP3A4 expression in human hepatocytes as a positive and negative regulator[J]. Biochem Pharmacol, 2013, 86(3):428-436.
18 Xiao L, Xie X, Zhai Y. Functional crosstalk of CAR-LXR and RORLXR in drug metabolism and lipid metabolism[J]. Adv Drug Deliv Rev, 2010, 62(13):1316-1321.
19 Surapureddi S, Rana R, Goldstein JA. NCOA6 differentially regulates the expression of the CYP2C9 and CYP3A4 genes[J]. Pharmacol Res, 2011, 63(5):405-413.
20 Saeki M, Kurose K, Tohkin M, et al. Identification of the functional vitamin D response elements in the human MDR1 gene[J]. Biochem Pharmacol, 2008, 76(4):531-542.
21 Pavek P, Pospechova K, Svecova L, et al. Intestinal cell-specific vitamin D receptor (VDR)-mediated transcriptional regulation of CYP3A4 gene[J]. Biochem Pharmacol, 2010, 79(2): 277-287.
22 Yuen MF, Hou JL, Chutaputti A, et al. Hepatocellular carcinoma in the Asia pacific region[J]. J Gastroenterol Hepatol, 2009, 24(3):346-353.
23 Tanaka M, Katayama F, Kato H, et al. Hepatitis B and C virus infection and hepatocellular carcinoma in China: a review of epidemiology and control measures[J]. J Epidemiol, 2011, 21(6):401-416.
24 Chirulli V, Longo V, Marini S, et al. CAR and PXR expression and inducibility of CYP2B and CYP3A activities in rat and rabbit lungs[J]. Life Sci, 2005, 76(22): 2535-2546.
25 Qiao EQ, Yang HJ. Effect of pregnane X receptor expression on drug resistance in breast cancer[J]. Oncol Lett, 2014, 7(4):1191-1196.
26 Harmsen S, Meijerman I, Maas-Bakker RF, et al. PXR-mediated P-glycoprotein induction by small molecule tyrosine kinase inhibitors[J]. Eur J Pharm Sci, 2013, 48(4-5):644-649.
Construction of pregnane X receptor response elements (ER6 and DR3) luciferase reporter and its transcription activity
FENG Fan1, ZHANG Fan2, SI Wen2,3, GAO Xudong4, WANG Chunping4, YANG Yutao5, YANG Junlan2, YANG Yongping4, SHI Guobing11Department of Pharmacy, The General Hospital of Shenyang Military Region, Shenyang 110016, Liaoning Province, China;2Department of Medical Oncology, Chinese PLA General Hospital, Beijing 100853, China;3Medical College, Nankai University, Tianjin 300192, China;4Center for Liver Cancer, 302 Military Hospital of China, Beijing 100039, China;5Institute of Disease Control and Prevention, Academy of Military Medical Sciences, Beijing 100071, China
s: YANG Yongping. Email: yongpingyang@hotmail.com; SHI Guobing. Email: guobingsh@163.com
Objective To construct the PXR response element luciferase reporter. Methods The pentamer-sequences of (Everted repeat elelment-6, ER-6 element)5and (Direct repeat element-3, DR-3 element)5were gained from chemical synthesis method. The pentamer-sequences of PXR response elements (ER-6 or DR-3) were cloned into pGL3-Promoter vectors. The transcriptional activity of PXR was measured by luciferase assay. Results The PXR response elements luciferase reporter was successfully constructed. The Anisomycin, which was the agonist of PXR, could induce the activity of ER6-Luc (R2=0.95; P=0.002 2) and DR3-Luc (R2=0.96; P=0.000 91) reporters in a dose dependent manner with the EC50value of (0.11±0.04)μmol/L and (0.13±0.06)μmol/L, respectively. The Ketoconazole, which was the antagonist of PXR, could inhibit the activity of ER6-Luc (R2=0.97; P=0.000 85) and DR3-Luc (R2=0.98; P=0.000 11) reporters induced by Anisomycin in a dose dependent manner with the EC50value of (0.71±0.11)μmol/L and (1.73±0.15)μmol/L, respectively. Conclusion The PXR response elements luciferase reporter is successfully constructed and the way to detect the transcriptional activity of PXR is established.
pregnane X receptor; pregnane X receptor response elements; luciferase reporter gene; transcriptional activity
R 73-3
A
2095-5227(2015)02-0166-05
10.3969/j.issn.2095-5227.2015.02.019
时间:2014-09-05 10:12
http://www.cnki.net/kcms/detail/11.3275.R.20140905.1012.002.html
2014-08-08
国家科技重大专项项目(2012ZX1002D2DD;2013ZX100 05002);国家自然科学基金项目(81272330;81202362)
Supported by National Science and Technology Major Project (2012ZX10 02D2DD; 2013ZX10005002); National Natural Science Foundation of China (81272330; 81202362)
冯帆,男,博士,主管药师。研究方向:肿瘤药理学。Email: fengfanbio@126.com
杨永平,男,硕士,主任医师,博士生导师,主任。Email: yongpingyang@hotmail.com;史国兵,男,博士,主任药师,博士生导师,主任。Email: guobingsh@163.com
