反相HPLC法研究影响水稻维生素C含量的关键基因
2015-03-21赵洪庆贺香嫦林建忠周延彪许光明
赵洪庆, 贺香嫦, 林建忠, 周延彪, 许光明
(1. 湖南中医药大学 药学院 湖南省教育厅中药现代化重点实验室, 长沙 410208;2. 湖南大学 生物学院, 长沙 410000)
反相HPLC法研究影响水稻维生素C含量的关键基因
赵洪庆1, 贺香嫦1, 林建忠2, 周延彪2, 许光明1
(1. 湖南中医药大学 药学院 湖南省教育厅中药现代化重点实验室, 长沙 410208;2. 湖南大学 生物学院, 长沙 410000)
HPLC测定水稻叶中维生素 C (Vc)含量的测定方法,测定后比较转基因水稻叶与普通水稻叶中Vc含量的差异,为寻找调控水稻中Vc含量的关键基因奠定基础。草酸水溶液提取水稻叶中的Vc后,反相HPLC方法测定含量,选用的色谱柱为Diamonsil C18柱(250×4.6 mm,5 μm),流动相为0.2%磷酸-甲醇,梯度洗脱,检测波长245 nm,柱温30℃。测的线性范围为 1~40 μg/mL(r=0.9992),平均回收率为98.51%,转基因水稻叶组含量为(0.356±0.009)和(0.444±0.008) mg/g,而普通组Vc含量为(0.554±0.013) mg/g,统计软件SPSS19.0分析表明二者有显著差异(P<0.01) 。此方法测水稻叶中Vc含量具有简便,快速,准确的特点;类受体蛋白激酶439即为影响水稻中Vc含量的关键基因。
转基因;水稻叶中的Vc;HPLC;类受体蛋白439
维生素C(Vc)是一种重要的植物衍生的抗氧化剂,并且是构成膳食Vc的主要来源。Vc对动植物的成长、应激反应起着重要的作用[1]。 Wheeler等提出的L-半乳糖途径被公认为高等植物中合成ASA的主要途径[2]。在拟南芥中,有9种酶被证明直接参与Vc的生物合成[ 3-8], 据文献报道[2],CSN5B(COP9信号亚基5B)能降解VTC1(Vc合成酶),影响Vc的含量。而我们所研究的类受体蛋白激酶439,通过酵母双杂交实验,验证能与CSN5B相互作用,预测蛋白激酶439是CSN5B的上游基因,可通过调控CSN5B来影响水稻中Vc含量。类受体蛋白激酶(RLK)是一类定位在质膜上,包含胞外结构域、跨膜结构域和胞内激酶域的膜蛋白。因为这类蛋白激酶的分子结构和功能类似动物细胞中的受体蛋白激酶(RPK)[9-12],并且绝大多数尚未鉴定出其配基,故称为类受体蛋白激酶。CSN5B 在酵母和植物中能与VTC1的N末端相互作用,凝胶过滤谱表明VTC1-CSN5B也与COP9信号复合物有关,而这互动通过26S蛋白酶体途径促进泛素依赖的VTC1降解。目前除了对水稻PMM和GME基因在分子和生化水平上的一些研究外,对其他参与Vc合成的基因报道较少[7-8,13-15]。
通过培育转基因439、COP9过表达的水稻苗,采用高效液相色谱法对水稻叶进行Vc含量测定,观察转基因水稻叶中Vc含量的变化情况,为寻找调控水稻叶片Vc含量的基因提供科学依据。
1 材料与方法
1.1 仪器与试剂
高效液相色谱仪(Agilent Technologies 1200,安捷伦仪器公司);5417R高速冷冻离心机(Eppendor);液氮(湖南大学提供);Vc标准品(购自湖南省药检所);甲醇(HPLC纯,购自长沙天恒试剂公司,下同),磷酸,草酸,三乙胺,以上试剂除说明的外均为分析纯。二次蒸馏水(自制),转基因水稻叶和正常水稻叶(湖南大学生物学院培育)。
1.2 色谱条件
色谱柱:Diamonsil C18柱(5 μm ,250 ×4.6 mm);流动相:A相为0.2%磷酸溶液(用三乙胺回调pH值至4.0),B相为甲醇,梯度洗脱程序为:0、7、15、30 min时对应的B%分别为5、5、25、85,总流速:1.0 mL/min;柱温:30℃;检测波长:245 nm;进样量:20 μL。
1.3 对照品溶液的配制
精称取Vc对照品0.4 g,至于100 mL棕色容量瓶中,用流动相溶解并稀释至刻度,摇匀,得浓度为0.4000 mg/mL的对照品储备溶液。分别取0.400 mg/mL的Vc对照品溶液0.25、1.25、2.50、2.75、6.25和10.00 mL于100 mL容量瓶中,加流动相稀释至刻度,得1.00、5.00、10.00、15.00、25.00和40.00 μg/mL的标准系列,摇匀,0.45 μm滤膜过滤,待用。
1.4 样品溶液的配制
按农杆菌介导的水稻转化方法培育一定时间后,准确称取0.2 g转基因439、COP9过表达水稻和正常水稻新鲜叶片,液氮下研磨成粉末,然后加5 mL 0.1%的草酸混匀,冰浴5 min,12000 r/min离心10 min。吸取上清液用0.45 μm滤膜过滤,稀释至标准液的线性浓度范围,进样测试,测试的色谱图如图1,Vc的色谱峰保留时间为4.17 min。
2 结果与讨论
2.1 试液制备及储存
由于Vc在空气中极易被氧化,尤其是在碱性条件下更快,而在酸性介质中,它受空气氧化的速度稍慢。因而用0.1%的草酸来配制Vc标准溶液。实验过程中,24 h内的测试结果较为稳定,但溶液经过36 h后,氧化现象明显,72 h后测试时有近一半的Vc被氧化了。在提取过程中,0.1%草酸液进行提取还考虑了抑制抗坏血酸氧化酶的原因。
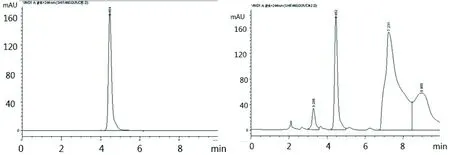
图1 HPLC检测Vc色谱图结果
2.2 色谱条件的选择
参照文献[16-17],根据Vc的紫外吸收情况,选择245 nm作为检测波长。考虑到测试需要,Vc出峰时间是在前段,为了节省试剂及分析时间,后端出的组分的分离加以忽略了,因而选择了如1.2的梯度洗脱条件,较好地实现了目标峰的分离检测。
实验中,由于Vc在水溶液中的离解作用,导致色谱峰会由于固定相吸附作用而拖尾,流动相中加入一定的酸会起到抑制离解作用,且能保护Vc避免被氧化。经试验,最终流动相确定为0.2%磷酸溶液-甲醇体系。为了防止磷酸导致流动相的酸度过大而影响色谱柱,用三乙胺回调酸度至pH值为4.0左右。实验结果表明测试中色谱峰拖尾现象得到了较好的控制。
2.3 精密度试验
取同一浓度对照品溶液,连续进样5次,每次20 μL,测得峰面积,计算相对标准偏差RSD为1.96%,表明精密度良好。
2.4 稳定性试验
取同一样品液分别于0、2、4、6和8 h进样20 μL,峰面积基本不变,RSD为2.09%,表明样品液在8 h内稳定性良好。
2.5 重复性试验
取同一批次的样品液,按样品液制备项下操作,平行制备5份,测得含量,计算RSD为2.11%,说明该样品成分测定的重复性良好。
2.6 标准工作曲线
将1.4制备的标准溶液,分别进样20 μL,记录峰面积,得测试V c的标准工作曲线。线性回归方程为:Y=57.40X-46.75(r=0.9992),表明在测试过程中Vc在1~40μg/mL范围内呈良好的线性关系。
2.7加标回收率试验
取6份同样的样品,按样品处理方法平行处理,按等浓度加标方法,每份等量加入Vc标准品,测试回收率情况,试验结果如表1,得平均回收率为98.51%,RSD为1.91%。测试的准确性达到要求。

表1 样品加标回收率测量结果
2.8 样品含量测定
取5批次的2组不同转基因水稻叶样品与普通水稻叶样品,每批次测来自不同植株的叶片6片的含量,按样品处理方法处理,取平均值得每批叶片中Vc含量。5个批次的测量结果如表2。用SPSS19.统计分析软件进行分析,发现转基因水稻叶样品与普通水稻叶中的Vc含量有明显差别(P<0.01)
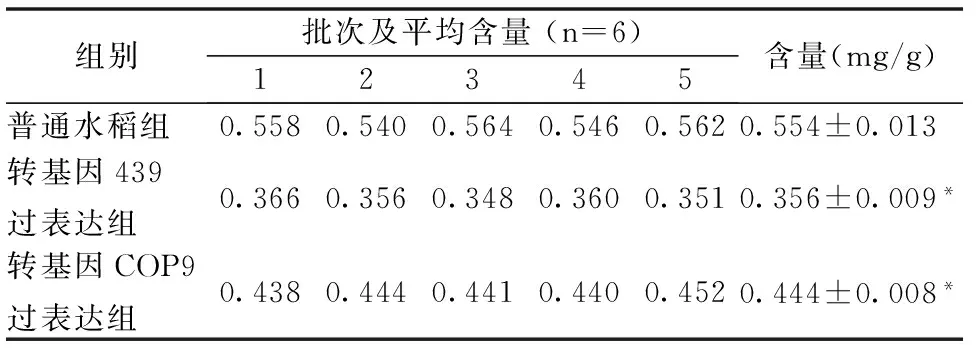
表2 不同批次的转基因和普通水稻叶中Vc含量比较
*—与普通水稻组比较 (P<0.01)。
3 结论
建立的高效液相方法分析水稻中的Vc含量,该方法能对主要组分进行完全分离,对非定量组分快速洗脱,从而节省了分析时间和流动相。实验中,为防止Vc的离解作用导致色谱峰拖尾而影响定量的精密度和准确性,流动相中加入0.2%磷酸溶液。同时为防止磷酸酸度过大而影响色谱柱,用三乙胺回调酸度至pH值4.0左右。实验结果表明测试中色谱峰拖尾现象得到了控制,该定量方法的线性范围宽,回收率、精密度和重复性均较高,适合于水稻叶等的Vc含量分测定。
实验表明,普通水稻叶组(对照组)Vc含量最高,COP9过表达组次之,439过表达组最低。由于COP9能够降解Vc合成酶(VTC1),所以COP9过表达组比对照组中Vc含量要低,又由于439能够激活COP9,使COP9降解活性增高,所以使Vc含量进一步降低。本文通过对水稻Vc含量的研究,找到了调控水稻叶片Vc含量的关键基因,为水稻Vc的合成与降解提供了理论研究依据,更好地为水稻的分子育种提供了广阔的前景。
[1]Conklin P L, Williams E H, Last R L. Environmental stress sensitivity of an ascorbic acid-deficientArabidopsismutant[J]. Proc Acad Sci, 1996, 93(18): 9970-9974.
[2]Wheeler G L, Jones M A, Smirnoff N. The biosynthetic pathway of vitamin C in higher plants[J].Nature, 1998, 393(5): 365-369.
[3]Tahata K, Oba K, Suzuki K. et al.Generation and properties of ascorbic acid deficient transgenic tobacco cells expressing antisense RNA for L-galactono-1,4-lactone-dehydrogenase[J]. Plant J, 2001, 27(2):139-148.
[4]Wolucka B A, Persiau G, Doorsaelaere J V, et a1.Partial purification and identification of GDP-mannose 3", 5"-epimeraac ofArabidopsisthaliana,a key enzyme of the plant vitanmin C pathway[J].Proc Natl Acad Sci USA, 2001, 98(26):14843-14848.
[5]Gatzek S, Wheeler G L, Smirnoff N.Antisense suppression of L-galactose dehydrogenase inArabidopsisthalianaprovides evidence for its role in ascorbate synthesis and reveals light modulated L-galactose synthesis [J].Plant J, 2002, 30(4): 541-553.
[6]Linster C L, Clarke S G. L-ascorbatc biosynthesis in higher plants:the role of VTC2 [J]. Trends Plant Sci, 2008,13(11):567-573.
[7]Qian W, Yu C, Qin H, et al. Molecular and functional analysis of phosphomannomutase(PMM) from higher plants and genetic evidence for the involvement of PMM in ascorbic acid biosynthesis inArabidopsisandNicotianabenthamiana[J]. Plant J, 2007, 49(3): 399-413.
[8]Maruta T, Yonemitsu M, Yahuta Y, et a1. Arabidopxis phosphomannose isomerasel. but not phosphomannose isomerase 2, is essential for ascorbic acid biosynthesis[J]. J Biol Chem, 2008, 283(43): 28842-28851.
[9]Wang J, Yu Y W, Zhang Z J.ArabidopsisCSN5B interacts with VTC1 and modulates ascorbic acid synthesis[J]. The Plant Cell, 2013, 25(2): 625-636.
[10]Hanks H K, Ouinn A M, Hunter T. The protein kinase family: conserved feature and deduced phylogeny of the catalytic domains[J]. Science, 1988, 241(4861) :42-52.
[11]Yarden Y, Ullrich A. Growth factor receptor tyrosine kinases[J]. Annu Rev Biochem, 1988, 57: 443-478.
[12]Ullrich A, Schlessinger J. Signal transduction by receptors with tyrosine kinase activity[J]. Cell, 1990, 61(2): 203-212.
[13]Fransson L A, Mani K. Novel aspects of vitamin C:how important is glypican 1 recycling[J]. Trends Mol Med, 2007, 13(4): 143-149.
[14]Watanabe K, Suzuki K, Kitamura S. Characterization ot a GDP-D-mannose 3",5"-epimerase from rice [J]. Phytochemistry, 2006, 67(4): 338-346.
[15]张桂云,徐 根,于恒秀等. 水稻维生素C合成相关基因的表达分析[J]. 扬州大学学报:农业与生命科学版,2011,32(1):15-19.
[16]迪丽努尔.马里克,沙拉买提,曼苏尔.高效液相色谱法测定野蔷薇果中Vc含量的研究[J].食品研究与开发,2008,29(7):87-89.
[17]黄桂颖,陈悦娇,白卫东.RP-HPLC测定夏橙中Vc含量[J].安徽农业科学,2008,36(6):2197-2198.
Study on regulation of the key genes on Vitamin C content in the rice by HPLC
ZHAO Hong-qing1, HE Xiang-chang1, LING Jian-zhong2,ZHOU Yan-biao2, XU Guang-ming1
(1. Key Laboratory of Modernization Education, College of Pharmaceutical Science, Hunan University of Chinese Medicine, Changsha 410208; 2. Biology School, Hunan University , Changsha 410000, China)
The difference of Vc content in leaves was compared between transgenic rice and ordinary rice to find the key genes which regulate the Vc content. Leaf Vc in the rice leaves was extracted with oxalic acid solution. The determination was performed with RP-HPLC on Diamonsil C18 column(250×4.6 mm,5 μm) under the condition of gradient elution with 0.2% phosphoric acid-methanol as mobile phase, detection wavelength of 245 nm and column temperature at 30℃. The detection linear range was 1-40 μg/mL(r=0.9992) and average recovery was 98.51%. The statistic analysis with SPSS19.0 soft showed significant differences(P<0.01) of Vc content between transgenic rice leaf group, (0.356±0.009) and (0.444±0.008) mg/g, and the normal group, (0.554±0.013) mg/g. Result showed that this method was simple, rapid and accurate for determination of Vc in rice leaf. The result indicated that receptor protein 439 was the key gene for regulation on Vc content in the rice.
transgenic;Vc in rice leaves;HPLC;receptor protein 439
2014-07-15;
2014-08-19
湖南省教育厅科研项目(11C0943,11C0952)资助;湖南省中药学重点学科建设项目
许光明,副教授,博士,研究方向为生物医药分,E-mail:1052262329@qq.com。
S511
A
2095-1736(2015)01-0052-03
doi∶10.3969/j.issn.2095-1736.2015.01.052
