北冰洋楚科奇海浮游细菌丰度和生产力及其分布特征
2015-03-21高源何剑锋陈敏林凌张芳
高源,何剑锋,陈敏,林凌,张芳
(1.厦门大学 海洋与地球学院,福建 厦门 361005;2.中国极地研究中心 国家海洋局极地科学重点实验室,上海 200136;3.厦门大学 近海海洋环境科学国家重点实验室,福建 厦门 361005)
北冰洋楚科奇海浮游细菌丰度和生产力及其分布特征
高源1,2,何剑锋2*,陈敏1,3,林凌2,张芳2
(1.厦门大学 海洋与地球学院,福建 厦门 361005;2.中国极地研究中心 国家海洋局极地科学重点实验室,上海 200136;3.厦门大学 近海海洋环境科学国家重点实验室,福建 厦门 361005)
2012年夏季中国第5次北极科学考察期间,对北冰洋楚科奇海及其北部边缘海浮游细菌丰度和生产力进行了测定,并将其与环境因子进行了相关性分析。结果显示,楚科奇海浮游细菌丰度的变化范围为0.56×108~6.41×108cells/dm3,平均为2.25×108cells/dm3;细菌生产力介于0.042~1.92 mg/(m3·d)(以碳计)之间,平均为0.54 mg/(m3·d) (以碳计),与已有研究结果基本相当。陆架区细菌丰度和生产力要明显高于北部边缘区,但前者的单位细菌生产力则较低。与环境因子的相关性分析显示,细菌丰度与温度和叶绿素a浓度存在显著正相关(p<0.01),表明北极变暖导致的海水升温及浮游植物生物量的增加均会促进细菌的生长,从而进一步提高细菌在海洋生态系统和碳循环中的作用。但陆架区的细菌生产力与环境参数均没有显著相关性,表明其影响因素较为复杂;生产力在北部边缘区则仅与叶绿素a存在显著正相关(p<0.01),表明浮游植物生长过程产生的溶解有机碳(DOC)是细菌生长最为主要的碳源,碳源的单一可能制约细菌的生产从而导致该海域无冰状态下细菌丰度的增加不如预期,但融冰过程带来的大量DOC将促进细菌活性的增加。
浮游细菌;细菌生产力;北极;楚科奇海;环境因子
1 引言
楚科奇海北面为加拿大海盆,南面通过白令海峡与白令海相通,西接东西伯利亚海,东临波弗特海,其深度不到50 m的海域占总面积的一半以上,是北冰洋生产力最高的边缘海之一。该海域常年受来自北太平洋、加拿大海盆以及东西伯利亚海海水的影响[1],其中从南面通过白令海峡进入楚科奇海的海流包括:低温高盐的阿纳德流、高温低盐的白令海陆架水以及阿拉斯加沿岸流[2]。另外,楚科奇海海冰的季节性消融过程,同样会影响该海域的浮游生物群落[3]。
浮游细菌(以下简称细菌)是海洋中分布最广、数量最多的生物类群,该类群可通过“微生物碳泵”影响海洋碳循环[4]。细菌既是海洋中有机物的分解者,同时也是海洋中的生产者[5—6]。它们可以吸收海洋中的溶解有机碳(DOC)合成颗粒有机碳(POC)并进入食物网。此外,经由细菌合成的生物量,除一部分被原生动物捕食、继续参与食物网的物质循环外[7],另一部分则可以附着在颗粒物上,通过沉降作用向深海输出,通过生物泵作用调节大气CO2含量[8-9]。
楚科奇海所在的北冰洋太平洋扇区是近年来北冰洋海冰覆盖面积变化最为显著的海区[10],海冰的显著变化会对浮游生态系统产生深刻影响。目前在北冰洋太平洋扇区已有少量针对细菌的研究,研究内容包括丰度、生产力以及对浮游植物藻华的响应,主要集中在阿拉斯加沿岸、加拿大海盆区,以及北冰洋中心区等海域[11-12],但对楚科奇海细菌随纬度的变化特性尚未展开相关研究。本文于2012年夏季中国第5次北极科学考察期间,对楚科奇海及其北部边缘区纬向大断面进行了细菌丰度以及生产力的对比分析,并结合温度、盐度和营养盐等环境因子,分析细菌丰度、生产力与环境的相关性,以阐明该海域细菌的纬向分布特征及其对环境变化的潜在响应。
2 材料与方法
2.1 调查时间与区域
2012年9月4日至8日中国第5次北极科学考察期间,利用“雪龙”号极地考察破冰船对楚科奇海及其北部边缘区纬向大断面(66°~80°N)共18个站位的环境参数(温度、盐度、叶绿素浓度、营养盐)和细菌丰度进行了测定,并在其中5个站位测量细菌生产力(图1)。

图1 楚科奇海及其北部边缘海采样站位Fig.1 Sampling stations in Chukchi Sea and its northern border area标示圆圈的站位为开展细菌生产力测定的站位Stations with red cycle is the stations sampling for bacterial production analysis
2.2 海洋环境参数
温度和盐度数据由“雪龙”船配备的SBE 911 plus CTD 获得。营养盐数据由SBE 911 plus CTD配备的24瓶10 dm3Rosette采水器分层采集的水样分析获取;其中陆架浅水区按0、10、20、30、40、50、75、100 m 以及叶绿素a极大值层分层;海盆深水区按0、30、50、75、100、125、150、200 m 和叶绿素a极大值层分层。每层各取水样100 cm3,用孔径0.45 μm、直径47 mm 的GF/F玻璃纤维滤膜过滤,滤液在4℃临时保存,48 h内在船上实验室按Grasshoff等推荐的方法用Skalar san++型营养盐自动分析仪测得[13]。
2.3 叶绿素a浓度
叶绿素a采样层位与细菌丰度的采样层位一致,每层采集250 cm3水样。水样经 25 mm直径的GF/F玻璃纤维滤膜负压过滤,滤膜在10 cm3的90%丙酮中低温、避光萃取24 h,用AU-10型唐纳荧光计测定[14]。
2.4 细菌丰度
细菌水样采集与营养盐和叶绿素a采样层位相同。各层用预先经稀盐酸浸泡并冲洗烘干的棕色聚乙氧基对苯甲酸酯(PEB)瓶采集100 cm3水样,经孔径50 μm的筛绢预过滤后,取1 cm3于Falcon进样管中,加入SYBR Green I染色剂(终浓度1/10 000,体积比)避光染色15 min,在船上用BD FACSCalibur型流式细胞仪测定细菌丰度。
2.5 细菌生产力
在5个站位进行细菌生产力的测定。细菌培养层位与丰度选取相同。每层各取3个平行样,每个样品各加入20 cm3海水于50 cm3事先灭菌的带螺盖玻璃培养瓶中,并在其中一个培养瓶中加入2 cm3甲醛溶液,混匀作为对照组,其余两个作为实验组。3个平行样各加入1 cm3的3H-亮氨酸工作液(5 μCi/cm3),混匀,用锡纸包裹两层,置现场温度避光培养2 h。取出后实验组中加入2 cm3甲醛摇均。样品用直径25 mm、0.7 μm混合纤维膜过滤,并用2 cm35%的三氯乙酸淋洗培养瓶加入滤器,抽滤至干;分别用5%三氯乙酸和80%乙醇淋洗滤筒内壁和滤膜;待滤膜自然干燥后放入闪烁瓶中,冷冻保存带回国内实验室。
在陆上实验室,向闪烁瓶中加入0.5 cm3乙酸乙酯,再加入10 cm3闪烁液,混匀、避光静置2 h后,用Perkin Elmer公司的Tri-carb 2009TR低本底液体闪烁计数仪测量3H放射性活度,并根据下式计算细菌生产力:
(1)
BP=1.55×106·Ri,
(2)
式中,Ri为亮氨酸吸收率,单位为 mmol/(dm3·h);Us为样品放射性活度值,单位为 Bq;Ub为空白样放射性活度值,单位为 Bq;Sa为3H在亮氨酸中的放射性比活度,单位为 Bq/mmol;T为样品培养时间,单位为 h;V为样品体积,单位为 dm3;BP为细菌生产力,单位为 μg/(dm3·h);1.55×106为细菌吸收1 mol亮氨酸转换为碳生产量(以μg计)的转换系数,单位为 μg/mmol。
2.6 数据处理
用CellQuest软件处理获得细菌丰度数据,用SigmaPlot 12.5和SPSS 20.0软件对细菌丰度和温、盐、营养盐以及叶绿素a数据等环境参数之间做皮尔森相关性分析(Pearson Correlation Analysis)。考虑到本航次只测定了浮游细菌的总丰度,而没有进行分类研究,所以采用单个细菌合成生物量的能力,即细菌生产力(bacterial production)与细菌丰度(bacterial abundance)的比值(BP/BA),来进行楚科奇海细菌活性的评估。
3 结果
3.1 温度、盐度、叶绿素a浓度的分布
温度、盐度和叶绿素a浓度的剖面分布见图2。温度的变化范围为-1.65~7.57℃,平均值为0.26℃(见图2a)。高温海水主要集中在楚科奇海陆架区(SR11站位以南),特别是在白令海峡附近以及SR07站。在73°N以北的楚科奇边缘海(SR12站位以北),海水的温度降至-1.65~-0.13℃,明显低于南部海区。盐度变化范围为25.40~33.19,平均值为30.46。整个断面海水存在明显的分层现象:30 m以深的海水具有高盐的特征,盐度均高于30。在白令海峡附近海域以及M01—M07站,海水盐度较低。叶绿素a浓度的变化范围在0.01~1.93 mg/m3之间,平均值为0.47 mg/m3(见图2c),其中楚科奇海陆架区的叶绿素a浓度相对较高,最大值则出现在SR14站位的50 m层。在楚科奇边缘海M01站(77°N附近)20 m及100 m处,叶绿素a浓度呈现极小值。
3.2 细菌丰度分布
细菌丰度的剖面分布见图3a。丰度变化范围为0.56×108~6.41×108cells/dm3,平均值为2.25×108cells/dm3(n=96)。最低值出现在断面最北端SR16站位100 m处,最高值出现在楚科奇海陆架边缘SR11站位0 m。其中,楚科奇海细菌丰度的变化范围为1.22×108~6.41×108cells/dm3,平均值为3.89×108cells/dm3(n=36);楚科奇边缘海的丰度变化范围为0.56×108~3.05×108cells/dm3,平均值为1.27×108cells/dm3(n=60),陆架区的细菌丰度要明显高于边缘海。在楚科奇海陆架区,细菌丰度由表到底基本呈下降趋势。但在楚科奇海台以西海域的30~50 m则存在一个丰度极大值层(见图3a)。
3.3 细菌生产力分布特征
楚科奇海及其边缘海细菌生产力的分布见图3b,变化范围为0.042~1.92 mg/(m3·d) (以碳计)(n=29),平均值为0.54 mg/(m3·d) (以碳计)。水柱总细菌生产力的变化范围为12.10~53.46 mg/(m2·d) (以碳计)(n=5)。细菌生产力的最大值出现在SR03站的10 m层,最小值出现在断面最北端SR16站的100 m层。与细菌丰度相对应,在楚科奇海北部陆架区、SR12站位40 m层以及门捷列夫海岭50 m处,细菌生产力也出现了一个较小的峰值(图3b)。

图3 细菌丰度(a)、细菌生产力(以碳计)(b)、细菌生产力/细菌丰度比值(c)的断面分布Fig.3 Distribution of BA (a), BP (in carbon)(b) ratio of BP/BA(c)
3.4 细菌丰度、细菌生产力与环境因子的相关性

3.5 细菌丰度与细菌生产力的相关性
细菌丰度与生产力的皮尔森相关性分析结果显示,相关性系数为0.37(p<0.05,n=40)。对其进行线性回归拟合,得出线性回归方程为:y=4.08+0.51x(r2=0.37,n=40,t=2.43,p=0.02)。单位细菌的生产力分布见图3c,可明显看出,该断面的BP/BA值普遍较低,但位于门捷列夫海岭的M04站位表层存在一个BP/BA高值区,此外,在74°N楚科奇陆架区北部边缘40 m水层和白令海峡附近表层存在着BP/BA的次高值区。
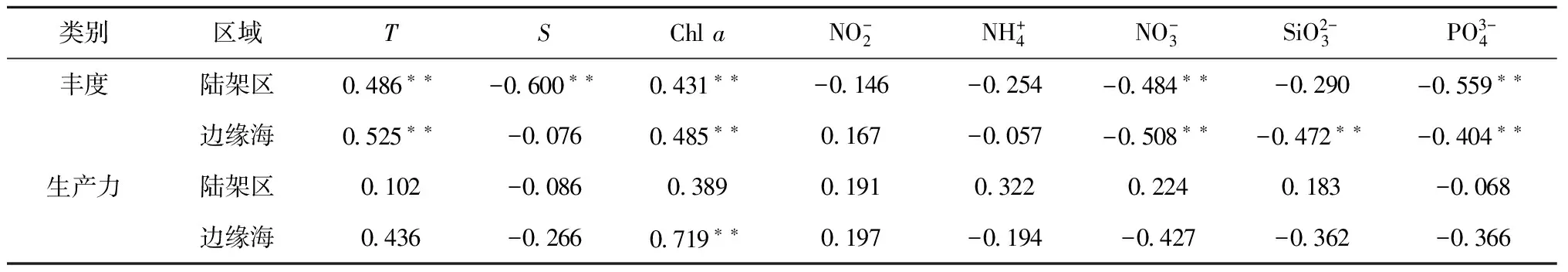
表1 楚科奇海陆架区与北部边缘海细菌丰度、生产力与环境因子的相关性分析
**表示置信度p<0.01(双边检验)。
4 讨论
4.1 浮游细菌丰度和生产力的变化特征
Anderson和Rivkin[7]在北极Resolute Passage海域观测到细菌丰度的季节变化介于0.6×108~3.3×108cells/dm3之间,其中最高值出现在8月;Sherr等[15]测得北冰洋中心海盆夏季0~40 m水层的细菌丰度为1.9×108~6.7×108cells/dm3,平均值为(3.23±0.7)×108cells/dm3。本文所得楚科奇海细菌丰度在上述报道值之间,但是明显低于2008年中国第3次北极科学考察在该海域测得的细菌丰度[16]。
南北极海域的细菌生产力数据见表2。楚科奇海及其北部边缘区的细菌生产力与其他北极海域相当。但就整个研究断面而言,相对于北部的低生产力,楚科奇海南部及白令海峡附近海域则呈现较高生产力的状态。

表2 南、北极海域细菌生产力的报道值
4.2 浮游细菌丰度和生产力的环境影响因素

细菌生产力与环境因子的相关性分析结果显示,细菌生产力仅仅在楚科奇海北部边缘海与叶绿素a呈现显著正相关(见表1)。造成这一结果的原因可能是陆架区和边缘海区DOC的来源不同。DOC是细菌进行生物量合成的必要原料。海洋中的DOC主要来源于浮游植物的释放、有机物降解释放以及陆地径流的输入。楚科奇海陆架区除了浮游植物光合作用释放的DOC外,太平洋入流水也携带了DOC,包括大量陆源DOC[25]。在光降解等过程的作用下,惰性DOC逐渐变成可被细菌所利用的类型[26]。因此在该海域细菌生产力与叶绿素a没有明显的相关性。对于楚科奇海边缘海,由于陆地径流影响基本可以忽略,因此海域DOC的来源相对比较单一。细菌主要利用浮游植物所释放的DOC来满足自身的新陈代谢,导致细菌生产力与叶绿素a存在显著的相关性。根据细菌丰度、生产力与各环境参数的相关性可以推测,当海水温度升高时,极地细菌丰度将呈现增长的趋势,而温度升高所导致的高纬度海冰的融化,也会促进其增长。
4.3 细菌丰度与细菌生产力之间的关系
本研究显示,细菌丰度与生产力之间的线性关系较差(r2=0.37,n=40,p=0.02),可能意味着并非所有的浮游细菌均参与了POC的合成。Pearce等[27]的研究表明,细菌群落中并不是所有的细菌均能发挥生产者的作用。而是部分高核酸含量(HNA,High Nucleic Acids)的细菌才拥有合成生物量的能力,其余部分细菌则处于较低活力或者休眠状态[28]。这种以核酸含量高低作为细菌活力大小的标准在一定程度上解释了本文的结果。但是Sherr等[29]指出以核酸含量高低来判断细菌活力的方法仍需深入讨论。例如,在南极半岛附近海域,低核酸含量(LNA,Low Nucleic Acids)的细菌与细菌生产力的相关性更为显著[30]。但不管如何区分,HNA与LNA在一定程度上可能反映了细菌群落活性的差异。丰度越高的细菌种群,其内部结构往往比低丰度的种群复杂得多,其物种多样性也更为丰富[31],且各个细菌种群相互联系紧密,承担不同的生态功能[32]。
本研究在门捷列夫海岭附近海域观察到的表层高细菌活性现象,应当与该海域的低细菌丰度有关。从上述分析可知,楚科奇海陆架区的细菌丰度要明显高于北部边缘海。高细菌丰度会使得种群之间的竞争加剧,可利用的营养物质减少,有一部分细菌很可能处于低活力甚至休眠状态,导致单个细菌平均活性较低。另外,海冰融化也可能是导致门捷列夫海岭海域表层BP/BA高值的原因之一。从断面盐度分布可以看出,M01-M07站位20 m以浅是整个断面盐度最低的区域(见图2),这很有可能是海冰融化后造成的现象。Sala等[33]发现,含有大量融冰水的极地表层水表现出很高的单位细菌生产力。Uchimiya等[34]的研究也显示,加拿大海盆海冰融化后所伴随的有机物输入会促进表层海水中原核生物的生产力以及生长。因此,细菌的大量繁殖使得这一海域表现出较高的细菌活性。
5 结论
楚科奇海浮游细菌丰度的变化范围为0.56×108~6.41×108cells/dm3,平均为2.25×108cells/dm3;细菌生产力介于0.042~1.92 mg/(m3·d) (以碳计)之间,平均为0.54 mg/(m3·d) (以碳计)。细菌丰度与生产力均随纬度的升高而降低。楚科奇海陆架区和北部边缘区的细菌丰度和生产力存在显著差异,陆架区细菌丰度和生产力均较高,但单位细菌生产力较低。研究海域细菌丰度与温度和叶绿素a含量存在显著正相关,显示全球变化导致的水温升高及浮游植物生物量的增加有利于细菌的生长。在楚科奇海北部边缘区,细菌生产力仅与叶绿素a含量存在明显正相关,表明细菌生长与浮游植物光合作用过程所释放的DOC密切相关,融冰过程带来的大量DOC将促进细菌活性的增加。
致谢:感谢“雪龙”号极地科考破冰船和第五次北极考察队员的支持。特别感谢中国海洋大学矫玉田高级工程师提供海水温、盐数据,以及国家海洋局第二海洋研究所金海燕研究员和郝锵副研究员分别提供营养盐与叶绿素数据。
[1] Asahara Y,Takeuchi F,Nagashima K,et al. Provenance of terrigenous detritus of the surface sediments in the Bering and Chukchi Seas as derived from Sr and Nd isotopes: implications for recent climate change in the Arctic regions[J]. Deep-Sea Research Ⅱ: Topical Studies in Oceanography,2012,61/64: 155-171.
[2] 赵进平,史久新,金明明,等. 楚科奇海融冰过程中的海水结构研究[J]. 地球科学进展,2010,25(2): 154-162.
Zhao Jinping,Shi Jiuxin,Jin Mingming,et al. Water mass structure of the Chukchi sea during ice melting period in the Summer of 1999[J]. Advances in Earth Science,2010,25(2): 154-162.
[3] Wang J,Hu H G,Goes J,et al. A modeling study of seasonal variations of sea ice and plankton in the Bering and Chukchi Seas during 2007-2008[J]. Journal of Geophysical Research: Oceans,2013,118(3): 1520-1533.
[4] 焦念志,骆庭伟,张瑶,等. 海洋微型生物碳泵——从微型生物生态过程到碳循环机制效应[J]. 厦门大学学报: 自然科学版,2011,50(2): 387-401.
Jiao Nianzhi,Luo Tingwei,Zhang Yao,et al. Microbial carbon pump in the ocean-from microbial ecological process to carbon cycle mechanism[J]. Journal of Xiamen University: Natural Science,2011,50(2): 387-401.
[5] Vallières C,Retamal L,Ramlal P,et al. Bacterial production and microbial food web structure in a large arctic river and the coastal Arctic Ocean[J]. Journal of Marine Systems,2008,74(3/4): 756-773.
[6] Vézina A F,Demers S,Laurion I,et al. Carbon flows through the microbial food web of first-year ice in resolute passage (Canadian High Arctic)[J]. Journal of Marine Systems,1997,11(1/2): 173-189.
[7] Anderson M R,Rivkin R B. Seasonal patterns in grazing mortality of bacterioplankton in polar oceans: a bipolar comparison[J]. Aquatic Microbial Ecology,2001,25(2): 195-206.
[8] Wilkins D,Yau S,Williams T J,et al. Key microbial drivers in Antarctic aquatic environments[J]. FEMS Microbiology Reviews,2013,37(3): 303-335.
[9] 陈立奇,高众勇,杨绪林,等. 北极地区碳循环研究意义和展望[J]. 极地研究,2004,16(3): 171-180.
Chen Liqi,Gao Zhongyong,Yang Xulin,et al. Prospects of research on carbon cycle in the arctic[J]. Chinese Journal of Polar Research,2004,16(3): 171-180.
[10] Arrigo K R,Perovich D K,Pickart R S,et al. Phytoplankton blooms beneath the sea ice in the Chukchi Sea[J]. Deep-Sea Research Ⅱ: Topical Studies in Oceanography,2014,105: 1-16.
[11] Steward G F,Smith D C,Azam F,et al. Abundance and production of bacteria and viruses in the Bering and Chukchi Seas[J]. Marine Ecology-Progress Series,1996,131(1/3): 287-300.
[12] Ortega-retuerta E,Fichot C G,Arrigo K R,et al. Response of marine bacterioplankton to a massive under-ice phytoplankton bloom in the Chukchi Sea (Western Arctic Ocean)[J]. Deep-Sea Research Ⅱ: Topical Studies in Oceanography,2014,105: 74-84.
[13] Grasshoff K,Ehrhardt M,Kremling K. Methods of Seawater Analysis[M]. Weinheim: Verlag Chemie Gmb H,1999: 177-187.
[14] Parsons T R,Maita Y,Lalli C M. A Manual of Chemical and Biological Methods for Seawater Analysis[M]. New York: Pergamon Press,1984.
[15] Sherr E B,Sherr B F,Wheeler P A,et al. Temporal and spatial variation in stocks of autotrophic and heterotrophic microbes in the upper water column of the central Arctic Ocean[J]. Deep-Sea Research Ⅰ,2003,50(5): 557-571.
[16] 林凌,何剑锋,张芳,等. 2008年夏季白令海和北冰洋异养浮游细菌丰度与分布特征[J]. 海洋学报,2011,33(2): 166-174.
Lin Ling,He Jianfeng,Zhang Fang,et al. Heterotrophic bacterial abundance and distribution in the Bering Sea and the Arctic Ocean in the summer of 2008[J]. Haiyang Xuebao,2011,33(2): 166-174.
[17] 陈敏,黄奕普,郭劳动,等. 北冰洋: 生物生产力的“沙漠”?[J]. 科学通报,2002,47(9): 707-710.
Chen Min,Huang Yipu,Guo Laodong,et al. Arctic Ocean: “desert” of biological production? [J]. Chinese Science Bulletin,2002,47(9): 707-710.
[18] Garneau M,Roy S,Lovejoy C,et al. Seasonal dynamics of bacterial biomass and production in a coastal arctic ecosystem: franklin bay,western Canadian Arctic[J]. Journal of Geophysical Research: Oceans,2008,113(C7): C07S91.
[19] Malmstrom R R,Straza T R A,Cottrell M T,et al. Diversity,abundance,and biomass production of bacterial groups in the western Arctic Ocean[J]. Aquatic Microbial Ecology,2007,47(1): 45-55.
[20] Bøsrsheim K Y. Bacterial production rates and concentrations of organic carbon at the end of the growing season in the Greenland Sea[J]. Aquatic Microbial Ecology,2000,21(2): 115-123.
[21] Lochte K,Bjørnsen P K,Giesenhagen H,et al. Bacterial standing stock and production and their relation to phytoplankton in the Southern Ocean[J]. Deep-Sea Research Ⅱ: Topical Studies in Oceanography,1997,44(1/2): 321-340.
[23] Kirchman D L,Morn X A G,Ducklow H. Microbial growth in the polar oceans-role of temperature and potential impact of climate change[J]. Nature Reviews Microbiology,2009,7(6): 451-459.
[24] 李宏亮,陈建芳,高生泉,等. 西北冰洋中太平洋入流水营养盐的变化特征[J]. 海洋学报,2011,33(2): 85-95.
Li Hongliang,Chen Jianfang,Gao Shengquan,et al. Nutrients variation of the Pacific inflow in the western Arctic Ocean[J]. Haiyang Xuebao,2011,33(2): 85-95.
[25] Mathis J T,Hansell D A,Bates N R. Strong hydrographic controls on spatial and seasonal variability of dissolved organic carbon in the Chukchi Sea[J]. Deep-Sea Research Ⅱ: Topical Studies in Oceanography,2005,52(24/26): 3245-3258.
[26] Amado A M,Farjalla V F,Esteves F D A,et al. Complementary pathways of dissolved organic carbon removal pathways in clear-water Amazonian ecosystems: photochemical degradation and bacterial uptake[J]. FEMS Microbiology Ecology,2006,56(1): 8-17.
[27] Pearce I,Davidson A T,Bell E M,et al. Seasonal changes in the concentration and metabolic activity of bacteria and viruses at an Antarctic coastal site[J]. Aquatic Microbial Ecology,2007,47(1): 11-23.
[28] Jellett J F,Li W K W,Dickie P M,et al. Metabolic activity of bacterioplankton communities assessed by flow cytometry and single carbon substrate utilization[J]. Marine Ecology Progress Series,1996,136: 213-225.
[29] Sherr E B,Sherr B F,Longnecker K,et al. Distribution of bacterial abundance and cell-specific nucleic acid content in the Northeast Pacific Ocean[J]. Deep Sea Research I: Oceanographic Research Papers,2006,53(4): 713-725.
[30] Ortega-retuerta E,Reche I,Pulido-villena E,et al. Exploring the relationship between active bacterioplankton and phytoplankton in the Southern Ocean[J]. Aquatic Microbial Ecology,2008,52(1): 99-106.
[31] Kirchman D L,Cottrell M T,Lovejoy C. The structure of bacterial communities in the western Arctic Ocean as revealed by pyrosequencing of 16S rRNA genes[J]. Environmental Microbiology,2010,12(5): 1132-1143.
[32] Cohan F M. What are bacterial species?[J]. Annual Review of Microbiology,2002,56: 457-487.
[33] Sala M M,Arrieta J M,Boras J A,et al. The impact of ice melting on bacterioplankton in the Arctic Ocean[J]. Polar Biology,2010,33(12): 1683-1694.
[34] Uchimiya M,Fukuda H,Nishino S,et al. Does freshening of surface water enhance heterotrophic prokaryote production in the western Arctic? Empirical evidence from the Canada Basin during September 2009[J]. Journal of Oceanography,2011,67(5): 589-599.
The spatial distribution of abundance and production of bacterioplankton in and near Chukchi Sea, Arctic Ocean
Gao Yuan1, He Jianfeng2, Chen Min1,3, Lin Ling2, Zhang Fang2
(1.CollegeofOceanandEarthSciences,XiamenUniversity,Xiamen361005,China; 2.KeyLaboratoryforPolarScience,PolarResearchInstituteofChina,StateOceanicAdministration,Shanghai200136,China; 3.StateKeylaboratoryofMarineEnvironmentalScience,XiamenUniversity,Xiamen361005,China)
The abundance and production of bacterioplankton with their correlations with environmental factors were investigated in the Chukchi Sea and its northern border areas in 2012 summer. The abundances of bacterioplankton in and near the Chukchi Sea range from 0.56×108to 6.41×108cells/dm3, with an average of 2.25×108cells/dm3. Bacterial productions are between 0.042 mg/(m3·d) (in carbon) and 1.92 mg/(m3·d) (in carbon), with an average of 0.54 mg/(m3·d) (in carbon). These results are similar with previous studies in the Arctic Ocean. In the shelf region, the abundances and productions of bacteria are obviously higher than those in the northern border areas, but the specific bacterial production is lower. The environmental correlation analysis shows that bacterial abundance is positively correlation with temperature and Chlaconcentration (p<0.01), indicating that both the increase of water temperature and phytoplankton biomass will enhance the growth of bacterioplankton in the Chukchi Sea which will further promote the role of bacteria in the marine ecosystem and carbon cycle. On the contrary, bacterial production has no correlation with environmental factors in the shelf region, but shows a significant positive correlation with Chlain northern border area (p<0.01), suggesting that the growth of bacteria mainly depends on DOC released by phytoplankton in border area. The simplicity of carbon source may restrict the productivity of bacteria in the northern border area, and the DOC released from melting ice will stimulate the bacterial activity.
bacterioplankton; bacterial production; Arctic; Chukchi Sea; environmental correlation
10.3969/j.issn.0253-4193.2015.08.009
2014-11-24;
2014-12-31。
国家自然科学基金(41476168,41206189);南北极环境考察与评估专项(CHINARE2011-2015);海洋公益专项(201105022)。
高源(1988—),男,山东省日照市人,博士研究生,主要从事极地海洋细菌生产力研究。E-mail:453357493@qq.com
*通信作者:何剑锋,研究员,主要从事极地生态学研究。E-mail:hejianfeng@pric.org.cn
P727,Q938
A
0253-4193(2015)08-0096-09
高源,何剑锋,陈敏,等. 北冰洋楚科奇海浮游细菌丰度和生产力及其分布特征[J]. 海洋学报,2015,37(8):96—104,
Gao Yuan, He Jianfeng, Chen Min, et al. The spatial distribution of abundance and production of bacterioplankton in and near Chukchi Sea, Arctic Ocean[J]. Haiyang Xuebao,2015,37(8):96—104, doi:10.3969/j.issn.0253-4193.2015.08.009
