挪威海和格陵兰海海水DMS分布特征及影响因素研究
2015-03-21厉丞烜王保栋杨桂朋
厉丞烜,王保栋,杨桂朋
(1. 国家海洋局 第一海洋研究所 海洋生态研究中心,山东 青岛 266061;2. 中国海洋大学 化学化工学院,山东 青岛 266100)
挪威海和格陵兰海海水DMS分布特征及影响因素研究
厉丞烜1,王保栋1,杨桂朋2*
(1. 国家海洋局 第一海洋研究所 海洋生态研究中心,山东 青岛 266061;2. 中国海洋大学 化学化工学院,山东 青岛 266100)
于2012年7—9月现场测定了北极挪威海和格陵兰海区域海水二甲基硫(DMS)及其前体物质二甲巯基丙酸内盐(DMSP,分溶解态DMSPd和颗粒态DMSPp)的含量,研究了其空间分布格局及其影响因素,探讨了表层海水DMS的生物周转和去除途径。结果表明,表层海水DMS、DMSPd和DMSPp的平均浓度分别为5.36 nmol/L、15.63 nmol/L 和96.73 nmol/L,受挪威海流和北极深层水影响,表层海水二甲基硫化物浓度呈现出由低纬度向高纬度海域递减的趋势。DMSPd和DMSPp浓度与Chla浓度均有显著的相关性,说明浮游植物生物量是影响挪威海和格陵兰海二甲基硫化物生产的重要因素。表层海水DMS生物生产和消费速率平均值分别为18.19 nmol/(L·d)、15.67 nmol/(L·d)。DMS微生物周转时间变化范围为0.03~1.80 d,平均值为0.49 d,DMS海-气周转时间是微生物消费时间的90倍,说明夏季挪威海和格陵兰海表层海水中DMS微生物消费过程是比海-气扩散更具优势的去除机制。
二甲基硫;二甲巯基丙酸内盐;浓度分布;生物周转;挪威海和格陵兰海
1 引言
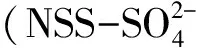
β-二甲基巯基丙酸内盐(DMSP,dimethylsulfoniopropionate)是DMS的主要前体物质[5],海洋中的微型、大型藻类和盐生植物都是DMSP的重要来源[5]。浮游植物中金藻纲、甲藻纲和定鞭金藻纲是DMSP主要生产者,含量约为45~400 mmol/(L·cell);绿胞藻纲、绿藻纲、隐藻纲等是DMSP低产藻种,其含量小于30 mmol/(L·cell)。大藻中以绿藻纲中的石莼、浒苔、松藻、红藻纲中的多管藻中DMSP含量较多,而褐藻DMSP含量则很少[6]。DMSP可作为藻类细胞内的一种渗透压调节剂,外界盐度升高时,藻细胞会合成较多DMSP维持细胞内外的渗透压平衡[7];盐度下降时,藻细胞会将体内多余的DMSP释放到水体中[8]。
海水中DMS主要来源于海洋浮游植物体内的DMSP,但是海洋藻类细胞中的DMSP转化为释放到大气中DMS途径是非常复杂的。其中涉及的相关过程包括:浮游植物生长、细胞分泌渗出、自然衰老、浮游动物摄食、病毒感染、细菌消耗、藻类DMSP裂解酶的活动以及DMSO光化学生产等。海水中总DMSP的含量是非常大的,但是其中只有小部分能够以DMS的形式释放到海水中,而余下的绝大部分会在海洋食物网中重复循环或沉积到深层海水中[9]。生物生产与消耗被认为是海洋中DMS的主要来源和去除途径,主要发生在海洋真光层[10],具有明显的季节和纬度变化[11],涉及海洋微生物食物网,决定表层海水中DMS的浓度以及海-气通量[12]。海洋中相关的物理和化学过程会影响复杂的DMS(P)生产与消费网,潜在导致了DMS在海-气间的动态转换。
北冰洋是全球纬度最高的大洋,也是对全球变化最敏感的地区之一。全球范围内,北冰洋的挪威海和格陵兰海(Norwegian and Greenland Seas)是影响气候变化的关键区之一,表层具有强烈的由西至东水文梯度,东部挪威海流是北大西洋漂流(North Atlantic Dift)一个相对高温(6~10℃)高盐(35)分支,西部东格陵兰岛洋流(East Greenland Current)是由南沿东格陵兰大陆边缘向北的低温(小于0℃)低盐(30~34)极地水,在这两条主要洋流之间通过东冰岛洋流(East Iceland Current)和扬马延岛洋流(Jan Mayen Current)两个漩涡混合形成北极表层水团[13],暖水团和冷水团的紧密并置导致明显的海洋锋面。挪威海和格陵兰海复杂的水文条件会对该海域生源硫的生产分布产生重要影响,进而对北半球乃至全球气候变化产生一定影响。而且,北冰洋DMS的富集和周转会受到极地海冰性质和海—气交换过程共同影响,对于全球生源硫的生物地球化学循环具有不容忽视的作用。目前,关于挪威海和格陵兰海海域海洋DMS和DMSP生物地球化学循环的研究甚少,仅Galí和Simó[14]关注过夏季北极格陵兰海海域二甲基硫化物浓度分布及循环。鉴于此,本文针对夏季挪威海和格陵兰海,着重研究海水中DMS和DMSP的浓度分布、生物周转及其影响因素,估算DMS海-气通量,定量评价海水DMS海气周转和生物周转两种去除途径的相对重要性,对于深入认识北极海域生源硫化物(DMS和DMSP)的生物地球化学循环和气候效应具有重要的科学意义。
2 样品采集与分析
2.1 样品采集
2012年7-9月,中国“雪龙”号科学考察船第5次赴北极进行科学考察,期间对北冰洋—大西洋扇区内挪威海和格陵兰海的公海进行调查取样(见图1),包括BB断面和AT断面17个站位不同深度的样品,用于二甲基硫化物的分析测定。海水样品由12 L Niskin采水器采集后,DMS样品通过一硅胶管直接从Niskin采水器装入润洗过2~3次的5 mL玻璃注射器中。海水样品采集后在现场温度(±1℃)黑暗条件下储存并于1 h内完成测定[15]。对于DMSP样品,现场用一头带有玻璃管的硅胶管将水样从采水器分装至120 mL玻璃瓶。硅胶管要求透明,以便观察管中是否有气泡,玻璃管管口要大小适中,既能顺利地把管中的气泡排掉,又能迅速采水。首先用少量海水冲洗瓶子2遍,然后把玻璃管插到瓶底,将海水迅速注入,但不应使瓶中产生大的涡流。当水装满并且溢出约瓶体积的一半时,慢慢抽出玻璃管,迅速拧紧瓶盖。
采用小体积重力过滤方法(SVDF)测定DMSP样品[16]。约30 mL海水样品在3 min内经重力过滤,收集最初的3.5 mL滤液用于DMSPd分析,滤膜切勿过滤至干。在收集滤液的样品瓶中事先添加一定量50% H2SO4,将酸化样品室温下黑暗放置24 h以上,以至任何内源性DMS通过酸催化氧化被移除。后向酸化样品添加一定量NaOH溶液,放置3~6 h进行碱解后,测定DMS来确定DMSP浓度。重力过滤中,操作需非常仔细,过滤压力要尽可能小,过滤中可能人为导致浮游植物细胞破裂,使细胞内颗粒态DMSP释放至水体,致使本体DMSPd浓度提高。

图1 挪威海和格陵兰海调查站位示意图Fig.1 Locations of sampling stations in the Norwegian and Greenland Seas

图2 挪威海和格陵兰海表层海水各参数水平分布Fig.2 Horizontal distributions of temperature,salinity,DO,Chl a,DMS and DMSP in the surface water of Norwegian and Greenland Seas
2.2 分析方法
DMS样品采用气提-冷阱捕集气相色谱法测定[17—18],即用玻璃注射器取2~5 mL水样注入至干燥玻璃瓶中,通入40 mL/min高纯N2进行吹扫,吹扫出的气体通过Nafion干燥器(Perma Pure,USA)除去水份,并通过六通阀(Valco,USA)富集于浸在液氮中的1/8 Teflon捕集管中,冷凝吹扫2~5 min后将捕集管置于热水(大于70℃)中加热解析,解析出来的DMS样品随载气进入气相色谱仪(GC-14B,Shimadzu,配置火焰光度检测器)进行测定。DMS样品采用外标法定量,即用吹扫除净DMS的空白海水配制一系列已知浓度的DMS标准溶液,根据浓度与峰面积的对应关系绘制标准曲线,计算得出样品DMS浓度。该测定方法的相对标准偏差小于5%,DMS最小检出限为0.2 nmol[16]。
对于DMSP样品的测定,首先在强碱(pH≥13)条件下完全降解为DMS,再通过分析DMS的浓度间接获得DMSP的含量,其中DMSPp浓度由DMSPt浓度减去DMSPd浓度获得。测定时,分别向DMSPd和DMSPt样品中加入200 μL和500 μL的10 mol/L NaOH溶液,然后避光冷藏(4℃)放置24 h以上,保证DMSP能够完全转化为DMS。
海水的温度(T)、盐度(S)、叶绿素(Chla)参数由船载CTD系统现场获得。
3 结果与讨论
3.1 挪威海和格陵兰海表层海水DMS和DMSP的空间分布
3.1.1 挪威海和格陵兰海表层海水DMS和DMSP的水平分布
夏季挪威海和格陵兰海表层海水中DMS浓度变化比较大,范围在0.81~22.38 nmol/L之间,平均值为5.36 nmoL/L,这同2007年夏季格陵兰海域表层海水DMS浓度变化范围基本一致(1.5~18.3 nmol/L),略低于夏季中国东部陆架海表层海水DMS浓度[19—20](北黄海和南黄海东海DMS平均值分别为6.2 nmol/L和5.64 nmol/L)。DMS浓度最高值出现在AT10站位,而且浓度超过10 nmol/L的站位也大都集中在低纬度海域(见图2)。总体上,DMS浓度的分布趋势与Chla大致相似,呈现随纬度增高而降低的趋势,浓度峰值出现在富含营养盐的北大西洋暖流的分支——高温高盐挪威海流[21]流经的AT10站位。营养盐是浮游植物生长的基础物质,水体中营养盐的浓度及结构直接影响着浮游植物的生长[22]。BB断面DMS浓度明显高于AT断面DMS浓度,这可能由于Jan Mayen表层寒流流经BB断面,硅酸盐浓度相对较低[23],本航次浮游植物调查发现硅藻为夏季格陵兰海的优势藻种[24],进而导致该海域生物量偏低。Keller等[5]指出,尽管硅藻通常被认为是DMS的低产藻种,但当其成为优势藻种时,其对DMS总量的影响也是不容忽视的[5],因此BB断面DMS浓度明显偏低。
海水中DMSPd和DMSPp的浓度都明显高于DMS浓度。夏季DMSPd浓度从3.18变化到43.30 nmol/L,平均15.63 nmol/L;DMSPp 浓度范围为23.27~282.39 nmol/L,平均96.73 nmol/L。水平分布上,DMSPd和DMSPp浓度都总体表现出由低纬度向高纬度海域递减的趋势,但二者分布也不完全一致。例如,DMSPp最低值出现在AT02站位,其最大值出现在同一断面最外端的AT10站位;而DMSPd最低值出现在AT02站位,但其最高值却出现在高纬度BB03站位。虽然DMSPd和DMSPp峰值未出现在同一站位,但在Chla浓度较高的BB03站位表层DMSPd和DMSPp浓度皆较高,可该站位的DMS浓度却相对偏低,这主要由于海水中DMS和DMSP生产过程存在差异引起的,DMSP含量与浮游植物的种类和数量有直接关系,而DMS的生产却与整个浮游生物圈内的生物活动过程有关。本研究中,除BB03站位(DMSPt为321.04 nmol/L),DMSPt含量变化范围为26.45~174.34 nmol/L,同Galí和Simó[14]关于DMSPt的研究范围(1.4~163.6 nmol/L))基本一致,明显高于夏季中国东部陆架海表层DMSP浓度[19—20](南黄海东海DMSPd和DMSPp平均值分别为5.23 nmol/L和27.13 nmol/L;北黄海DMSPd和DMSPp平均值分别为10.83 nmol/L和19.5 nmol/L)。
3.1.2 BB断面DMS和DMSP的垂直分布
夏季,北冰洋大西洋扇区BB断面温度、盐度、Chla、DO、DMS、DMSPd和DMSPp浓度的垂直分布如图3所示。由图中温度和盐度分布可以看出,BB01至BB04站位表层水体受控于高温高盐挪威海流。BB断面的上层水体以莫恩海脊为界,西侧格陵兰海盆内海水温度盐度均低于东侧罗弗墩海盆内水体,中层两个海盆内水体均存在一个低盐中心,深层两个海盆之间温盐性质进一步缩小。从二甲基硫化物剖面图分析,二甲基硫化物浓度垂向分布趋势是水体表层浓度高于深层水体,与其他海域的垂向分布趋势一致。在20 m附近二甲基硫化物出现浓度最大值,在100~200 m以下二甲基硫化物浓度明显下降,随后基本保持稳定,变化不是很大。DMS浓度表层变化范围为0.8~3.6 nmol/L,平均值为2.82 nmol/L;底层变化范围为0.2~1.0 nmol/L,平均值为0.597 nmol/L。整个水体看来,BB04站位为DMS浓度高值区。BB04站位DMS浓度垂直分布上75~200 m范围内浓度较高,随后逐渐降低,在近底层2 000 m左右再次出现DMS浓度高值。DMSPd浓度表层变化范围为5.9~38.7 nmol/L,平均值为15.5 nmol/L;底层变化范围为0.4~8.0 nmol/L,平均值为4.90 nmol/L。DMSPp浓度表层变化范围为27.9~282.4 nmol/L,平均值为102.8 nmol/L;底层变化范围为0.12~5.7 nmol/L,平均值为2.9 nmol/L。表层DMSPd和DMSPp的高值区均出现在BB03站位,这与DMSP直接来源于浮游植物,而该层可能聚集较多的浮游生物有直接关系。而且底层DMSPd还在BB03站位出现高值区,说明此站位深水层中DMSP的生产或释放过程仍然存在,可能是包含在颗粒物中的DMSP沉降至深水层中释放造成的,如浮游动物摄食浮游植物的粪便等。
3.1.3 AT断面DMS和DMSP的空间分布
夏季挪威海AT断面温度、盐度、Chla、二甲基硫化物浓度垂直分布如图4所示。由图中温度和盐度分布可以看出,夏季挪威海水体层化现象明显。表层水体中明显受控于高温高盐的挪威海流,自AT10站位沿右侧向北流动扩展,其下部主要为相对低温低盐的北极深层出流水。AT断面上层以Vøring海台为界北部罗弗墩海盆内水体具有相对更大的温度和盐度,中层两个海盆内的低盐核心呈现北深南浅的分布特征,深层则从罗弗墩海盆的北部向南部递减。但该断面大部分站位二甲基硫化物层化现象不明显。DMS浓度表层变化范围为2.5~22.4 nmol/L,平均值为8.23 nmol/L;底层变化范围为0.2~3.6 nmol/L,平均值为1.21 nmol/L。表层DMS高值区出现在AT08至AT10站位,底层DMS高值区则在AT02站位底层。DMSPd浓度表层变化范围为3.2~43.3 nmol/L,平均值为15.7 nmol/L;底层变化范围为0.6~14.9 nmol/L,平均值为2.65 nmol/L。DMSPp浓度表层变化范围为23.3~153.4 nmol/L,平均值为89.9 nmol/L;底层变化范围为0.47~22.2 nmol/L,平均值为8.6 nmol/L。同DMS相似,表层DMSPd和DMSPp浓度同样在AT08至AT10站位范围内呈现高值区,这种分布趋势可能与挪威海和格陵兰海表层洋流所携带的浮游生物(包括浮游植物、浮游动物、细菌以及病毒等)分布趋势密切相关。

图3Fig.3

图3 挪威海和格陵兰海BB断面各参数空间分布Fig.3 Spatial distributions of temperature,salinity,DO,Chl a,DMS and DMSP at BB transect in the Norwegian and Greenland Seas
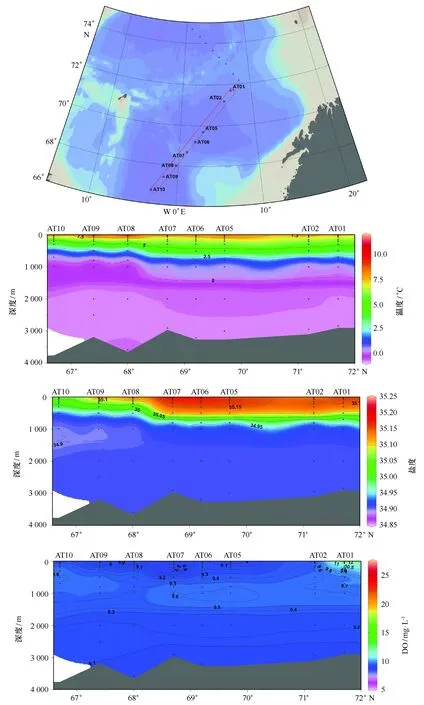
图4Fig.4
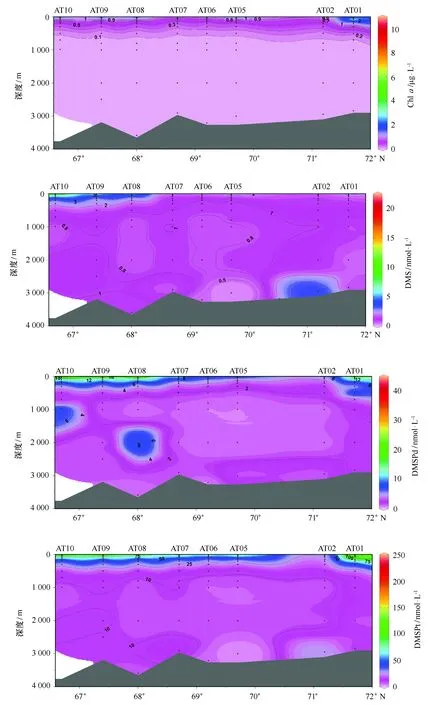
图4 挪威海和格陵兰海AT断面各参数空间分布Fig.4 Spatial distributions of temperature,salinity,DO,Chl a,DMS and DMSP at AT transect in the Norwegian and Greenland Seas
3.2 表层海水DMS的生物周转速率
2012年夏季挪威海和格陵兰海表层海水DMS 生物周转速率现场调查情况如图5所示,DMS生物生产速率的变化范围为11.19~35.7 nmol/(L·d),平均值为18.19 nmol/(L·d);DMS生物消费速率的变化范围为8.72~34.2 nmol/(L·d),平均值为15.7 nmol/(L·d)。从空间分布看来,DMS生物生产和消费速率的高值区同时出现在BB02站位,而DMS生物生产和消费速率低值区则同时出现在BB01和BB08站位。夏季,光照充足,海水温度适宜,浮游植物生长旺盛,本航次挪威海和格陵兰海浮游植物群落结构研究表明,微微型浮游植物的优势藻种为定鞭金藻、硅藻和青绿藻(对Chla贡献率分别为49%、18%和12%),微型浮游植物的优势藻种为定鞭金藻和硅藻(对Chla贡献率分别为73%和12%),小型浮游植物的优势藻种为硅藻和甲藻(对Chla贡献率分别为63%和17%)。总体看来,夏季挪威海和格陵兰海浮游植物的定鞭金藻、硅藻和甲藻[24]。定鞭金藻和甲藻为DMSP的高产藻种,而硅藻虽然是DMSP的低产种,但当它成为海域中的优势藻种时,所产生的DMSP总量可能会超越非优势种的其他DMSP高产种的贡献,从而成为海水中DMSP的重要来源[5],这些优势细胞能够合成更多的DMSP进而生产更多的DMS释放到海水中。而且此时微生物活动也相对频繁,酶的活性也较高,对浮游植物生产DMS/DMSP的过程也有很大的帮助,因此物理条件可能是造成夏季挪威海和格陵兰海表层海水DMS生物生产速率和消费速率空间差异的重要因素。BB08站位出现了明显的温度低值,而浮游植物及细菌体内的酶系都有其合适的催化温度,低温可能使得藻类和细菌的生理状态的DMSP裂解酶活性发生变化,从而引起DMS生物生产速率偏低。另一方面,细菌是海水DMS生物消费的重要参与者,温度能够影响细菌酶活性,直接影响细菌的新陈代谢能力,间接影响细菌生产力,进而可能造成BB08站位的生物消费速率明显偏低。DMSP((CH3)2S+CH2CH2COO-)是一种叔代硫化合物,结构上类似季铵化合物,因此被认为具有类似“相容性”溶液的功能,在高盐情况下,更容易取代含氮的渗透压调节剂(如甜菜碱、甘氨酸等),DMSP在藻细胞体内起到调节渗透压作用,BB02站位表层海水盐度较高,藻体细胞能够合成更多的DMSP来维持体内渗透压[25],进而海水中DMSPd浓度也较高,而DMSPd是海水中DMS的最直接来源,因此BB02站位表层海水的DMS生物生产速率明显偏高。空间变化特征显示,夏季海水表层DMS生物生产与消费速率的地区相似性,二者之间可能存在着紧密的联系。数据线性相关分析表明DMS生物生产速率与消费速率之间存在显著相关性(R=0.989 2,n=9,p<0.000 1,见图6)。这表明DMS生物生产与其微生物消费构成一个紧密的生物循环过程。这样,如果有更多的DMS产生,就同样可能有更多的DMS被微生物所降解消耗,从而维持海水表层DMS浓度在一个较小的范围内变化。

图5 挪威海和格陵兰海表层海水DMS生物生产和消费速率的水平变化图Fig.5 Horizontal variation of DMS biological production and consumption rates in the surface waters of Norwegian and Greenland Seas
根据夏季挪威海和格陵兰海的调查数据,DMS生物生产速率皆高于其消费速率,高出范围为4.4%~34.2%,平均高出19.9%。在东北太平洋[26]、北大西洋亚极地海域[27]、北太平洋西部[28]、日本Funka湾及其邻近海域[29]和南海[30]也同样发现表层海水DMS生物生产速率高于其消费速率,但二者之间的比值具有地区差异,这可能是由于不同海区浮游植物种群分布和活性的不同。海水表层中,DMS生物生产速率高于消费速率从而导致DMS的净生产,因此DMS净生物生产可能被其他DMS去除途径平衡(如光化学降解和海 ̄—气扩散)。

图6 夏季挪威海和格陵兰海表层海水DMS生物生产速率与消费速率的相关性Fig.6 Relationships between DMS biological production and consumption rates in the surface water of Norwegian and Greenland Seas during summer
3.3 二甲基硫化物分布及生物周转的影响因素
3.3.1 DMS、DMSP和Chla的相互关系
海水中DMS/DMSP主要来源于浮游植物的自身合成,而Chla常被用来作为浮游生物量的指标,因此两者之间的相互关系一直是关注的热点问题。为进一步探寻浮游植物生物量对DMS/DMSP水平分布及DMS生物周转的影响,对表层水体和整个水体DMS/DMSP浓度及DMS生物生产速率和Chla浓度进行线性回归分析,结果表明,表层水体Chla浓度与DMSPd和DMSPp浓度之间具有良好的相关性(见图7,DMSPd,R=0.830 1,n=18,p<0.000 1;DMSPp,R=0.610 1,n=18,p=0.007 2),然而却没有发现DMS、DMS生物生产速率与Chla之间的相关性存在。对于整个水体分析,研究结果相同,水体Chla浓度与DMSPd和DMSPp浓度之间具有良好的相关性(见图7,DMSPd,R=0.691 3,n=219,p<0.000 1;DMSPp,R=0.668 2,n=219,p<0.000 1),同样没有发现DMS与Chla之间的相关性存在。DMSPp直接来源于浮游植物,而且海水中大量的DMSPp存在于浮游植物细胞内,这样DMSPp浓度与Chla相关性较好。海水中,正常的藻类细胞会通过细胞衰败、破裂以及被浮游动物摄食等过程释放产生DMSPd,因而DMSPd浓度与Chla存在密切联系。DMS可从藻体内直接释放,但释放量与海藻的生长阶段、生理阶段有关,而DMSP转化成DMS的途径涉及浮游植物生长、细胞分泌渗出、浮游动物摄食、病毒感染、细菌消耗、藻类DMSP裂解酶活动以及DMSO光化学生产等复杂过程,由此导致DMS浓度与Chla时空分布的不一致性。
不同浮游植物合成Chla的能力不同,而且生产DMS/DMSP的能力也存在很大差异。DMS/DMSP与Chla浓度比值常被用来估算不同海区浮游植物现存量生产DMS/DMSP的能力或反映浮游植物组成中DMSP生产者所占比例的高低[31]。夏季,挪威海和格陵兰海表层海水DMS/Chla和DMSPp/Chla比值变化范围分别在0.74~14.26 mmol/g和22.85~157.80 mmol/g之间,平均值分别为5.28和87.50 mmol/g,其中BB断面DMS/Chla和DMSPp/Chla比值平均值均明显低于AT断面相应的比值(见图8)。这反映出各断面或同一断面不同站位间浮游植物组成或生物量有所差异,而这种差异可能是由于营养盐浓度水平及比例的不同造成的[32],硅藻为夏季格陵兰海的优势藻种[24]。通常高DMS/Chla和DMSPp/Chla比值出现在甲藻或金藻占优势地位的海域,而低DMS/Chla和DMSPp/Chla比值出现在硅藻为优势种的海区[33]。而且,浮游植物的组成也会受到海水温度和盐度的明显影响。自BB断面向AT断面,海水表层水温明显增加,同时海水表层盐度也显著增高,这样优势硅藻的种类和数量逐渐减少,更有利于暖水性、耐高盐的浮游植物(甲藻)的生长,进而导致DMS/Chla和DMSPp/Chla比值的升高[34]。
3.3.2 DMS、DMSP和环境因子的关系
根据本航次调查结果,对夏季挪威海和格陵兰海整个水体DMS浓度与DMSP浓度进行线性拟合,发现DMS与DMSPd、DMSPp之间均存在较好相关性(见表1),这表明调查海域水体中DMSPd和DMSPp对海洋中DMS生产皆具有明显贡献。但同时DMS生产还受到诸多因素的影响,将二甲基硫化物浓度、DMS生物生产与消费速率同温度盐度进行线性拟合,发现温度与DMS、DMSP浓度存在较好的正相关关系,盐度只与DMSP浓度呈现正相关关系,但DMS生物生产与消费速率同温度、盐度之间未发现明显相关性,表明海水温度和盐度对于DMS生物生产和消费速率的影响甚微。夏季,整个调查水域水体中叶绿素同现场温度呈现良好的正相关性(R=0.490 7,n=219,p<0.000 1),表明浮游植物生物量随温度的升高而明显升高,进而提升海水二甲基硫化物浓度。此外,DMSP在藻细胞体内起到调节渗透压作用[25],海水盐度升高会导致藻体细胞合成更多的DMSP来维持体内渗透压,进而生产释放到海水中较高的DMSP含量。
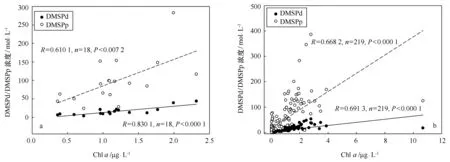
图7 夏季挪威海和格陵兰海表层海水(a)和整个水体(b)DMS、DMSPp和Chl a之间的相关性Fig.7 Correlations between DMS,DMSPp and Chl a concentrations in the surface water and the whole water of Norwegian and Greenland Seas during summer
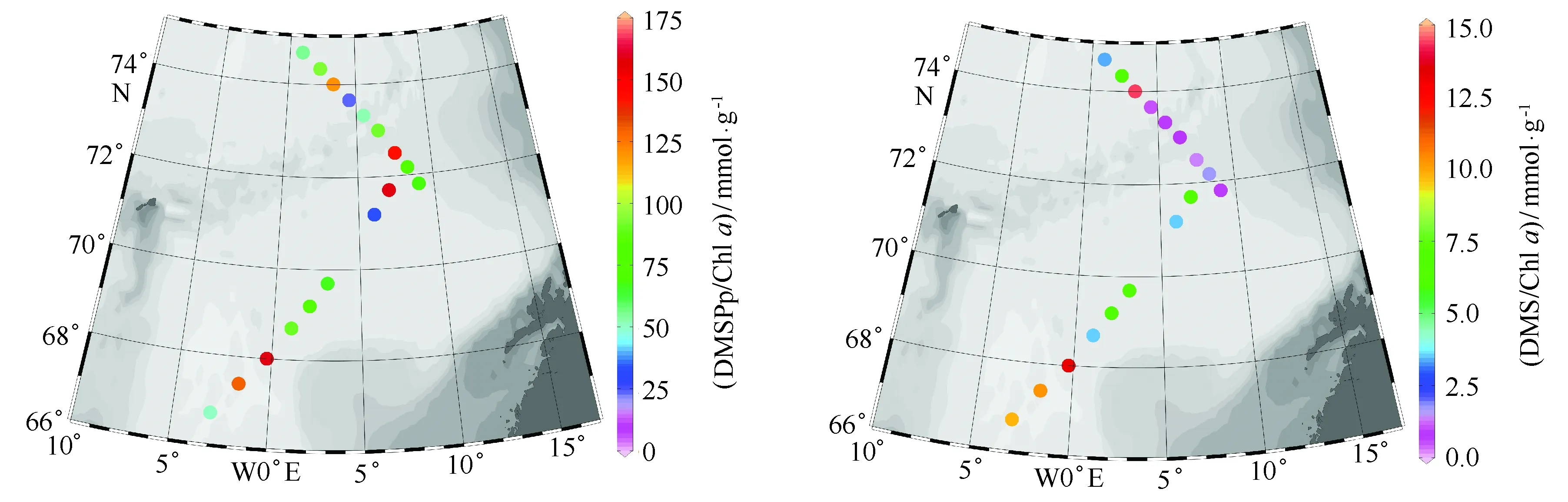
图8 挪威海和格陵兰海表层海水DMSPp/Chl a和DMS/Chl a水平变化Fig.8 Horizontal variation of DMS/Chl a and DMSPp/Chl a in the surface waters of Norwegian and Greenland Seas

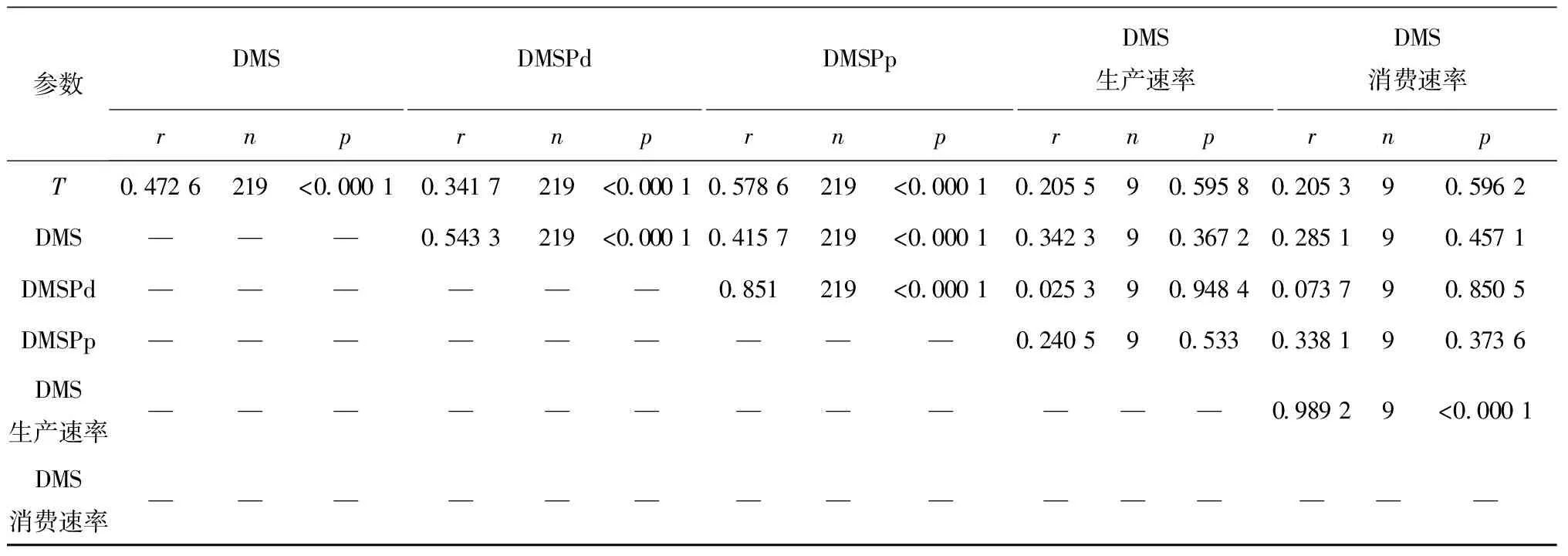
续表1
3.4 表层海水DMS的去除途径
从全球硫循环的角度来看,准确测定表层海水DMS浓度分布的重要目的之一即用于计算DMS的海-气交换通量以及评价其在全球硫循环中的重要作用。DMS的海-气通量F通常用下式计算[35]:
(1)
式中,K是海-气传输速率;Cw和Cg分别为DMS在水体和大气中的浓度;H是亨利常数;由于Cg/H远远小于Cw,可忽略。本研究中,依据现场风速和海水温度,利用LM86公式[35]、W92公式[36]和N2000公式[37]分别计算DMS的传输速率(表2)。DMS海-气通量,由公式LM86计算所得平均值为2.75 μmol/(d·m2),而由公式W92计算所得平均值为5.23 μmol/(d·m2),后者是前者的近2倍,这主要是由于计算中海-气传输速率的不确定性导致的。最近研究表明[38],公式LM86估算出最低值,公式W92估算出最高值,最可信的海气交换速率会介于二者之间,即平均DMS海-气通量介于2.75~5.23 μmol/(d·m2)之间,近似为公式N2000的计算结果3.28 μmol/(d·m2)。

表2 挪威海和格陵兰海表层DMS海-气通量和周转时间
表层海水中DMS的去除主要通过微生物消耗、光化学氧化和海-气扩散这些途径实现。由于受到各种影响因素(包括细菌活性、风速、太阳辐射强度等)的综合干扰,这三者在海水DMS去除过程中的相对重要性具有地域和季节上的可变性[39]。其中微生物消耗在表层海水DMS去除机制中的重要作用在多项研究中被高度强调,指出海水中平均有50%~80%的DMS生产通过微生物消耗途径进行去除,在某些情况下是比其他两种途径更具优势的去除途径[39]。而其他研究表明,光化学氧化和海-气扩散在DMS去除过程中也具有相当重要的作用[40—41]。由于航次时间的限制,我们未能现场研究DMS的光化学氧化速率,因此无法获得DMS光氧化周转时间τphoto。定量分析各种DMS去除途径的周转时间进行,有助于进一步探讨和评价特定海域和时期内海水中DMS的源与汇。
根据海水中DMS浓度及其微生物消耗速率,计算出了表层中DMS微生物消耗的生物周转时间τbio(DMS在表层海水中的浓度/DMS的微生物消费速率)。夏季,挪威海和格陵兰海表层中DMS微生物消耗的生物周转时间的变化范围为0.03~1.80 d,平均值为(0.49±1.24) d(表3)。海水表层中DMS海-气周转时间τsea-air根据DMS浓度、DMS海-气交换通量和取样水层的厚度进行计算(DMS在表层海水中的浓度×取样层深度/DMS海-气通量值)。夏季,挪威海和格陵兰海表层DMS海-气周转时间τsea-air分别在4.14~185.22 d之间,平均值分别为(28.8±0.49)d(表2)。表层海水DMS海-气周转时间与其微生物消耗周转时间的比值(τsea-air/τbio)范围为2.54~253.60。平均看来,DMS海-气周转时间是微生物消费时间的90.35倍,夏季挪威海和格陵兰海表层中DMS微生物消费过程都是比海-气扩散更具有优势的去除机制。

表3 挪威海和格陵兰海表层DMS生物周转时间
4 结论
(1) 夏季挪威海和格陵兰海表层水体二甲基硫化物总体表现出由低纬度向高纬度海域递减的趋势,主要受高温高盐的挪威海流和低温低盐的北极深层水影响。
(2) 夏季挪威海和格陵兰海表层水体DMS生物生产和消费速率空间分布格局呈现一定相似性,高值区位于挪威海莫恩海脊附近,低值区则位于近格陵兰海盆区域。DMS生物生产速率与消费速率之间存在显著相关性,表明DMS生物生产与其微生物消费构成一个紧密的生物循环过程。
(3)挪威海和格陵兰海水体二甲基硫化物受现场海洋物理、化学和生物条件(如温度、盐度、Chla以及浮游植物组成等)不同程度影响。Chla浓度影响最为显著,海水温度和盐度次之,浮游植物组成对于海水二甲基硫化物的生产具有重要影响。
(4)夏季挪威海和格陵兰海表层中DMS微生物消费过程都是比海-气扩散更具有优势的去除机制。
[1] Stefels J,Steinke M,Turner S,et al. Environmental constraints on the production and removal of the climatically active gas dimethylsulphide (DMS) and implications for ecosystem modelling[J]. Biogeochemistry,2007,83(1/3): 245-275.
[2] Andreae M O. Ocean-atmosphere interactions in the global biogeochemical sulfur cycle[J]. Marine Chemistry,1990,30: 1-29.
[3] Charlson R J,Lovelock J E,Andreae M O,et al. Oceanic phytoplankton,atmospheric sulphur,cloud albedo and climate[J]. Nature,1987,326(6114): 655-661.
[4] Nguyen B C,Mihalopoulos N,Putaud J P,et al. Covariations in oceanic dimethyl sulfide,its oxidation products and rain acidity at Amsterdam Island in the southern Indian Ocean[J]. Journal of Atmospheric Chemistry,1992,15(1): 39-53.
[5] Keller M D,Bellows W K,Guillard R R L. Dimethyl sulfide production in marine phytoplankton[C]// Saltzman E S,Cooper W J. Biogenic Sulfur in the Environment. Washington DC: American Chemical Society,1989: 167-182.
[6] 李和阳,王大志,林益明,等. 海洋二甲基硫的研究进展[J]. 厦门大学学报(自然科学版),2001,40(3): 715-725.
Li Heyang,Wang Dazhi,Lin Yiming,et al. Progress in study of marine dimethylsulfide [J]. Journal of Xiamen University (Natural Science),2001,40(3): 715-725.
[7] 杨桂朋,景伟文,陆小兰. 海洋中DMSP的研究进展[J]. 中国海洋大学学报,2004,34(5): 854-860.
Yang Guipeng,Jing Weiwen,Lu Xiaolan. Recent Progress in the study of oceanic dimethylsulfoniopropionate[J]. Periodical of Ocean University of China (Natural Science),2004,34(5): 854-860.
[8] Stefels J,Van Leeuwe M. Effects of iron and light stress on the biochemical composition of AnarcticaPhaeocystissp. (Prymnesiophyceae):Ⅰ. intracellular DMSP concentrations[J]. Journal of Phycology,1998,34(3): 486-495.
[9] Kiene R P,Linn L J,Bruton J A. New and important roles for DMSP in marine microbial communities[J]. Journal of Sea Research,2000,43(3/4): 209-224.
[10] Burgermeister S,Zimmermann R L,Georgii H W,et al. On the biogenic origin of dimethylsulfide: relation between chlorophyll,ATP,organismic DMSP,phytoplankton species,and DMS distribution in Atlantic surface water and atmosphere[J]. Journal of Geophysical Research,1990,95(D12): 20607-20615.
[11] Kettle A J,Andreae M O,Amouroux D,et al. A global database of sea surface dimethylsulfide (DMS) measurements and a procedure to predict sea surface DMS as a function of latitude,longitude and month[J]. Global Biogeochemical Cycles,1999,13(2): 399-444.
[12] Malin G,Kirst G O. Algal production of dimethyl sulfide and its atmospheric role[J]. Journal of Phycology,1997,33(6): 889-896.
[13] Swift J H. The Arctic Waters[C]// Hurdle B C. The Nordic Seas. New York: Springer-Verlag,1986: 129-153.
[14] Galí M,Simó R. Occurrence and cycling of dimethylated sulfur compounds in the Arctic during summer receding of the ice edge[J]. Marine Chemistry,2010,122(1/4): 105-117.
[15] Wolfe G V,Kiene R P. Radioisotope and chemical inhibitor measurements of dimethyl sulfide consumption rates and kinetics in estuarine waters[J]. Marine Ecology Progress Series,1993,99: 261-269.
[16] Kiene R P,Slezak D. Low dissolved DMSP concentrations in seawater revealed by small volume gravity filtration and dialysis sampling[J]. Limnology and Oceanography: Methods,2006,4(4): 80-95.
[17] 杨桂朋,康志强,景伟文,等. 海水中痕量DMS和DMSP分析方法的研究[J]. 海洋与湖沼,2007,38(4): 322-328.
Yang Guipeng,Kang Zhiqiang,Jing Weiwen,et al. An analytical method of determining trace quantities of dimethylsulfide and dimethylfulfoniopropionate in seawater[J]. Oceanologia et Limnologia Sinica,2007,38(4): 322-328.
[18] Kiene R P,Service S K. The influence of glycine betaine on dimethylsulfide and dimethylsulfoniopropionate concentrations in seawater[C]// Oremland R S. The Biogeochemistry of Global Change: Radiatively Important Trace Gases. New York: Chapman and Hall,1993: 654-671.
[19] Yang Guipeng,Zhang Honghai,Su Luping,et al. Biogenic emission of dimethylsulfide (DMS) from the North Yellow Sea,China and its contribution to sulfate in aerosol during summer[J]. Atmospheric Environment,2009,43(13): 2196-2203.
[20] Zhang Shenghui,Yang Guipeng,Zhang Honghai,et al. Spatial variation of biogenic sulfur in the south Yellow Sea and the East China Sea during summer and its contribution to atmospheric sulfate aerosol[J]. Science of the Total Environment,2014,488-489: 157-167.
[21] Pelegrí J L,Marrero-Díaz A,Ratsimandresy A W. Nutrient irrigation of the North Atlantic[J]. Progress in Oceanography,2006,70(2/4): 366-406.
[22] Varela1 D E,Crawford D W,Wrohan I A,et al. Pelagic primary productivity and upper ocean nutrient dynamics across Subarctic and Arctic Seas[J]. Journal of Geophysical Research: Oceans,2013,118(12): 7132-7152.
[23] 马德毅. 中国第五次北极科学考察报告[M]. 北京: 海洋出版社,2013.
Ma Deyi. The Report of 2012 Chinese Arctic Research Expedition[M]. Beijing: China Ocean Press,2013.
[24] 王肖颖,张芳,李娟英,等. 2012年夏季挪威海和格陵兰海浮游植物群落结构的色素表征[J]. 生态学报,2014,34(8): 2076-2084.
Wang Xiaoying,Zhang Fang,Li Juanying,et al. Phytoplankton community structures revealed by pigment signatures in Norwegian and Greenland Seas in summer 2012[J]. Acta Ecologica Sinica,2014,34(8): 2076-2084.
[25] Cerqueira M A,Pio C A. Production and release of dimethylsulphide from an estuary in Portugal[J]. Atmospheric Environment,1999,33(20): 3355-3366.
[26] Bates T S,Kiene R P,Wolfe G V,et al. The cycling of sulfur in surface seawater of the Northeast Pacific[J]. Journal of Geophysical Research-Oceans,1994,99(C4): 7835-7843.
[27] Simó R,Grimalt J O,Albaigés J. Sequential method for the field determination of nanomolar concentrations of dimethyl sulfoxide in natural waters[J]. Analytical Chemistry,1996,68(9): 1493-1496.
[28] Yang Guipeng,Tsunogai S,Watanabe S. Biogenic sulfur distribution and cycling in the surface microlayer and subsurface water of Funka Bay and its adjacent area[J]. Continental Shelf Research,2005,25(4): 557-570.
[29] Yang Guipeng,Tsunogai S,Watanabe S. Biogeochemistry of dimethylsulfoniopropionate (DMSP) in the surface microlayer and subsurface seawater of Funka Bay,Japan[J]. Journal of Oceanography,2005,61(1): 69-78.
[30] 康志强. 黄海、南海DMS生物生产与消费速率的研究[D]. 青岛: 中国海洋大学,2006.
Kang Zhiqiang. Studies on Biological Production and Consumption rates of DMS in the Yellow Sea and South China Sea[D]. Qingdao: Ocean University of China,2006.
[31] Turner S M,Nightingale P D,Broadgate W,et al. The distribution of dimethyl sulphide and dimethylsulphoniopropionate in Antarctic waters and sea ice[J]. Deep-Sea Research Part Ⅱ,1995,42(4/5): 1059-1080.
[32] Iverson R L,Neaehoof F L,Andreae M O. Production of dimethylsulfonium propionate and dimethylsulphide by phytoplankton in estuarine and coastal waters[J]. Limnology and Oceanography,1989,34(1): 53-67.
[33] Ditullio G R,Smith W O. Relationship between dimethylsulfide and phytoplankton pigment concentrations in the Ross Sea,Antarctica[J]. Deep-Sea Research Part I,1995,42(6): 873-892.
[34] Simó R,Archer S D,Pedrós-Alió C,et al. Coupled dynamics of dimethylsulfoniopropionate and dimethylsulfide cycling and the microbial food web in surface waters of the North Atlantic[J]. Limnology and Oceanography,2002,47(1): 53-61.
[35] Liss P S,Merlivat L. Air-sea gas exchange rates: introduction and synthesis[C]//Buat-Ménard P. The Role of Air-Sea Exchange in Geochemical Cycling. Reidel,Dordrecht: Academic Press,1986: 113-127.
[36] Wanninkhof R. Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysical Research,1992,97(C5): 7373-7382.
[37] Nightingale P D,Malin G,Law C S,et al. In situ evaluation of air-sea gas exchange parameterizations using novel conservative and volatile tracers[J]. Global Biogeochemical Cycles,2000,14(1): 373-387.
[38] Huebert B J,Blomquist B W,Hare J E,et al. Measurement of the sea-air DMS flux and transfer velocity using eddy correlation[J]. Geophysical Research Letters,2004,31: L23113.
[39] Simó R. From cells to globe: approaching the dynamics of DMS(P) in the ocean at multiple scales[J]. Canadian Journal of Fisheries and Aquatic Sciences,2004,61(5): 673-684.
[40] Toole D A,Slezak D,Kiene R P,et al. Effects of solar radiation on dimethylsulfide cycling in the western Atlantic Ocean[J]. Deep-Sea Research Part Ⅰ,2006,53(1): 136-153.
[41] Erickson D J,Ghan S J,Penner J E. Global ocean-to-atmosphere dimethyl sulfide flux[J]. Journal of Geophysical Research,1990,95(D6): 7543-7552.
Spatial distributions of Dimethylsulfide (DMS) and influencing factors in the Norwegian and Greenland Seas during summer
Li Chengxuan1,Wang Baodong1,Yang Guipeng2
(1.ResearchCenterforMarineEcology,TheFirstInstituteofOceanography,StateOceanicAdministration,Qingdao266061,China; 2.CollegeofChemistryandChemicalEngineering,OceanUniversityofChina,Qingdao266100,China)
The dimethylsulfide (DMS),dissolved and particulate dimethylsulfoniopropionate (DMSPd and DMSPp) concentrations were determined in the Norwegian and Greenland Seas during summer of 2012. Surface DMS,DMSPd and DMSPp concentrations in the study area increased significantly from high latitudes to low latitudes,with the average values of 5.36,15.63 and 96.73 nmol/L,respectively. Moreover,the biological production and consumption rates of DMS were estimated during the cruise,with the average values of 18.19 and 15.67 nmol/(L·d),respectively. Our results showed that the spatial variation of chlorophyllawas consistent with that of DMSPd and DMSPp concentrations,suggesting that phytoplankton biomass might play an important role in controlling the distribution of DMSP in the study area. In the surface water,the biological turnover time of DMS varied from 0.03 to 1.8 days,with an average of 0.49 days,which was about 90-fold faster than the mean DMS sea-air turnover time (28.8 days). Thus,the main sink of DMS in the surface water appears to be microbial consumption.
dimethylsulfide; dimethylsulfoniopropionate; distribution; biological turnover; Norwegian and Greenland Seas
10.3969/j.issn.0253-4193.2015.08.002
2014-07-16;
2015-05-12。
国家自然科学基金(41106071, 41320104008);国家海洋局青年海洋科学基金(2012503);国家海洋局第一海洋研究所基本科研业务费专项基金(GY02-2011T01);2013年留学人员科技活动择优自助项目(02648)。
厉丞烜(1982—),女,山东省青岛市人,博士,助理研究员,主要从事海洋生物地球化学研究。E-mail:cxli@fio.org.cn
*通信作者:杨桂朋,教授,博导,从事海洋化学研究与教学。E-mail:gpyang@ouc.edu.cn
P734.2
A
0253-4193(2015)08-0009-17
厉丞烜,王保栋,杨桂朋. 挪威海和格陵兰海海水DMS分布特征及影响因素研究[J].海洋学报,2015,37(8):9—25,
Li Chengxuan,Wang Baodong,Yang Guipeng. Spatial distributions of Dimethylsulfide (DMS) and influencing factors in the Norwegian and Greenland Seas during summer[J]. Haiyang Xuebao,2015,37(8):9—25,doi:10.3969/j.issn.0253-4193.2015.08.002
