高产安丝菌素的珍贵束丝放线菌菌种选育
2015-03-20张金龙李芳
张金龙,李芳
(天津永安职业健康检测评价有限公司,天津,300457)
高产安丝菌素的珍贵束丝放线菌菌种选育
张金龙,李芳
(天津永安职业健康检测评价有限公司,天津,300457)
以珍贵束丝放线菌FRCS-025为出发菌株,采用常压室温等离子体(ARTP)诱变技术对其孢子进行处理,筛选得到了一株安丝菌素AP-3高产菌株ARTP-054,其产量可达235.16 mg/L,较原始菌株FRCS-025的产量164.12mg/L,提高了43.3%。以筛选出的ARTP-054高产菌为出发菌株,进行化学诱变,选取浓度为0.4 g/L的亚硝基胍对其孢子悬液进行处理,且使用安丝菌素AP-3支链前体异丁醇进行底物限制性筛选,结合发酵复筛,最终筛得一株安丝菌素AP-3高产菌株HF-064,产量达287.64mg/L,较原始菌株产量提高了75.3%。经50 L发酵罐验证试验,发现诱变后菌株遗传稳定性良好,168 h产量高达292.36mg/L。
安丝菌素;等离子体诱变;化学诱变;亚硝基胍
安丝菌素属于聚酮类抗生素,是一类以珍贵束丝放线菌为生产菌,通过微生物发酵获得的美登醇类衍生物,与美登醇相似,具有抗肿瘤活性。安丝菌素主要由AP-1,AP-2,AP-3,AP-3'和AP-4共五个组分组成,研究表明AP-3的药理活性最强[1-2]。
常压室温等离子体(ARTP)技术,近些年来在微生物诱变育种领域越来越受关注。该技术本身的温度低,活性粒子浓度高,且种类多样,设备简单,易操作,成本低廉,更重要的是处理微生物菌种时,作用效果明显,微生物基因组的突变速度快,产生突变的多样性大[3]。
化学诱变是利用化学试剂来处理微生物细胞群,使染色体断裂、基因重组或碱基置换,从而使后代发生变异。化学诱变操作简单,不易发生回复突变,是生产实践或科研常用的筛菌技术[4]。
安丝菌素独特的抗癌特性,使其具备较高的社会和经济效益,国内各大医药及科研机构都在竞先抢占市场。目前关于安丝菌素的研究报道比较多,包括培养基优化、发酵连续培养、补料培养等[5-6]。本研究以珍贵束丝放线菌FRCS-25为出发菌株,将常压室温等离子体诱变和化学试剂亚硝基胍应用于安丝菌素菌株的选育中,从而获得高产菌株,并进行了50 L发酵实验验证。
1 材料和方法
1.1 菌株
珍贵束丝放线菌FRCS-25,由天津永安职业健康检测评价有限公司保存。
1.2 培养基
斜面及平板培养基(g/L):琼脂20,酵母浸提物10,牛肉浸膏10,葡萄糖5,甘油10,氯化钠3,pH 7.4,121℃灭菌20 min。
种子培养基(g/L):酵母浸提物10,葡萄糖5,甘油10,pH 7.4,121℃灭菌20 min。
发酵培养基(g/L):酵母浸提物10,牛肉浸膏10,葡萄糖10,甘油15,MgSO4·7H2O 0.5,FeSO4· 7H2O 0.01,pH 7.4,121℃灭菌20 min。
1.3 主要试剂
实验所用异丁醇购自国药(上海)有限公司。
1.4 分析方法
1.4.1 高效液相色谱法检测安丝菌素(AP-3)含量[7]
HPLC条件如下,HPLC(岛津LC-20AD);检测器:紫外检测器;检测波长:252 nm;色谱柱SinoChrom ODS-BP(250 mm×4.6 mm,5μm);柱温:40℃;V(流动相乙腈)∶V(水)=60∶40;流速:0.8 mL/min;进样量:40μL。
1.4.2 pH检测
使用梅特勒pH计进行检测。
1.5 菌株等离子体诱变处理
1.5.1 诱变处理流程
原始菌株孢子悬液制备→诱变(ARTP)→观察菌落形态进行初筛→复筛(根据发酵AP-3产量)→斜面保藏,稳定性考察→ARTP诱变高产菌株孢子悬液制备→异丁醇底物耐受菌株初筛→发酵复筛→斜面保藏,稳定性考察。
1.5.2 出发菌株的ARTP诱变
1)单孢子悬液的制备:用接种铲从菌种斜面表面刮取适量菌种,然后再用带有纱布和棉花的无菌漏斗过滤,从而获得单孢子悬浮液,使用无菌盐水将孢子数量调整至107~108个/mL。
2)ARTP诱变致死率曲线的制作:采用清华大学研制的常压室温等离子体诱变系统(型号:ARTP-IIS),对原始菌株FRCS-25的孢子进行处理。具体操作如下:
首先在圆形铁片(直径10 mm)上,加10μL上述单孢子悬液,然后将其置于以氦气作为工作气体的诱变系统中。电源功率:110W;工作气流量:10 L/min;处理距离:2mm;处理时间:0、30、45、60、75、90、105、120、150、180 s。
将上述10个照射时间的孢子悬液使用0.85%的无菌生理盐水进行梯度稀释,然后取各照射时间的10-2、10-3、10-4三个稀释度的孢子悬液0.1mL涂平板,最后将平板置于培养箱中,28℃倒置培养5~7 d。与0 s处理的孢子悬液涂布的平板做对比,以ARTP处理时间为横坐标,制作致死率曲线。
3)菌株ARTP诱变初筛:选择致死率大于95%的照射时间,对原始菌株FRCS-25的孢子悬浮液进行处理,然后进行梯度稀释,取10-2、10-3、10-4三个梯度的孢子悬液进行涂布。在培养箱28℃培养5~7 d,挑选具有特殊形态的单菌落,转接斜面保藏,用于复筛。
4)菌株的复筛:取斜面菌株,加入10 mL 0.85%的无菌生理盐水,将孢子洗下;然后取3 mL孢子液于种子培养基中,28℃、220 r/min培养48~54 h;最后取5mL种子液于发酵培养基,28℃、220 r/min发酵7 d。结束后,取新鲜的安丝菌素发酵液,加入等体积丙酮,振荡浸提2 h,12 000 r/ min离心10 min,上清液过0.45μm针孔过滤器,用HPLC测定安丝菌素AP-3的含量。将获得的高产菌株进行斜面保藏。
5)高产菌株的遗传稳定性实验:将筛选得到的高产菌株连续转接6代,每代均进行发酵,检测安丝菌素AP-3的产量,进行分析比较,从而检验菌株的遗传性状是否稳定。
1.6 菌株化学诱变处理
对ARTP诱变获得的高产菌株再进行化学诱变处理,从而达到使用复合诱变手段获得高产安丝菌素AP-3的菌株。
1.6.1 化学诱变致死率曲线绘制
1)按照1.5.2制作孢子悬液,然后取20mL分装于小口试管瓶中;2)配制亚硝基胍母液:按照W(亚硝基胍)∶V(丙酮)=10∶1配制;3)在小口试管中加入不同体积的亚硝基胍母液,使最终亚硝基胍浓度在0.1、0.2、0.3、0.4、0.5 g/L;4)将上述小口试管置于摇床振荡40 min,摇床温度30℃,转速200 r/min;5)结束后12 000 r/min离心10min获得孢子,然后使用无菌生理盐水配制成105~106个/ mL的孢子悬液,取0.1mL进行涂布。在培养箱28℃倒置培养5~7 d,以未经亚硝基胍处理的孢子悬浮液涂布的平板作对比绘制致死率曲线。
1.6.2 异丁醇耐受强菌株的筛选
异丁醇是合成安丝菌素AP-3侧链的前体[8-9],本实验在平板培养基上添加不同浓度的异丁醇(30、40、50、60、70、80 mmol/L)进行复合诱变高产安丝菌素AP-3菌株初筛。
1.6.3 化学诱变和复筛
选择致死率大于95%照射时间,对高产菌株孢子悬浮液进行处理,取10-2、10-3、10-4三个梯度的孢子悬液进行涂布。在培养箱28℃培养10~14 d,挑选单菌落,转接斜面保藏,用于复筛。
对初筛菌株斜面按照1.5.2部分4)中的方法进行菌株的复筛,并对筛选得到的高产菌株按照1.5.2部分5)中的方法检验其遗传稳定性。
1.7 50 L发酵罐验证试验
一级种子培养是在摇床进行:取斜面菌株,加入10mL 0.85%的无菌生理盐水,将孢子洗下,然后取3 mL孢子液于种子培养基中,28℃、220 r/ min培养48~54 h,镜检无染菌则转接二级。二级种子培养在5 L发酵罐中进行,接种量10%,温度28℃,通风比1∶1,溶氧与搅拌联动保持DO≥30%,培养30~36 h,镜检无染菌则转接50 L发酵罐发酵。50 L发酵罐装液量30 L,接种量10%,通风比1∶1,溶氧与搅拌联动保持DO≥30%,初始pH 7.4,发酵过程中不进行调控。
1.8 数据处理
每组实验均作3个平行,并使用spss 16.0和origin 8.5进行分析。
2 结果与讨论
2.1 等离子体诱变结果
2.1.1 等离子体诱变的致死率曲线及诱变剂量的选择
本实验按照1.5.2中的方法测定了照射0、30、45、60、75、90、105、120、150、180 s的致死率,获得的致死率曲线如下图1所示。
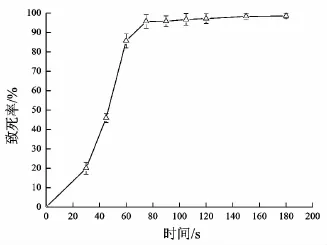
图1 ARTP诱变的致死率曲线
从上图可以清晰地看出,照射时间为75 s时,致死率就达到90%。一般致死率在90%以上,也是其发生突变概率最大的时候,所以本实验选取ARTP诱变时间为75 s,处理后经过稀释涂布,挑选单菌落用于初筛。
2.1.2 菌株的筛选结果
对挑选出来的菌株进行发酵复筛,以筛选得到安丝菌素AP-3的高产菌,经复筛最终获得一株产量比较高的菌株ARTP-054,其安丝菌素AP-3的产量可达到235.16 mg/L,较出发菌株FRCS-025的产量164.12mg/L提高了43.3%。
2.1.3 菌株ARTP-054遗传稳定性实验
珍贵束丝放线菌是典型的束丝放线菌科菌株,可形成带游动孢子的菌丝体,直径在0.5~1μm之间。Hasegawa等在1978年就鉴定其为革兰氏阳性菌,属于好氧菌,能在15~37℃条件下生长,众多研究表明其最适温度是28℃[10-11]。
将筛选出的高产菌株ARTP-054在斜面培养基上连续转接6代,其产量均稳定在234.12~235.16mg/L,结果见表2,表明该菌株的遗传性能稳定。

表2 ARTP-054遗传稳定性
2.2 化学诱变结果
2.2.1 化学诱变的致死率曲线及诱变剂量的选择
本研究测定了浓度为0.1、0.2、0.3、0.4、0.5 g/ L的亚硝基胍对菌株ARTP-039的致死率,致死率曲线如图2所示
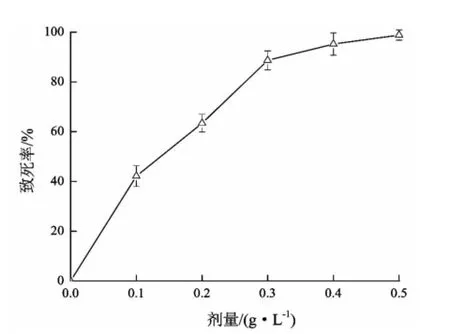
图2 化学诱变的致死率曲线
从图2看出,亚硝基胍浓度在0.4 g/L时,致死率就达到了95%,本实验选取亚硝基胍浓度为0.4 g/L作为化学诱变剂量,处理后稀释至涂布,挑选单菌落用于初筛。
2.2.2 异丁醇耐受菌株的初筛及化学诱变复筛结果
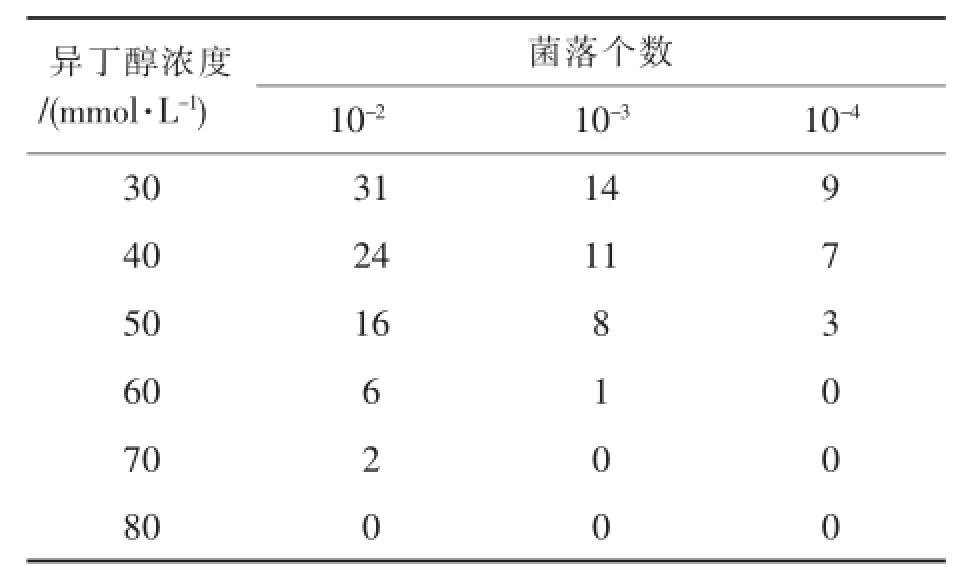
表3 异丁醇耐受菌株筛选
通过底物异丁醇耐受菌株筛选结果(表3)发现,异丁醇浓度大于80 mmol/L时,无菌落存在,随后本实验对异丁醇浓度在50、60、70 mmol/L时共36株菌进行了发酵复筛,最终获得了一株安丝菌素AP-3产量达287.64 mg/L的菌株FH-064,较原始菌株FRCS-025产量提高了75.3%。
2.2.3 遗传稳定性实验
将筛选出的高产菌株FH-064在斜面培养基上连续转接6代,其产量稳定在285.23~287.64 mg/L,其结果如表4所示,表明该菌株的遗传性能稳定。

表4 FH-064遗传稳定性
2.3 50 L发酵罐验证试验
取原始菌株和经复合诱变后的菌株进行50 L发酵罐验证对比实验,结果如图3。原始菌株对恶劣环境耐受能力较差,导致安丝菌素AP-3产量增长缓慢,而经过复合诱变后的菌株,则保持较快的产素速度,168 h下罐时产量达(292.36±6.8)mg/L。
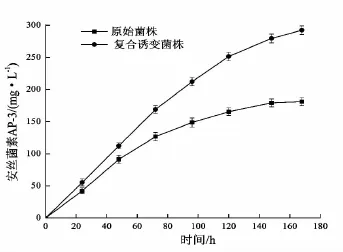
图3 安丝菌素AP-3产量随时间变化曲线
3 结论
通过ARTP诱变,筛选获得了一株安丝菌素AP-3高产菌株ARTP-054,其产量可达到235.16 mg/L,较原始菌株FRCS-025的产量164.12 mg/L提高了43.3%。以ARTP诱变获得高产菌株ARTP-054为出发菌株,进行化学诱变,并且使用安丝菌素AP-3支链前体异丁醇进行底物限制性筛选,并结合发酵复筛,最终筛得了一株安丝菌素AP-3高产菌株HF-064,产量达287.64 mg/L,较原始菌株FRCS-025产量提高了75.3%,遗传稳定性较好。本研究中提出的对菌株的复合诱变菌种选育思路(即先进行ARTP诱变,然后以筛选出的高产菌进行化学诱变),取得了很好的结果,经50 L发酵罐验证,其产量稳定,且在已报道文献中安丝菌素AP-3产量较高,这不仅为以后菌株的选育提供了一个思路,也为安丝菌素后续研究打下夯实的基础。
[1]伊丹,王岩,陈少欣.安丝菌素P-3的发酵工艺[J].中国医药工业杂志,2012,43(4):260-262.
[2]南艳妮,白晓光,孙桂芝,等.珍贵束丝放线菌固体发酵生产安丝菌素及安丝菌素P-0制备[J].中国抗生素杂志,2015,40 (4):241-244.
[3]汪晨,蔡恒,张恒丽,等.高产琥珀酸菌株的等离子体诱变选育[J].南京工业大学学报(自然科学版),2013,35(1):57-60.
[4]李慧玲,刘祖艳,赵敏.产β-甘露聚糖酶菌株的物理和化学诱变育种研究[J].安徽农业科学,2014,42(18):5741-5741.
[5]LITinglan,FAN Yuxiang,NAMBOU K,et al.Improvement of ansamitocin P-3 production by Actinosynnema mirum with fructose as the sole carbon source[J].Applied Biochemistry and Biotechnology,2015,175(6):2845-2856.
[6]GAO Yang,FAN Yuxiang,Nambou K,et al.Enhancement of ansamitocin P-3 production in Actinosynnema pretiosum by a synergistic effect of glycerol and glucose[J].Journal of Industrial Microbiology&Biotechnology,2014,41(1):143-152.
[7]JURJENSG,KIRSCHNINGA.Synthesisofa cytotoxic ansamycin hybrid[J].Organic Letters,2014,16(11):3000-3003.
[8]SCHWENK D,NETT M,DAHSE H M,et al.Injury-induced biosynthesis ofmethyl-branched polyene pigments in a whiterotting basidiomycete[J].Journal of Natural Products,2014,77 (12):2658-2663.
[9]NEWMAN D J,GIDDINGS L A.Natural products as leads to antitumor drugs[J].Phytochemistry Reviews,2014,13(1):123-137.
[10]EICHNER S,KNOBLOCH T,FLOSSH G,et al.The interplay between mutasynthesis and semisynthesis:generation and evaluation of an ansamitocin library[J].Angewandte Chemie International Edition,2012,51(3):752-757.
[11]TAFT F,HARMROLFS K,NICKELEIT I,et al.Combined muta-and semisynthesis:A powerful synthetic hybrid approach to access target specific antitumor agents based on ansamitocin P3[J].Chemistry-A European Journal,2012,18(3):880-886.
(责任编辑:朱小惠)

表2 废水副产元明粉过程板式蒸发结晶装置与单效管式蒸发结晶装置消耗比较结果
3 结语
在我国能源结构调整的背景下,MVR板式蒸发、结晶装置将得到长足发展。发酵行业物料多为有机物及有机酸盐,沸点升高相对较低,热敏性物质较多,非常适合于MVR板式蒸发、结晶装置。然而,发酵行业涉及物料成分较为复杂,设备供应商对基础物性掌握不充分,导致不能够完全发挥MVR板式蒸发装置的优良特性。需要设计单位、系统装置供应商、用户共同努力,紧密合作,在基础物性研究和系统配套上多下功夫,才能将MVR板式蒸发结晶装置在发酵行业推广普及。
参考文献:
[1]赵元军.蒸发器在发酵行业的应用[C].2007年全国发酵行业高峰论坛暨中国发酵工业协会2007年行业大会论文汇编. 2007:539-543.
[2]张永生,宋金虎.MVR在板式蒸发装置中的应用[J].发酵科技通讯,2011,40(4):1-4.
[3]梁林.处理高浓度含盐废水的机械蒸汽再压缩系统设计及性能研究[D].南京:南京航空航天大学,2013.
(责任编辑:朱小惠)
Breeding of enhanced ansam itocin producing strains of Actinosynnema pretiosum
ZHANG Jinlong,LIFang
(Tianjin Yongan Occupational Health Inspection Co.,Ltd.,Tianjin 300457,China)
The atmospheric pressure plasma at room temperature(ARTP)technology was applied to treat spores of Actinosynnema pretiosum FRCE-025.A high ansamitocin AP-3 producing strain ARTP-054wasobtained and theansamitocin concentration reached 235.16mg/L,whichwasincreased by 43.3%compared with the original strain(164.12 mg/L).Chemical mutagenesis was further carried out on strain ARTP-054.The spores suspension was treated by 0.4 g/L nitrosoguanidine,and isobutanol,the branched chain precursor of ansamitocin AP-3,was used for substrate restrictive screening.Combined with the second-round screening,another highly producing strain HF-064 was finally screened and the yield of ansamitocin reached 287.64 mg/L,which was increased by 75.3%compared with the original strain.The 50 L fermentor test showed that the genetic stability of the mutant strain is good,and the yield of ansamitocin reached 292.36 mg/L after 168 h of fermentation.
ansamitocin;atmospheric pressure plasma;chemicalmutagenesis;nitrosoguanidine
Q819
A
1674-2214(2015)04-0043-05
2015-09-30
张金龙(1989—),男,吉林吉林人,助理工程师,主要从事微生物发酵相关工作,E-mail:2969752161@qq.com.
