蓝莓对非酒精性脂肪性肝病小鼠肝细胞核因子相关因子2 表达的影响*
2015-03-20任婷婷王豫萍程明亮
黄 超 任婷婷 王豫萍 程明亮△
1.贵阳医学院感染病教研室 (贵州 贵阳,550004) 2.贵阳医学院生化教研室 3.贵阳医学院微生物教研室
近年来研究发现,氧化应激是NAFLD 的重要发病机制[1],而核因子相关因子2(Nrf2)是肝脏抗氧化应激系统的中心环节。当机体启动氧化应激时,转录因子Nrf2 与抗氧化反应元件(ARE)结合,促进抗氧化酶系的表达,从而抵抗外源性物质引起的肝损害[2,3]。本课题组前期研究表明[4,5],蓝莓能够通过增强机体的抗氧化能力,对急慢性肝损伤起到较好的保护作用。研究发现[6],姜黄素能促进肝细胞中Nrf2 的表达。故本研究以高脂饲料建立NAFLD 小鼠模型,来探究蓝莓对NAFLD 的保护作用及相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物和饲料 C57BL/6J 雄鼠40 只,8周龄,体重(23 ±5)g;购于贵阳医学院动物实验中心(动物批号SYXK 黔2012-0001,伦理学文件批号1403070);纯化型高脂饲料(江苏南通特洛菲饲料科技有限公司,TP26300)。
1.1.2 主要试剂 蓝莓(兔眼品种)购于贵州省麻江蓝莓基地;姜黄素溶液(Sigma,458-37-7);兔抗鼠Nrf2 多克隆抗体(Abcam,EP1808Y);蛋白提取试剂盒(宝生物工程有限公司,RR047A);GAPDH 兔抗鼠一抗(武汉博士德生物技术有限公司,212601-ap);辣根过氧化物酶标记羊抗兔二抗(上海基因工程部,GK500710);BCA 蛋白定量试剂盒(Biomiga,PW0104);Western blot 超敏化学发光试剂(百乐公司,WBKLS0100);肝组织GSH、MDA、TG 测定试剂盒、SOD 活性蛋白检测试剂盒(上海凯基);其他试剂均为国产分析纯。
1.1.3 主要仪器 全自动生化分析仪(日本ADVIA2400);高速低温离心机(sigma3K15);电子天平(JA10003B);分光光度仪(上海奥析科学仪器);MSS 全波长酶标仪(BioTec);1DYCZ-24DN 型电泳仪(自北京市六一仪器厂);图像采集系统(OLYMPUS,BX41);Gel Doc XR 凝胶成像系统(BIO-RAD)。
1.2 实验动物分组 40 只小鼠普通饲料喂养一周后,随机分为正常组(A)、蓝莓组(B)、姜黄素组(C)及模型组(D)4 组,每组10 只。除正常组饲喂正常饲料外,其余各组均饲喂高脂饲料。蓝莓组每日固定时间予蓝莓原浆(15 ml·kg-1·d-1)灌胃,姜黄素组予姜黄素溶液(200mg·kg-1·d-1)灌胃,其余两组予等容量的生理盐水灌胃。实验动物均自由饮食、饮水。
1.3 动物取材 饲喂12周后,禁食水12h,称体重,4%水合氯醛麻醉后颈部脱臼处死,摘除眼球取血,分离血清,-80℃保存;取相同部位部分肝脏用于油红染色,剩余肝脏-80℃保存。
1.4 指标检测 ①肝组织病理学检测:取新鲜小鼠肝组织制备病理切片,行油红染色。②血清生化指标检测:全自动生化分析仪测定小鼠血清ALT、AST、TG、TC 含量。③测定肝组织中GSH、MDA、TG 含量及SOD 活性:取肝组织50mg,严格按照试剂盒说明书进行检测并记录数据。④Western blot 检测肝组织Nrf2 蛋白表达水平:按试剂盒说明书提取蛋白,测定蛋白含量。取蛋白质样品50μg,行SDS-PAGE 电泳,转膜,封闭。用Nrf2 抗体(1:1000)4℃孵育过夜,隔日用二抗(1:3000)室温孵育1h,ECL 曝光显影,Gel Doc EQ 凝胶成像仪扫描,Quantity One 软件分析结果。以GAPDH 表达水平作为内参,目标蛋白的表达量以目标蛋白与内参照蛋白灰度值的对比值表示。
2 结果
2.1 各组小鼠肝组织形态学变化 A 组肝组织油红染色未见细胞水肿及红色脂肪滴;D 组肝组织见弥漫性细胞水肿及重度脂肪变性,胞浆中出现大量的红色脂滴;B、C 组肝细胞较D 组来说,肝细胞脂质沉积明显较轻(见插页图1)。
2.2 各组小鼠血清ALT、AST、TG、TC 结果 见表1。
表1 各组小鼠血清生化指标及脂代谢指标测定结果(n=10,)
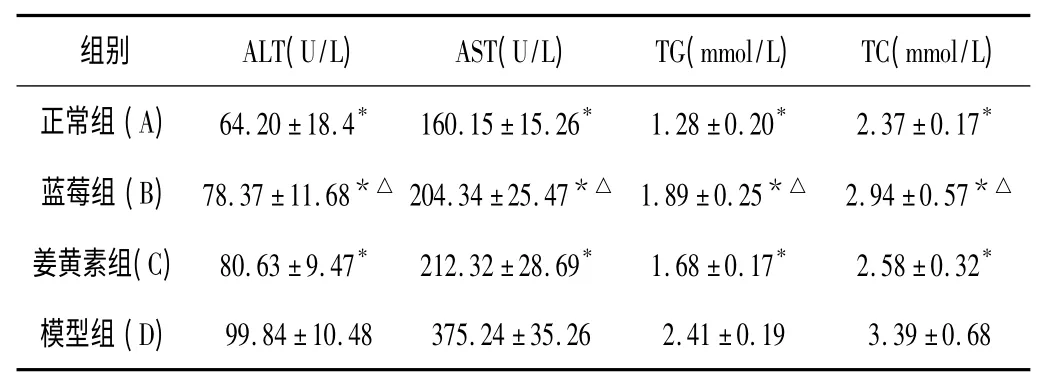
表1 各组小鼠血清生化指标及脂代谢指标测定结果(n=10,)
与模型组比较,* P<0.05;与姜黄组比较,△P>0.05
2.3 各组小鼠肝组织中GSH、MDA、TG 含量及SOD 活性 见表2。
表2 各组小鼠肝组织GSH、MDA、TG、SOD 指标测定结果比较(n=10,)
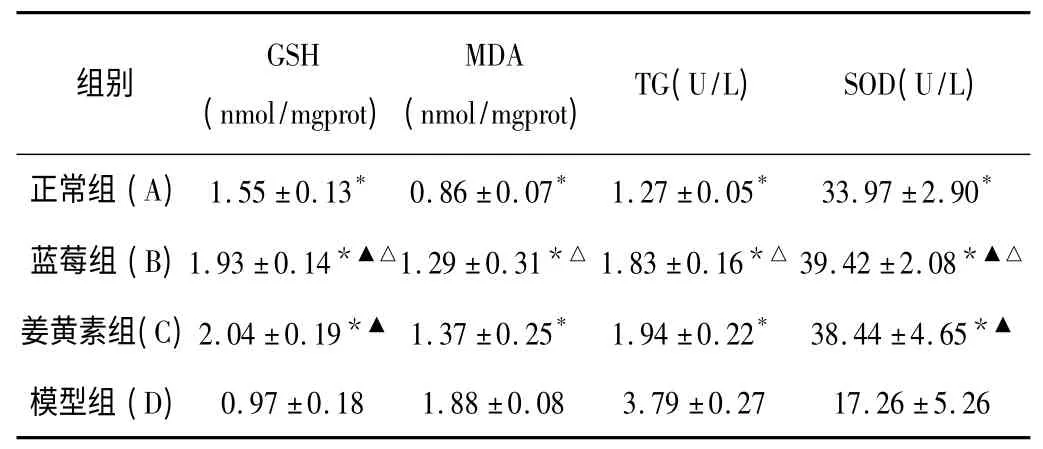
表2 各组小鼠肝组织GSH、MDA、TG、SOD 指标测定结果比较(n=10,)
与模型组比较,* P<0.05;与正常组比较,▲P<0.05;与姜黄组比较,△P>0.05
2.4 各组小鼠肝组织中Nrf2 蛋白表达的变化 B、C、D 组Nrf2 蛋白表达高于A 组(P<0.05),而B、C 组Nrf2 蛋白表达明显高 于D 组(P<0.05),B、C组间对比无统计学意义(P>0.05),见图2。
3 讨论
NAFLD 的发病进程中,氧化应激是“二次打击学说”的中心致病环节[7]。在高脂饮食情况下,脂质在肝脏堆积,产生大量脂肪酸,所产生的脂肪酸激活线粒体、微粒体的氧化作用,积累大量活性氧(ROS)。ROS 一方面直接或间接损伤肝细胞内DNA、蛋白质,引起脂质过氧化;另一方面抑制细胞线粒体功能,造成ATP 生成下降,影响肝细胞功能系统。两个方面同时降低肝细胞三酰甘油代谢能力,从而促进肝细胞脂肪变性[8]。Nrf2属于亮氨酸拉链家族的调节抗氧化应激反应的重要转录因子,在细胞调节抗氧化应激反应中发挥着重要作用。当细胞氧化应激时,其通过与ARE 相互作用调节编码抗氧化蛋白如GSH、SOD 的表达,提高机体的抗氧化应激能力,进而抵御外来有害物质所造成的肝损伤[9]。有文献报道[10],对Nrf2(-/ -)小鼠饲喂高脂胆固醇饲料时,其肝脏脂肪沉积程度明显高于等条件下的野生小鼠。张海峰等[11]研究也发现,通过姜黄素促进小鼠肝脏中Nrf2 的表达,能够提高小鼠抗氧化酶系的表达及活性,减轻NAFLD 病情的发展。因此我们推测,肝细胞中Nrf2 表达的变化所造成的机体抗氧化应激能力的改变,可能是NAFLD发病的重要途径。

图2 Western blot 检测各组小鼠Nrf2 蛋白表达(n=10,)
蓝莓属杜鹃花科越桔属,富含花青素、绿原酸、黄酮素、蝶二苯乙烯(紫檀芪)、亚麻油酸、白藜芦醇及各种维生素等生物活性成分,具有明确的抗氧化、抗炎、降血脂的作用[12]。因其有巨大的保健作用,被联合国粮农组织(FAO)列为五大健康食品之一,英国权威营养学家将其评选为全球15 种健康食品之首,又被称为“黄金浆果”[13]。Mansour 等[14]发现蓝莓可以抑制北极鲑鱼精液由硫酸亚铁引起的肝细胞脂质过氧化。Barros 等[15]在鼷鼠上的实验也说明蓝莓所含的多酚,包括花青苷具有良好的抗氧化和基因保护作用。
本研究发现,蓝莓组、姜黄素组小鼠肝组织油红染色中红色油脂沉积明显少于模型组,而血清中ALT、AST、TG、TC 含量明显低于模型组(P<0.05),提示蓝莓与姜黄素能有效改善NAFLD 发病过程中肝细胞的损伤及脂质代谢紊乱,减少脂肪在肝细胞内的沉积。Western blot 结果也发现,模型组Nrf2 蛋白表达高于正常组(P<0.05),说明机体在高脂饮食情况下会代偿性地上调其表达从而抵抗脂质代谢所造成的氧化应激。同时蓝莓组、姜黄素组小鼠肝组织中Nrf2 的蛋白表达、GSH 含量及SOD 活性明显高于模型组及正常组(P<0.05),同时MDA、TG含量低于模型组(P<0.05),表明蓝莓能够通过上调Nrf2 的表达,提高小鼠的氧化应激能力拮抗NAFLD 的发生发展。
综上所述,蓝莓对NAFLD 有较好的防治作用,可能通过上调肝组织中Nrf2 蛋白的表达,从而提高机体抗氧化能力拮抗高脂饮食下NAFLD 的发生与发展。
[1]Luthra A,Nigam P,Misra A.Metabolic correlation and management strategies of non-alcoholic fatty liver disease:An Asian Indian perspective[J].Diabetes Metabolic syndr,2007:1(4):279 -285.
[2]Copple IM.The Keap1-Nrf2 cell defense pathway-a promising therapeutic target?[J].Adv Pharmacol,2012,63:43 -79.
[3]Magesh S,Chen Y,Hu LQ.Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents[J].Med Res Rev,2012,32 (4):687 -726.
[4]李宏,杨勤,程明亮,等.蓝莓对免疫性肝纤维化大鼠肝组织TLR4-TLR9 表达的影响[J].世界华人消化杂志,2012,20(18):1609 -1615.
[5]姜萍萍,张权,王豫萍,等.蓝莓下调Toll 样受体4 表达减轻肝损伤的作用机制[J].临床肝胆病杂志,2012,28(5):380 -382.
[6]王正,张静.姜黄素对小鼠肝损伤的影响[J].食品科学杂志,2007,10:501 -503.
[7]李颖,洪振丰.“二次打击"假说与非酒精性脂肪肝[J].医学综述,2013,19(4):594 -596.
[8]Paradies G,Paradies V,et al.Oxidative stress,cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease[J].World J Gastroenterol.2014;20(39):14205 -14218.
[9]王豫萍,程明亮.Nrf2-Keap1 抗氧化系统与肝脏疾病[J].世界华人消化杂志.2010,18(18):1907 -1911.
[10]Toshinori Kamisako,Yuji Tanaka,et al.Role of Nrf2 in the alteration of cholesterol and bile acid metabolism-related gene expression by dietary cholesterol in high fat-fed mice[J].J Clin Biochem Nutr.Mar 2014,54(2):90 -94.
[11]张海峰,王锋.Nrf2 减轻小鼠非酒精性脂肪性肝炎[J].基础医学与临床.2014,31(3):360 -364.
[12]陈介甫,李亚东,徐哲.蓝莓的主要化学成分及生物活性[J].药学学报,2010,45(4):422 -429.
[13]Wu X,Beecher GR,Holden JM,et al.Lipophilic and hydrophilic antioxident capacities of common foods in the United States[J].J Agric Food Chem,2004,52:4026 -4034.
[14]Mansour N,McNiven MA,Richardson GF.The effect of dietary supplementation with blueberry,alpha-tocopherol or astaxanthin on oxidative stability of Arctic char (Salvelinus alpinus)semen[J].Theriogenology,2006,6:373 -382.
[15]Barros D,Amaral OB,Izquierdo I,et al.Behavioral and genoprotective effects of Vaccinium berries intake in mice[J].Pharmacol Biochem Behav,2006,84:229 -234.
