新型高载药量姜黄素聚前药两亲分子的制备与抗肿瘤研究*
2015-03-18胡祥龙翟少东张文佳
胡祥龙,翟少东,曹 冰,杨 军,张文佳,李 辉
(1.华南师范大学激光生命科学研究所,激光生命科学教育部重点实验室,生物光子学研究院,广东 广州510631;2.中国科学技术大学,高分子科学与工程系,安徽 合肥510040)
0 引言
姜黄素(Curcumin)是从植物姜黄中分离得到的多酚类有机化合物,具有广泛的药用价值,如抗氧化、抗菌、抗炎以及抗肿瘤等[1]。在抗肿瘤方面,研究发现姜黄素可以抑制多种肿瘤的生长增殖[2,3],被用于放疗[4,5]和化疗[6,7]。但是其水溶性差,且在中性或者碱性条件下,结构不稳定,在体内易被代谢,药物的生物利用率低[8,9],在pH=7.2条件下,其降解半衰期甚至不足十分钟[10]。
针对上述问题,姜黄素的前药研究越来越受到重视,但是普遍存在载药量低等不足[11]。最近,我们设计了一种具有两亲性且含有药物重复单元的功能高分子,即聚前药两亲分子(Polyprodrug amphiphiles),实现高载药量(>50 wt%)和多级纳米结构调控,并详细研究其抗肿瘤纳米结构效应[12];另外,也发展了具备肿瘤细胞穿膜和长血液循环特征的单分子超支化聚前药两亲分子体系,用于抗肿瘤药物传输和肿瘤医学成像;实现在肿瘤细胞内信号刺激下,药物活性启动,磁共振造影信号协同增强[13]。这些结果表明聚前药两亲分子在抗肿瘤研究领域具有很好的应用和发展前景。
本工作中,我们将一种肿瘤酸性微环境可降解的共价键和亲水功能团引入到姜黄素的聚前药两亲分子设计中,可以很好地实现姜黄素在肿瘤细胞内的输运、释放,并表现出良好的抗肿瘤活性。
1 实验部分
1.1 试剂
二缩三乙二醇(Triethylene glycol),3-溴丙炔(Propargyl bromide),80% in toluene stabilized with MgO,Alfa Aesar),3-巯基丙酸(Alfa Aesar)。对甲苯磺酰氯(TsCl),叠氮化钠(NaN3),溴化亚铜,四正丁基碘化铵,草酰氯(Oxalyl chloride),三乙胺购自国药集团;姜黄素,五甲基二乙烯三胺(PMDETA)购自Aldrich;石油醚,乙酸乙酯,二氯甲烷,硫酸镁,氨水,二甲亚砜,N,N-二甲基甲酰胺等溶剂均购自国药集团。
1.2 仪器与表征
核磁共振谱(NMR)采用Bruker AV300核磁共振仪表征(共振频率为300 MHz,CDCl3为氘代试剂)。透射电子显微镜(TEM)测试在JEOL 2010电子显微镜完成,加速电压120 KV,样品制备采用吸取10μL样品溶液滴在Formvar薄膜和碳膜的铜网上,然后快速液氮冷却,冷冻干燥以保持其在溶液态的形貌。紫外-可见光谱用Unico UV/vis 2802PCS紫外可见分光光度计测试。
2 结果与讨论
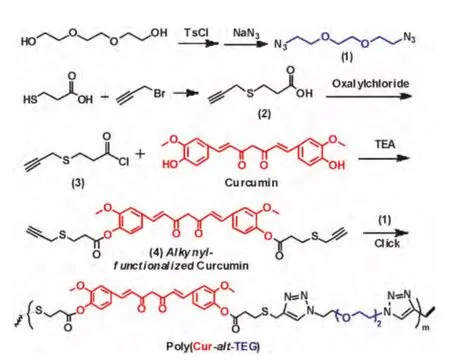
图1 姜黄素聚前药两亲分子Poly(Cur-alt-TEG)及其小分子前体合成Fig.1 Synthetic routes employed for curcumin-based polyprodrug amphiphiles,Poly(Cur-alt-TEG)and its small molecular precursors
2.1 1,2-bis(2-azidoethoxy)ethane(式1)的合成
将三甘醇(3 g,20 mmol)和对甲苯磺酰氯(8.580 g,45 mmol)溶于60 mL干燥CH2Cl2中,加入KOH(9.250 g,160 mmol),冰水浴反应3小时。结束反应,加入60 mL水,用CH2Cl2萃取水相,无水硫酸镁干燥有机相,过滤,浓缩除去溶剂,得到白色粉末状固体(8.620 g,产率94.10%)。称取该白色固体粉末(3.664 g,8 mmol)和NaN3(2.000 g,32 mmol)溶于20 mL DMF中,常温反应过夜,经过水洗,乙酸乙酯萃取,浓缩得到无色透明液体(1.315 g,产率82.2%),其核磁氢谱表征如Fig.2a所示。
2.2 炔基功能化姜黄素(式4)制备
称取3-巯基丙酸(1.592 g,15 mmol),加入到32 mL氨 水 中(25%-28%),搅 拌,加 入3-溴 丙 炔(3.569 g,30 mmol,80%储存在甲苯中),冰浴,反应40分钟,浓缩,过滤,在滤液中加入饱和NaHCO3水溶液,用CH2Cl2萃取。取水相,用浓盐酸酸化,用乙酸乙酯萃取。将油层分出,除去溶剂。再采用硅胶柱层析,用石油醚:乙酸乙酯=1∶3的淋洗剂,最后得到红色液体(如图1中的式2中间体,3-(prop-2-yn-1-ylthio)propanoic acid,1.570 g,产率72.7%),其核磁氢谱表征如Fig.2b所示,结果表明成功制备式2中间体。
称取中间体2(1.000 g,6.943 mmol)和草酰氯(3.328 mL,35.00 mmol)加入到经干燥处理的30 mL CH2Cl2中,N2保护下反应过夜。除去溶剂,得到黄色液体,即成功将式2分子的羧基变成酰氯的中间体3(1.068 g,产率95%)。
最后,称取姜黄素(0.500 g,1.357 mmol)和三乙胺(0.568 mL,4.072 mmol)加入到30 mL干燥的CH2Cl2中,冰浴。将中间体3(0.661 g,4.072 mmol)缓慢滴加到体系中,反应24 h。水洗,萃取有机相,并用无水硫酸镁干燥。粗产物进行柱层析分离,淋洗剂为石油醚:二氯甲烷=1∶3,最后得到棕色固体,即炔基功能化姜黄素(如图1式4所示,0.510 g,产率60.6%)。其核磁氢谱表征及峰的归属如图2c所示,表明成功合成炔基功能化姜黄素前药分子(如图1中式4所示)。

图2 姜黄素聚前药两亲分子Poly(Cur-alt-TEG)及其小分子前体的核磁共振氢谱表征Fig.2 1 H NMR spectra recorded for curcumin-based polyprodrug amphiphiles,Poly(Cur-alt-TEG)and its small molecular precursors
2.3 姜黄素聚前药两亲分子Poly(Cur-alt-TEG)的制备
如Fig.1所示,采用缩聚方法制备姜黄素聚前药两亲分子,先将炔基功能化姜黄素(式4,124 mg,0.2 mmol)、叠氮化三甘醇(式4,42 mg,0.21 mmoL)和PMDETA(1.4 mg,0.01 mmol)溶于1.5 mL DMSO中,经过冻融循环除去空气,加入溴化亚铜(1.4 mg,0.01 mmol),抽真空,50℃加热反应48 h。结束后,采用乙醚沉淀,室温干燥过夜。得到褐色固体(100 mg,27μmol,产率60.24%)。如Fig.2d所示,核磁共振氢谱中有明显的点击反应产物三氮唑的质子信号,计算获悉平均每条分子链上有5个三氮唑,再结合投料比叠氮基多于炔基、炔基基本没有出现在核磁氢谱上,因此聚合物的结构式可以表示为Poly(Cur4-alt-TEG5),简写为Poly(Cur-alt-TEG),数均分子量为2224,姜黄素的载药量为66.2 wt%,如此高的载药量在现有姜黄素药物传输体系中是非常少见的[14]。
另外,采用紫外吸收光谱进一步验证了姜黄素聚前药两亲分子的成功制备;姜黄素的紫外吸收在~210 nm以及~430 nm,经过改性以后,由于羟基和炔基等的吸电子性质不同,430 nm处的吸收峰发生蓝移,炔基化姜黄素前体的紫外吸收在210 nm以及400 nm处,同样,Poly(Cur-alt-TEG)在210 nm和400 nm处都有强吸收。因此,从吸收峰的位置说明姜黄素前体成功聚合,且制备过程中没有降解释放姜黄素,具有较好的稳定性。
2.4 Poly(Cur-alt-TEG)胶束纳米粒子的制备与表征
由于Poly(Cur-alt-TEG)中三甘醇亲水基元的存在,因此其具有两亲性。本文采用“自下而上”的自组装策略来制备姜黄素聚前药两亲分子的水相纳米粒子,先称取2.0 mg Poly(Cur-alt-TEG)聚合物,溶解在1.0 mL DMSO中,随后在快速搅拌下,快速注入水中,继续搅拌3 h,然后转移到透析袋中对水透析除去有机溶剂,多次换水,即可制得姜黄素聚前药两亲分子的水相纳米粒子,进行浓度标定,并用于后续测试。采用TEM对胶束纳米粒子进行了表征,如Fig.3b所示,纳米粒子的平均直径约为46 nm,抗肿瘤药物传输纳米粒子的尺寸一般不超过200 nm会更加有利,因此,姜黄素药物传输体系的尺寸满足肿瘤治疗的要求[14]。
2.5 抗肿瘤活性评价
选用HepG 2细胞系,通过MTT法检测姜黄素聚前药两亲分子Poly(Cur-alt-TEG)纳米粒子的抗癌活性。将细胞接种在96孔板上,每个孔加100μL培养基,初始密度约为每孔80 000个细胞,培养过夜至细胞贴壁,再用换取新鲜的培养基替代,分别加入姜黄素和Poly(Cur-alt-TEG)的组装体培养48 h。另设细胞空白对照组和培养基空白组,每孔设5复孔。每孔加入20μL MTT试剂(PBS溶液,5 mg/mL),继续培养5 h后,吸出DMEM培养基,加入180μL DMSO,酶标仪检测570 nm的吸光度值(A)。每次实验条件均采集四组数据,所得到的最终数据是四组平行试验的平均值及标准偏差(±SD),以培养基空白组调零,计算细胞存活率。如图4所示,Poly(Cur-alt-TEG)与姜黄素小分子药物对肿瘤细胞的毒性接近,说明姜黄素的聚前药两亲分子在改善药物的溶解性的同时并没有使其丧失药效;这与聚前药两亲分子的分子结构有关,如Fig.1所示,本文采用巯基丙酸酯键连接姜黄素构成分子骨架,而该键在微酸性环境中会发生降解[15],即纳米粒子进入肿瘤细胞以后,在肿瘤的酸性细胞器内发生降解,释放出姜黄素原药分子,表现出抗肿瘤活性[16]。

图3 (a)姜黄素,炔基功能化姜黄素以及姜黄素聚前药两亲分子Poly(Cur-alt-TEG)的紫外吸收光谱;(b)姜黄素聚前药两亲分子Poly(Cur-alt-TEG)的自组装纳米粒子透射电镜图Fig.3 (a)UV-vis absorption spectra for curcumin,alkynyl-functionalized curcumin,and Poly(Cur-alt-TEG);(b)TEM image recorded for nanoparticles fabricated from the aqueous self-assembly of Poly(Cur-alt-TEG)

图4 不同浓度姜黄素聚前药两亲分子Poly(Curalt-TEG)和姜黄素与HepG2细胞共培养48 h的细胞活性Fig.4 Cell viability analysis determined by MTT assay for HepG2 cells upon incubation with aqueous dispersion of Poly(Cur-alt-TEG)and curcumin at different equivalent dosages
3 结论
近年来,姜黄素的抗肿瘤研究越来越受到关注,但其水溶性和稳定性限制了其应用。基于聚前药两亲分子在抗肿瘤研究中的重要优势,本文利用缩聚反应制备了姜黄素的聚前药两亲分子Poly(Cur-alt-TEG),载药量高达66.2%。通过水相自组装调控,制备球状纳米粒子,粒径约为46 nm。细胞生物学评价表明,该姜黄素药物传输系统对HepG2细胞具有较好的杀伤效果。本文研究表明姜黄素聚前药两亲分子在肿瘤治疗领域具有重要应用前景,为未来姜黄素药物传输体系设计提供了重要参考。
[1]KUNNUMAKKARA A B,ANAND P,AGGARWAL B B.Curcumin inhibits proliferation,invasion,angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins[J].Cancer Lett,269(2):199-225.
[2] WILLIAM B M,GOODRICH A,PENG C,et al.Curcumin inhibits proliferation and induces apoptosis of leukemic cells expressing wild-type or T315I-BCR-ABL and prolongs survival of mice with acute lymphoblastic leukemia[J].Hematology,2008,13(6):333-343.
[3] DUJIC J,KIPPENBERGER S,RAMIREZ-BOSCA A,et al.Curcumin in combination with visible light inhibits tumor growth in a xenograft tumor model[J].Int J Cancer,2009,124(6):
1422-1428.
[4] KUNNUMAKKARA A B,DIAGARADJANE P,GUHA S,et al.Curcumin sensitizes human colorectal cancer xenografts in nude mice toγ-radiation by targeting nuclear factor-κb-regulated gene products[J].Clin Cancer Res,2008,14(7):2128-2136.
[5] JAVVADIP,SEGAN A T,TUTTLE SW,et al.The chemopreventive agent curcumin is a potent radiosensitizer of human cervical tumor cells via increased reactive oxygen species production and overactivation of the mitogen-activated protein kinase pathway[J].Mol Pharmacol,2008,73(5):1491-1501.
[6] KUNNUMAKKARA A B,GUHA S,KRISHNAN S,et al.Curcumin potentiates antitumor activity of gemcitabine in an orthotopic model of pancreatic cancer through suppression of proliferation,angiogenesis,and inhibition of nuclear factor-kappaB-regulated gene products[J].Cancer Res,2007,67(8):3853-3861.
[7] TANG H,MURPHY C J,ZHANG B,et al.Amphiphilic curcumin conjugate-forming nanoparticles as anticancer prodrug and drug carriers:in vitroandin vivoeffects[J].Nanomedicine,2010,5(6):855-865.
[8] DHILLON N,AGGARWAL B B,NEWMAN R A,et al.Phase II trial of curcumin in patients with advanced pancreatic cancer[J].Clin Cancer Res,2008,14(14):4491-4499.
[9]ANAND P,KUNNUMAKKARA A B,NEWMAN R A,et al.Bioavailability of curcumin:Problems and promises[J].Mol Pharm,2007,4(6):807-818.
[10] WANG Y J,PAN M H,CHENG A L,et al.Stability of curcumin in buffer solutions and characterization of its degradation products[J].J Pharm Biomed Anal,1997,15(12):1867-1876.
[11] HANI U,SHIVAKUMAR H G.Solubility enhancement and delivery systems of curcumin a herbal medicine:A review[J].Curr Drug Deliv,2014,11(6):792-804.
[12] HU X,HU J,TIAN J,et al.Polyprodrug amphiphiles:Hierarchical assemblies for shape-regulated cellular internalization,trafficking,and drug delivery[J].J Am Chem Soc,2013,135(46):17617-17629.
[13] HU X,LIU G,LI Y,et al.Cell-penetrating hyperbranched polyprodrug amphiphiles for synergistic reductive milieu-triggered drug release and enhanced magnetic resonance signals[J].JAm Chem Soc,2015,137(1):362-368.
[14] PEER D,KARP J M,HONG S,et al.Nanocarriers as an emerging platform for cancer therapy[J].Nat Nanotechnol,2007,2(12):751-760.
[15] DAN K,GHOSH S.One-pot synthesis of an acid-labile amphiphilic triblock copolymer and its pH-responsive vesicular assembly[J].Angew Chem Int Ed,2013,52(28):7300-7305.
[16] WANG M,RUAN Y,CHEN Q,et al.Curcumin induced hepg2 cell apoptosis-associated mitochondrial membrane potential and intracellular free ca2+concentration[J].Eur JPharmacol,2011,650(1):41-47.
