重度子痫前期并发低蛋白血症对妊娠结局的影响
2015-03-18罗永红
罗永红,刘 记
(皖南医学院弋矶山医院妇产科,安徽芜湖241001)
重度子痫前期病情重而且进展快,往往迅速出现全身多脏器并发症,同时大量蛋白尿的丢失及肝脏合成蛋白功能减退形成低蛋白血症,严重威胁母婴健康,处理尤为棘手。本文回顾性分析本院2013年1月至2014年10月住院的113例重度子痫前期患者的临床资料,以探讨重度子痫前期并发低蛋白血症对母婴结局的影响,现报道如下。
1 资料与方法
1.1 一般资料 选择本院产科2013年1月至2014年10月间收治的重度子痫前期患者113例,诊断标准参考《妊娠期高血压疾病诊治指南(2012)版》的诊断分类标准[1]。妊娠高血压疾病患者当血清清蛋白小于30g/L即可诊断低蛋白血症。其中低蛋白血症组(A组)61例,占重度子痫前期患者的54.0%,非低蛋白血症组(B组)52例,占重度子痫前期患者的46.0%,两组病例均选择单胎妊娠,排除既往高血压及心脏、肝脏、肾脏疾病的患者。
1.2 方法
1.2.1 治疗方案 所有患者入院后行凝血功能、血常规、尿常规、24h尿蛋白定量、肝肾功能、电解质、眼底镜及心电图检查,部分心电图异常及有胸闷、心慌症状者行心脏彩超检查。有上腹痛及肝功能异常者行肝、胆、胰B超检查。所有患者治疗措施如下:(1)硫酸镁预防子痫;(2)孕周小于34周者予以促胎肺成熟;(3)给予心电监护,监测血压、心率、呼吸、血氧饱和度,适当使用降压药,控制血压在155/95mm Hg以下;(4)评估胎儿状况包括胎心监护,B超监测胎儿发育、胎盘功能及羊水量。(6)适时终止妊娠:妊娠小于26周及妊娠26~28周经治疗病情不稳定者建议终止妊娠;妊娠28~34周病情不稳定且治疗24~48h无好转促肺成熟后终止妊娠,病情稳定者期待治疗,治疗期间定期复查相关实验室检查;妊娠大于34周者胎儿肺成熟后终止妊娠;而孕周达37周的重度子痫前期患者予以积极终止妊娠。当重度子痫前期出现心功能不全、糖尿病及肾功能不全等并发症时,在相关内科医师的协助下给予积极对症治疗,待病情稳定后,及时终止妊娠。
1.2.2 观察指标 观察两组孕妇发病孕周、终止妊娠孕周、发病时血压情况、母体各种并发症发生率;并观察两组围生儿结局,包括新生儿出生体质量、围生儿死亡数量、胎儿生长受限/小于胎龄儿(FGR/SGA)数量,以及新生儿窒息等发生情况。
1.3 统计学处理 采用SPSS17.0软件进行统计学分析,计量资料用±s表示,组间比较采用t检验;计数资料用率表示,组间采用χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组孕妇发病情况 两组孕妇中妊娠期糖尿病10例,A组6例,B组4例;妊娠期肝内胆汁淤积症7例,A组3例,B组4例。两组比较差异无统计学意义(P>0.05)。两组平均年龄及孕次比较差异无统计学意义(P>0.05),见表1。A组发病孕周及终止妊娠孕周均早于B组(P<0.05)。入院时A组患者收缩压及舒张压均高于B组(P<0.05),见表2。
2.2 孕妇并发症情况 A组孕妇胎盘早剥3例、羊水过少5例、产后出血3例、子痫2例、心功能不全1例、肾损害3例、视网膜损害5例(其中Ⅰ级1例、Ⅱ级1例、Ⅲ级1例,视网膜剥离2例)、肝损害6例、血小板减少8例、浆膜腔积液21例,1例为多浆膜腔积液,A组中3例出现两种以上并发症;B组患者并发症发生情况如下:胎盘早剥1例、羊水过少4例、产后出血1例、心功能不全1例、视网膜损害1例、血小板减少1例、浆膜腔积液3例,其中1例出现两种以上并发症。A组肝功损害、浆膜腔积液、血小板减少并发症发生率均高于B组(P<0.05);A组胎盘早剥、羊水过少、产后出血、子痫、肾功能损害、视网膜损害的发生率高于B组,但两组比较差异无统计学意义(P>0.05),见表3。
2.3 母婴结局 113例孕妇无死亡案例。8例经阴道分娩,其余均行剖宫产终止妊娠。所有孕妇包括出现并发症者均在多科协作治疗下痊愈出院。围生儿情况:A组患者死胎3例,围生儿死亡1例;A组中有2例孕龄不足28周者新生儿死亡,因孕龄不足28周未计入围生儿死亡;活产新生儿58例。B组患者死胎1例,围生儿死亡1例;活产新生儿51例。A组患者FGR/SGA发生率、新生儿窒息发生率显著高于B组(P<0.05);A组患者新生儿平均出生体质量低于B组(P<0.05)。两组患者死胎率及围生儿病死率差异无统计学意义(P>0.05),见表4。

表1 两组孕妇一般情况比较
表2 两组孕妇发病情况比较(±s)
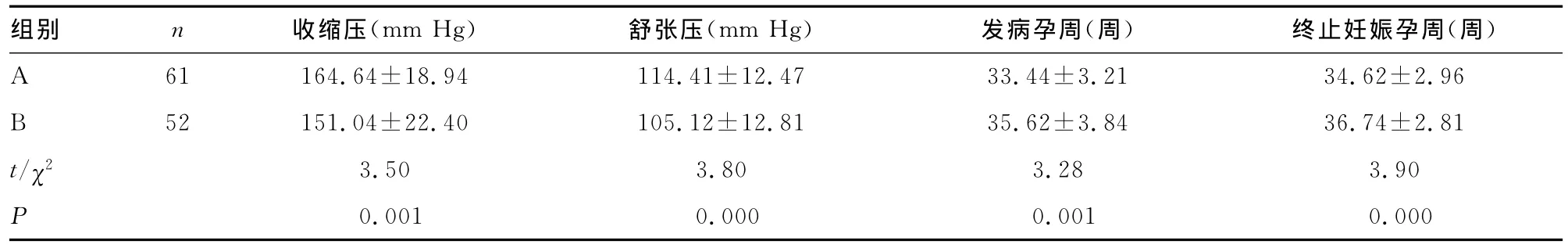
表2 两组孕妇发病情况比较(±s)
组别 n 收缩压(mm Hg) 舒张压(mm Hg) 发病孕周(周) 终止妊娠孕周(周)A 61 164.64±18.94 114.41±12.47 33.44±3.21 34.62±2.96 B 52 151.04±22.40 105.12±12.81 35.62±3.84 36.74±2.81 t/χ2 3.50 3.80 3.28 3.90 P 0.001 0.000 0.001 0.000
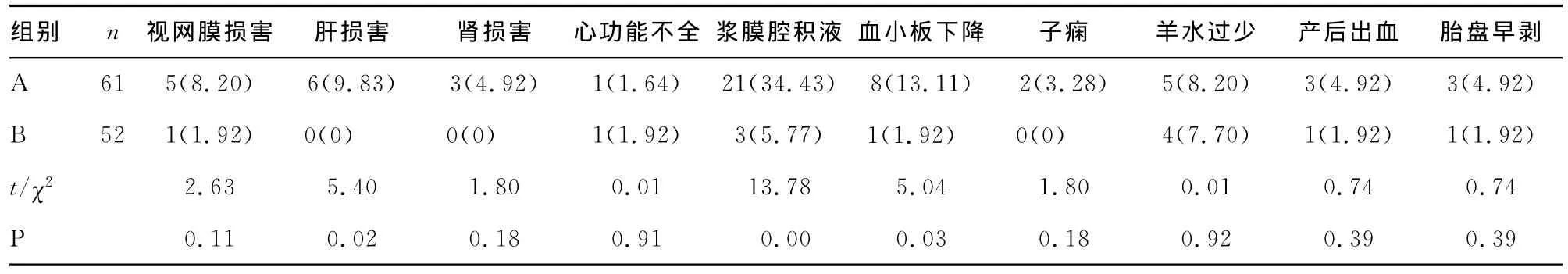
表3 两组患者母体并发症比较[n(%)]
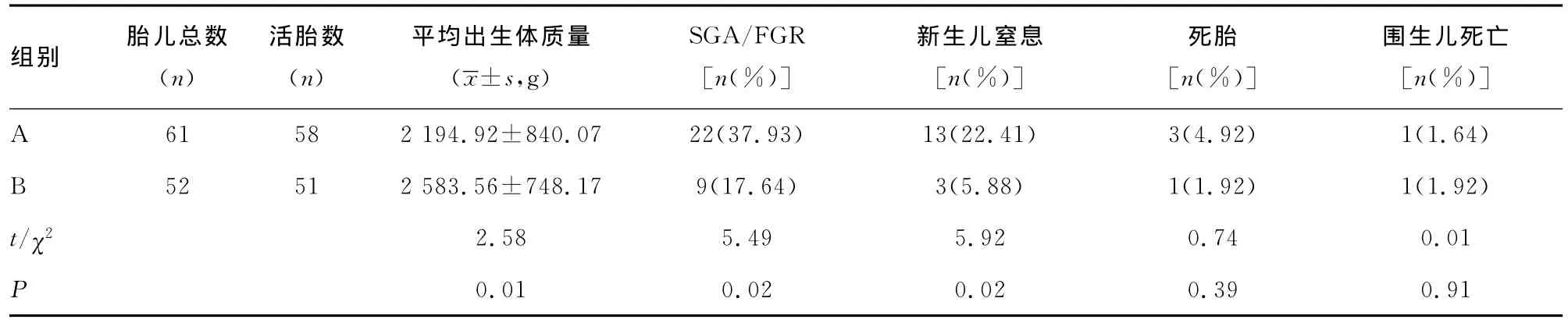
表4 两组围产儿结局比较
3 讨 论
重度子痫前期是妊娠期高血压疾病发展的严重阶段,危害母婴健康。重度子痫前期易并发低蛋白血症[2],马玉红等[3]认为低蛋白血症是导致重度子痫前期患者预后不良的一个独立因素,孕妇可迅速出现多个脏器并发症,且可导致胎儿生长受限、胎儿宫内窘迫及围生儿死亡,临床处理较为棘手。
3.1 重度子痫前期并发低蛋白血症的原因 本组资料中重度子痫前期患者共113例,其中并发低蛋白血症共61例,其入院时平均收缩压(164.64±18.94)mm Hg、平均舒张压(114.41±12.47)mm Hg,均高于 B组(P<0.05),本组资料中,低蛋白血症组平均发病孕周为(33.44±3.21)周,平均终止妊娠孕周为(35.62±3.84)周,均较非低蛋白血症组早,差异有统计学意义(P<0.05),提示重度子痫前期并发低蛋白血症发病时血压升高明显,发病孕周早且病情重,进展迅速,且往往需提前终止妊娠才能有效控制疾病发展。重度子痫前期的病理基础是全身小血管痉挛,动脉压升高,而全身血容量减少。重度子痫前患者肝脏血管痉挛引起肝脏血流灌注不足,肝脏功能损害加剧,清蛋白合成减少;肾血管痉挛导致肾血流量减少,肾小球基底膜受损,蛋白滤出增加,种种因素共同作用导致重度子痫前期患者易并发低蛋白血症。而低蛋白血症使血浆胶渗压下降,各器官组织血流灌注减少,加重各器官组织损害,血清清蛋白进一步降低,重度子痫前期与低蛋白血症互为因果,相互促进,加速疾病发展。
3.2 重度子痫前期并发低蛋白血症的孕产妇结局 本资料中,妊娠期糖尿病10例,A组6例,B组4例;妊娠期肝内胆汁淤积症7例,A组3例,B组4例。两组比较差异无统计学意义(P>0.05),排除了妊娠合并症对母婴结局的影响。本组资料显示A组孕妇浆膜腔积液发生率高于B组,提示重度子痫前期患者并发低蛋白血症易导致胸腔积液、腹水、心包积液等,当心脏舒张功能受到影响,肺通气功能降低,甚至可引起心肌缺血、肺水肿、心功能不全等严重并发症,A、B两组各有1例发生心功能不全,提示重度子痫前期患者发生心力衰竭不仅与低蛋白血症引起的胸、腹水有关,而且与血压升高所造成的心脏后负荷增加及心肌缺血有关。本组资料显示A组肝功能损害发生率高于B组,差异有统计学意义(P<0.05),提示重度子痫前期患者并发低蛋白血症时更易发生肝功能损害,在一定程度上清蛋白水平反映了有功能肝细胞的数量。本组资料显示A组血小板减少发生率高于B组,差异有统计学意义,因为重度子痫前期子宫底蜕膜螺旋小动脉重铸不足,造成胎盘远端毛细血管缺血、坏死,进一步发展导致远端毛细血管破裂出血,进而引起胎盘早剥,血管内皮细胞受损,缩血管物质合成增加,激活血小板、凝血因子,从而增加血小板消耗,血小板减少造成血管内溶血,产后出血,病情严重者可导致凝血功能障碍及弥漫性血管内凝血。本组资料中A组胎盘早剥、羊水过少、产后出血、子痫、肾功能损害、视网膜损害均高于B组,但差异无统计学意义,可能与期待治疗中已经补充清蛋白有关,也可能与本资料中病例数较少有关。Lala等[4]认为导致重度子痫前期患者病情进展、母婴各种并发症加剧的一个主要原因就是低蛋白血症。Takahashi等[5]认为子痫前期的患者,低蛋白血症出现的时间早于临床表现出现的时间,甚至认为低蛋白血症可作为一种有效预测子痫前期发生率的监测手段。重度子痫前期患者并发低蛋白血症时,病情重且进展快,可引起多脏器功能障碍,两者互为因果,相互促进,加速疾病发展。本研究认为对于重度子痫前期患者应加强监测低蛋白症,当低蛋白血症经积极治疗后病情无改善甚至加剧时,孕妇并发症明显增加,治愈的唯一方法仍是终止妊娠。本组113例孕妇无死亡案例,所有孕妇包括伴有合并症者及出现并发症者予以适时终止妊娠,并在多科协作治疗下痊愈出院。
3.3 重度子痫前期并发低蛋白血症的围生儿结局 本资料中,A组新生儿窒息率较B组高,差异有统计学意义(P<0.05)。A组新生儿出生体质量(2 194.92±840.07)较B组低(2 583.56±748.17),差异有统计学意义(P<0.05),与张海虹[6]报道妊娠期高血压疾病患者并发低蛋白血症者新生儿体质量明显低于非低蛋白血症组一致。A组SGA/FGR发生率较B组高,差异有统计学意义(P<0.05),与程亚楠[7]报道的重度子痫前期有较高的胎儿生长受限发生率一致。A组死胎、围生儿病死率发生率与B组相比差异无统计学意义(P>0.05),可能与A组中有2例孕龄不足28周者新生儿死亡,因孕龄不足28周未计入围生儿死亡有关,也可能与本资料样本数较少有关。重度子痫前期并发低蛋白血症时由于血浆胶渗压降低,血液浓缩、血流缓慢,使得胎盘血流量明显减少,胎盘局部微血栓形成,同时由于胎儿长期处于低蛋白血症所引起的营养缺乏及低氧环境中,从而胎儿生长受限、胎儿宫内窘迫、新生儿窒息、死胎发生率,以及围生儿病死率增加。本组资料中A组平均终止妊娠孕周明显早于非低蛋白血症组,也影响围生儿的预后及出生体质量。重度子痫前期并发低蛋白血症发病孕周早,往往合并胎儿生长受限需行期待治疗,小剂量间断使用清蛋白同时使用利尿剂有利于消肿、降压,其目的是为了延长胎龄,有利于促胎儿生长,以及肺发育成熟,从而有效降低围生儿病死率。Aoki[8]认为重度子痫前期合并严重胎儿生长受限者行期待治疗,围生儿结局有明显改善。程亚楠[7]认为重度子痫前期伴有严重并发症者围生儿病死率与无并发症者相比明显升高,所以在期待治疗过程中出现严重并发症时,及时予以终止妊娠。
综上所述,重度子痫前期并发低蛋白血症发病孕周早、病情重、母婴并发症发生率高、预后不良,血清清蛋白可作为重度子痫前期患者的重要检测指标并可用于指导治疗。低蛋白血症往往与疾病的发展密切相关,在积极治疗重度子痫前期的同时,应权衡利弊,适时终止妊娠。
[1]中华医学会妇产科学分会妊娠期高血压疾病组.妊娠期高血压疾病诊治指南(2012)版[J].中华妇产科杂志,2012,47(6):476-480.
[2]毕温哲,马飞,刘世兰,等.早发型重度子痫前期结束妊娠时间的选择及妊娠结局[J].中国医学创新,2012,9(2):124-125.
[3]马玉红,龚卫玲,郭秋燕,等.低蛋白血症对重度子痫前期妊娠结局的影响[J].临床合理用药杂志,2012,5(19):131-132.
[4]Lala PK,Chakraborty C.Factors regulating trophoblast migration and invasiveness:possible derangements con-tributing to preeclampsia and fetal injury1[J].Placenta,2003,24(6):575-587.
[5]Takahashi H,Hisano M,Sago H,et al.Hypoproteinemia in the second trimester among patients with preeclampsia prior to the onset of clinical symptoms[J].Hypertens Pregnancy,2014,33(1):55-60.
[6]张海虹.妊娠高血压综合征并发低蛋白血症对妊娠结局影响150例观察[J].上海预防医学,2009,21(4):159-160.
[7]程亚楠.204例重度子痫前期严重并发症的临床分析[J].重庆医学,2007,36(21):2201-2202.
[8]Aoki S,Toma R,Kurasawa K,et al.Expectant management of severe preeclampsia with severe fetal growth restriction in the second trimester[J].Pregnancy Hypertens,2014,4(1):81-86.
