稳定转染CD151 或CD163 的Marc145 细胞系的建立及其在PRRS疫苗生产中的应用
2015-03-18刘开武吴建英王莲芳胡小明黄海军
阮 征 ,刘开武,吴建英,华 娟,夏 瑜,王莲芳,胡小明,刘 杰,,黄海军
(1.武汉市农科院畜牧兽医科学研究所,湖北 武汉430208 ;2.武汉市重大动物疫病防控中心,湖北 武汉 430023;3.华中农业大学农业动物遗传育种与繁殖教育部重点实验室,湖北 武汉 430070)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是猪群中流行的重要传染病之一,可引起母猪的繁殖障碍(包括流产、早产、死胎、木乃伊胎等)、仔猪存活率急剧下降和育成猪呼吸道疾病。病原为猪繁殖与呼吸综合征病毒(PRRSV),该病毒为单股正链RNA病毒,属于动脉炎病毒属。PRRSV有严格的宿主和细胞嗜性,猪肺泡巨噬细胞(Porcine alveolar macrophage,PAM)、Marc145 细胞和MA-104 细胞是其重要的靶细胞,PRRSV感染细胞需要首先与细胞受体结合,通过内吞作用进人细胞内,在胞内完成病毒的脱壳与基因组释放[1-3]。
目前发现的PRRSV感染相关受体有硫酸乙酰肝素(Heparin Sulphate,HS)、唾液酸粘附素(Sialoadhesin,Sn)、波形蛋白(Vimentin)、CD163(Cluster of Differentiation 163)分子、CD151(Cluster of Differentiation 151)分子和NMMHCIIA(非肌肉肌球蛋白重链ⅡA)分子[4]。有关研究结果表明,CD151 能与PRRSV3′端非转录区(3′URT)发生结合,进而导致PRRSV与细胞发生相互作用进入细胞内产生感染。通过转染使PRRSV非敏感细胞BHK-21 表达CD151会使该细胞允许PRRSV的感染,增殖程度高达100倍[5]。CD163 为一种SRCR 超家族的Hapten Hemoglobin 清道夫受体,是130 000 的细胞表面糖蛋白,在PRRSV感染巨噬细胞过程中介导病毒在细胞质中的脱衣壳和病毒基因组的释放[6-8]。
在实际生产中,PRRSV的体外增殖主要在Marc145细胞中进行。本研究采用脂质体介导方法,通过G418 筛选稳定转染Marc145 细胞,并利用单个细胞克隆技术,获得了稳定超表达CD151蛋白和(或)CD163 蛋白的Marc145 细胞株,并进一步探讨其在疫苗生产中的应用,为最终获得PRRSV高效增殖的新途径提供依据。
1 材料与方法
1.1 质粒和细胞 去内毒素纯化质粒p IRES2-EGFP-CD151 和p IRES2-EGFP-CD163 由本实验室保存。Marc145 细胞由武汉中博生物股份有限公司提供,在本实验室传代保存。
1.2 试剂 脂质体2000 和G418,购自Invitrogen 公司;胎牛血清,购自Gibco 公司;DMEM培养基,购自清大天一公司;胰蛋白酶、PBS(PH7.4),购自北京全式金生物技术有限公司;RIPA裂解液、50*cooktail、PMSF(100 mmol/L)、磷酸化蛋白酶抑制剂、SDS-PAGE凝胶制备试剂盒、5*蛋白上样缓冲液、ECL、显影定影试剂,购自谷歌生物技术有限公司;BCA蛋白定量检测试剂盒,购自Bio-rad 公司;蛋白Marker,购自Therm(Fermentas)公司;PVDF膜(0.22 μm、0.45 μm),购自Millipore 公司;BSA,购自Roche 公司;TWEEN 20,购自Amresco 公司;actin,购自Santa cruz 公司;GAPDH,购自Epitomics 公司;CD151、CD163 抗体,购自Abcam 公司。
1.3 稳定转染细胞株的建立 待Marc145 细胞融合至70%~80%,按照Lipofectamine 2000 转染试剂盒操作说明书进行操作。转染48 h 后,开始用G418(300 μg/mL)筛选3 d,逐渐增加筛选浓度至绝大部分细胞死亡,改为800 μg/mL 维持筛选6周。将获得细胞采用极限稀释法接种于96 孔细胞培养板,交替使用常规培养基和G418(600 μg/mL)培养基培养单个细胞,至其长出单个克隆,挑选单个细胞克隆继续培养至分别建立稳定转染CD151、CD163 和CD151/CD163 共转染的细胞株。
1.4 荧光免疫细胞化学分析 分别培养未转染的Marc145 细胞和稳定转染的细胞(CD151、CD163 和CD151/CD163 共转染),制作细胞爬片,进行荧光免疫细胞化学分析。用PBS按一定比例稀释好的一抗(CD163,Rabbit,1∶50;CD151,Rabbit,1∶50)覆盖组织,4°C孵育过夜。用PBS洗涤3 次。滴加与一抗相应种属的荧光二抗(cy3 标记山羊抗兔1∶100;cy3标记山羊抗小鼠1∶100),覆盖组织,避光室温孵育50 min。滴加DAPI 染液,避光室温孵育10 min。用PBS洗涤。稍甩干后将有细胞的一面朝下用抗荧光淬灭封片剂将玻片封固在载玻片上,于倒置荧光显微镜下观察并采集图像。
1.5 Western Blot 分析 分别收集4 种细胞并提取总蛋白,将样品加入点样孔中,5%浓缩胶电泳,转膜;5%的脱脂牛奶脱色;加一抗(CD163,Rabbit,1∶1 000;CD151,Rabbit,1∶1 000;Actin,Rabbit,1∶1 000),4 ℃过夜;再加二抗(1∶3 000),室温下孵育30 min;胶片拍照。
1.6 细胞接种病毒 按照文献[12]的方法,用细胞生长液(含体积浓度为8%的小牛血清的DMEM培养基)对超表达CD151、CD163 或CD151/CD163共表达的Marc145 细胞在培养瓶中进行扩繁培养,待细胞量足够后,以0.25%胰蛋白酶消化细胞接种到转瓶,置于转瓶培养箱中继续培养,转速10 r/h。待细胞覆盖率达到80%以上,移除细胞生长液,按照0.001MOI 剂量接种PRRS病毒Ch-1R株,加入病毒维持液(含体积浓度为2%的小牛血清的DMEM),在37 ℃下继续培养。细胞病变达到80%以上时收获病毒液,随后补入不含病毒的维持液,12 h 后再收毒,反复收毒5 次。按Reed-Muench 法计算TCID50值。将收获的病毒液置于2 ℃~8 ℃备用。
1.7 疫苗制备 将上述收获的病毒液用100 kD截留分子量的超滤膜包浓缩10 倍,灭活剂与病毒液的体积比按1∶2 000 加入质量浓度为37% 甲醛溶液进行灭活后,再经凝胶层析柱Sepharose 4FF柱层析得到纯化疫苗,按抗原和油佐剂1∶1 比例加入油佐剂,乳化配制成灭活疫苗(油佐剂的配制为94%(V/V)白油、6%(V/V)的Span-80、2%(g/V)硬脂酸铝)。
1.8 疫苗效力检验 疫苗免疫接种:3 个试验组分别将疫苗按2 mL/头的剂量接种4~6 周仔猪10头,同时设对照组(非免疫10 头)。血清抗体检测:在免疫前和免疫后28 d 采集猪血清,检测对PRRS病毒中和抗体效价。攻毒保护试验:免疫后28 d,用PRRS病毒(含量为105.5TCID50/mL 的病毒液)1∶10 稀释后给每头猪肌肉接种3 mL,继续饲养观察21 d,扑杀剖检。
2 结果与分析
2.1 稳定转染细胞系的建立 在荧光显微镜下稳定转染CD151、CD163 和CD151/CD163 共转 染的细胞均表达强烈的绿色荧光蛋白(见中插彩版图1)。扩繁培养的细胞经微生物学检测合格后,在液氮中进行保藏,建立了种子细胞库和工作细胞库。
2.2 病毒受体在细胞转染前后Marc145 细胞中的表达情况 结果表明,无论是单一转染还是共转染,稳定转染后的Marc145 细胞表面红色荧光强度增加明显,预示其表达CD151 或(和)CD163 的水平明显提高(见中插彩版图2)。
2.3 Western Blot 分析病毒受体在细胞转染前后Marc145 细胞中的表达情况 利用Western Blot 检测相关细胞表面受体蛋白CD151 和CD163 的表达情况(图3)。结果显示,跟对照组(未转染组)相比,稳定转染单一受体蛋白或CD151、CD163 共转染细胞中目的蛋白表达水平均高于未转染细胞组,共转染组较单一转染组同一目的蛋白水平略低。

图3 Western blot分析结果
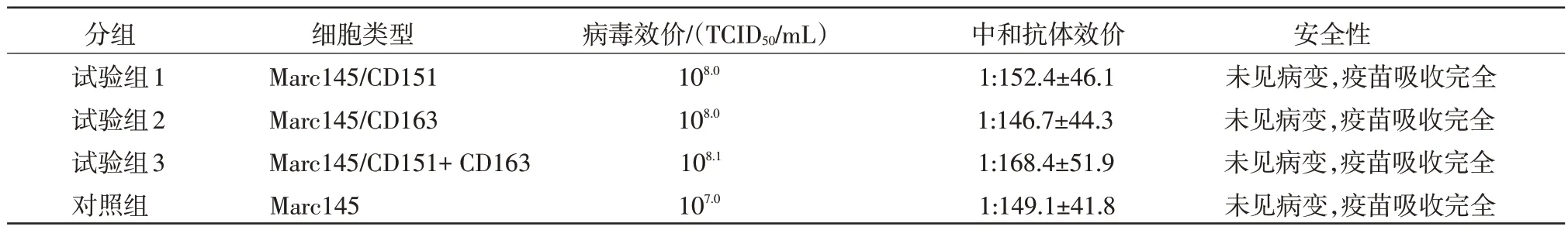
表1 疫苗效力检测结果
2.4 超表达受体蛋白的细胞制备疫苗效果分析利用超表达受体蛋白CD151 或(和)CD163 的Marc145 细胞接种PRRS病毒Ch-1R 株后,收获病毒效价可达到108.0以上,较对照组(未转染细胞组)提高10 倍以上。所制备的疫苗免疫接种动物后对PRRS病毒中和抗体效价与对照组(未转染组)水平相当。攻毒保护试验中通过剖检未见病变情况,且疫苗吸收完全,达到部颁标准(1∶16)。
3 讨论
PRRS病毒与细胞上的受体结合是实现其侵染靶细胞的先决条件。目前已经确定的PRRS病毒的细胞受体有6 种,分别是硫酸乙酰肝素(Heparin Sulphate,HS)、唾液酸粘附素(Sialoadhesin,Sn)、波形蛋白(Vimentin)、CD163(Cluster of Differentiation 163)分子、CD151(Cluster of Differentiation 151)分子和NMMHCIIA(非肌肉肌球蛋白重链ⅡA)分子。
已有多个研究小组报道,实验室条件下通过构建超表达载体提高了病毒感染的滴度,但是尚未在疫苗制备上进行验证。PRRSV非敏感细胞系BHK-21 和CRFK 在转染重组Vimentin 后接种PRRSV,发现转染Vimentin 的阳性细胞都能检测到病毒RNA,而转入半乳糖苷酶的阴性对照细胞中都检测不到病毒RNA,可见PRRSV非敏感细胞由于Vimentin 的转入获得了易感性,表明Vimentin 可以 与PRRSV的N 蛋白结 合,是PRRSV受体复合物的一部分,Vimentin 可能与PRRSV感染Marc145 细胞有关。Welch 等报道转染CD163 分子至PRRSV非敏感细胞系PK-15 中可以使此细胞获得感染PRRSV和产生子代病毒粒子的能力。通过转染使PRRSV非敏感细胞BHK-21 表达CD151 会使该细胞允许PRRSV的感染,增殖程度高达100 倍。最近有研究发现,将CD209 的基因导入BHK-21 细胞后能使BHK-21 细胞中产生的子病毒对Marc145 的感染能力增强。
本研究将CD151 和CD163 稳定转染到Marc145细胞中,并通过其感染PRRS病毒Ch-1R(Ch-1a)株,实现了病毒培养滴度的显著提高,最终在GMP 生产车间进行小规模试验,所生产的不同类型疫苗均能达到部颁标准,为下一步将该技术更好地应用到生产实践中去提供了依据。
[1]韩明远,沈青春,张志刚,等.影响猪繁殖与呼吸综合征病毒感染与增殖的因素[J].动物医学进展,2010,31(1):87-91.
[2]蒲静.PRRSV对猪肺泡巨噬细胞天然免疫功能影响的分子机制[D].北京:中国农业大学,2005.
[3]安同庆.猪繁殖与呼吸综合征与宿主细胞受体之间相互作用的研究及病毒遗传变异分析[D].北京:中国农业科学院,2007.
[4]蒋成兰,邢凤,徐云华,等.猪NMMHCⅡA基因功能区的克隆及表达特征分析[J].畜牧兽医学报,2012,43(10):1519-1524.
[5]Shanmukhappa K,Kim JK,Kapil S.Role of CD151,Atetraspanin in porcine reproductive and respiratory syndrome virus infection[J].Virol J,2007,4:62.
[6]Welch SK,Calvert JG.Abrief reviewof CD163 and its role in PRRSVinfection[J].Virus Research,2010,154(1-2):98-103.
[7]Lee Y J,Park CK,Nam E,et al.Generation of a porcine alveolar macrophage cell line for the growth of porcine reproductiveand respiratory syndrome virus[J].Journal of Virological Methods,2010,163:410-415.
[8]De Vries W,Haasnoot J,van der Velden J,et al.Increased virus replication in mammalian cells by blocking intracellular innate defense responses [J].Gene Therapy,2008,15:545-552.
[9]薛庆善.体外培养的原理与技术[M].北京:科学出版社,2001.
[10]Kim JK,Fahad AM,Shanmukhappa K,et al.Defining the cellular target(s)of porcine reproductive and respiratory syndrome virus blocking monoclonal antibody 7G10[J].JVirol,2006,80(2):689-696.
[11]王伟伟,张璐,马晓春,等.波形蛋白介导猪繁殖与呼吸综合征病毒感染Marc145 细胞作用的初步研究[J].病毒学报,2011,27(5):456-461.
[12]Calvert JG,Slade DE,Shields SL,et al.CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses[J].JVirol,2007,81(14):7371-7379.
[13]Van Gorp H,Van Breedam W,Van Doorsselaere J,et al.Identification of the CD163 protein domains involved in infection of the porcine reproductive and respiratory syndrome virus[J].JVirol,2010,84(6):3101-3105.
[14]Lee Y J,Lee C.Deletion of the cytoplasmic domain of CD163 enhances porcine reproductive and respiratory syndrome virus replication[J].Arch Virol,2010,155(8):1319-1323.
[15]Huang Y W,Dryman BA,Li W,et al.Porcine DCSIGN:molecular cloning,gene structure,tissue distribution and binding characteristics[J].Dev Comp Immunol,2009,33(4):464-480.
