多肽疫苗对猪圆环病毒2 型的免疫保护效果研究
2015-03-18刘博奇陈善真李中圣陈克宏王贵平李其昌
刘博奇 ,陈善真,李中圣,罗 均,陈克宏,王贵平,李其昌
(1.广东海大畜牧兽医研究院,广东 广州511400 ;2.华南农业大学,广东 广州 510642)
猪圆环病毒2 型(Porcine Circovirustype 2,PCV-2)是引起断奶仔猪多系统衰竭综合征的主要病原,其感染后破坏动物机体免疫系统,导致其严重的免疫抑制,进而诱发多种混合感染和继发感染,严重影响疾病的诊断和治疗,已成为世界养猪业的重要病原之一,给养猪业造成巨大的经济损失。大量的行业养殖现状和试验研究表明,疫苗注射是控制圆环病毒2 型感染的有效手段,因此国内外学者针对该病的疫苗研制展开了大量研究,并取得了显著成果。目前市售的PCV-2 商品化疫苗主要为灭活疫苗及亚单位疫苗,这两种疫苗的上市对我国防控PCV-2 感染发挥了重大作用,其优点是性能稳定、使用安全、易保存等,但同时也存在疫苗生产成本高、病毒难以培养等困难。由于PCV-2 疫苗在传统制备方法上尚存在缺陷,因此开发高效低廉的新型疫苗也逐渐被关注。近年来,越来越多的学者将注意力转移至亚单位和多肽疫苗的研究,多肽抗原作为完整病毒蛋白的一部分,其不具备传染疾病的危险性,并且可以大量合成生产,因此已成为疫苗研究开发的重要内容之一。
本试验根据已研发的非蛋白多糖多聚体定位耦联PCV-2 B、T 细胞免疫活性表位多肽作为抗原,免疫实验动物,取得了较好的免疫保护效果。同时该技术也可为其他兽用抗病毒生物制品的研发提供思路和借鉴。
1 材料与方法
1.1 主要试剂及动物 体液病毒核酸少量提取试剂盒为美国爱思进产品;多肽由上海强耀生物科技有限公司合成;市售圆环病毒2 型疫苗为德国勃林格产品;免疫佐剂为广州鼎国生物制剂产品;猪圆环病毒2 型抗体ELISA检测试剂盒,购自武汉科前动物生物制品公司;35 日龄仔猪20 头,购自广东某猪场育种管理中心;猪圆环病毒2 型由华南农业大学兽医学院张桂红教授馈赠。
1.2 耦联多肽疫苗的制备与鉴定 通过化学合成技术制备几段含有抗原表位的多肽,序列及出处分别为:PSWAVDMMRFNINDFLPPGGGSN(Cap 65-87)、QGDRGVGSTAVILDDNFVTKANALTYDPY VNYSS(Cap113-146)、SRYFTPKPVLDRTIDYFQPN NKRNQL(Cap158-183)、DHVGLGTAFENSKY(Cap 194-207)。用本项目组发明的非蛋白多聚体定位耦联B、T 细胞免疫活性表位多肽技术,制备圆环病毒2 型多肽疫苗。
1.3 试验动物分组及免疫程序 试验分为4 个组,分别为耦联多肽疫苗免疫组、市售疫苗免疫对照组、免疫佐剂对照组和空白对照组,每组5 头仔猪。耦联多肽疫苗组和免疫佐剂对照组的免疫剂量为2.0 mL/头,市售疫苗组的免疫剂量为1.0 mL/头,空白对照组不免疫。肌肉注射,分3 次免疫,首免(d1),二免(d8)和末次免疫(d23)。
1.4 血清特异性抗体检测 分别于首次免疫前(d0)、免疫后每周(d8、d15、d22、d29、d36)抽取血液1 次,用ELISA方法进行抗体检测,观察抗体产生情况,当抗体滴度趋于平稳时进行攻毒试验。
1.5 攻毒试验 于攻毒前3 天(d38)对试验动物进行免疫刺激。方法:每头猪两侧腋下及臀部肌肉注射1 mL经弗氏不完全佐剂乳化的KLH(0.5 mg/mL)、腹腔注射巯基乙酸培养基1.0 mL/头。攻毒(d41):圆环病毒培养液(106TCDI50)滴鼻1.0 mL/头并肌肉注射2.0 mL/头。攻毒后第4 天(d44)同d38 天方法进行免疫刺激处理。在攻毒后第11 天(d51)和第19天(d59),所有猪腹腔注射巯基乙酸培养基1.0 mL/头。若攻毒后出现濒死或死亡的猪,及时剖检观察其肺、腹股沟及肠系膜淋巴结变化,并分离肺脏及淋巴结,分别冰冻保存和4%中性福尔马林固定液进行组织固定;存活的猪则在攻毒后第32 天(d72)进行处死,并留取所需组织。
1.6 检测指标及数据处理
1.6.1 临床症状观察 每天观察并记录其食欲、被毛、皮肤、排便、行动及其他异常等情况,直至动物实验结束。
1.6.2 体征检测 分别于免疫当日(d1)、攻毒当日(d41)和宰杀当日(d72)称量所有猪的体重,计算各组在不同试验阶段的增重情况。于攻毒当日开始记录体温,每天上午10 点钟测定,直至体温未见明显升高,恢复平稳为止。
1.6.3 Real-time RCR 检测 分别于攻毒前3 d(d38)、攻毒后每周(d48、d55、d62、d69、)抽血一次,用Real-time RCR 方法检测攻毒后不同阶段血液内的病毒含量。于动物宰杀时(d72)取新鲜肺及淋巴结组织,检测组织中病毒含量。
1.6.4 组织病理学检查 对福尔马林固定的肺及淋巴结进行常规石蜡切片及H.E.染色,并进行读片观察。
2 结果与分析
2.1 特异性抗体检测结果 免疫前(d0)抽血检测所有样本猪圆环病毒2 型抗体均为阴性,首次免疫后1 周(d8),耦联多肽疫苗免疫组和市售疫苗免疫对照组大部分样本检测到抗体,二免后,抗体水平呈上升趋势,经过加强免疫后,第4 周(d29)抗体滴度水平达到最高,第5 周(d36)检测抗体水平趋于平稳(见图1)。
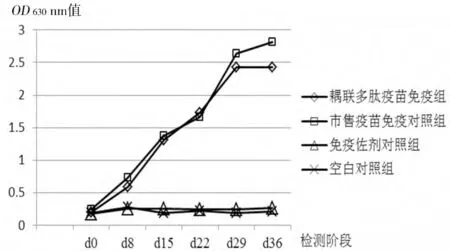
图1 不同免疫阶段特异性抗体检测结果
2.2 临床症状 4个试验动物组在免疫前及攻毒前,动物的食欲、被毛、皮肤、行动及精神状态等观察均正常。攻毒后,耦联多肽疫苗和市售疫苗两个免疫组临床观察未见明显异常;免疫佐剂对照组和空白对照组分别在攻毒后第9天和第7天出现精神委靡、被毛杂乱等,过2~3 d 开始呕吐、水便、投食前卧地不起,空白对照组在攻毒后第11 天、第12 天早上各有1 例动物便血,中午发现死亡。
2.3 攻毒前后体征变化 免疫后至攻毒前,各个组的整体增重较平均,组间未见明显差异。攻毒后至宰杀前,耦联多肽疫苗组及市售疫苗组两组的增重略有下降,但与攻毒前差别不大;而对照两组的增重则明显下降(见图2)。
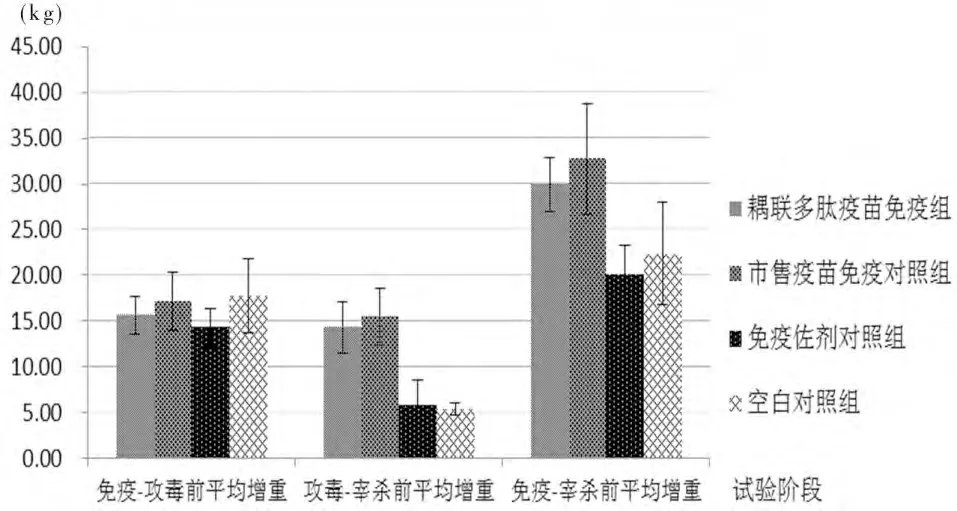
图2 不同试验阶段各组平均增重
攻毒第2 天,各组体温均有升高,但免疫佐剂对照组及空白对照组体温升高明显。至攻毒后第10 天,多肽疫苗及市售疫苗组体温趋于平稳,恢复至攻毒前水平;对照两组的体温较攻毒前仍略偏高(见图3)。
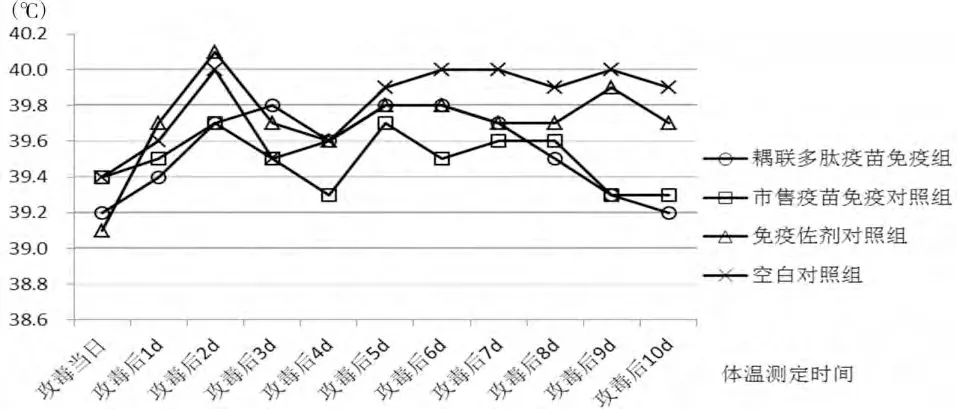
图3 攻毒后各组动物的平均体温变化趋势
2.4 Real-time PCR 检测结果 4 个组在攻毒前及攻毒后1 周、2 周的血液内均未检测出病毒,攻毒后3 周和4 周在空白对照组和免疫佐剂对照组分别检测出较高含量的病毒,而疫苗免疫两组未检测出。攻毒试验结束后,佐剂及空白对照组均在肺及淋巴结组织中检测到较高含量的病毒,而疫苗免疫两组亦未在组织中检测到病毒。
2.5 组织病理学检查结果 耦联多肽疫苗及市售疫苗免疫两组的易感组织:肺脏和淋巴结大体观察未见明显异常;组织学观察未见明显病变(见中插彩版图4A-D)。免疫佐剂及空白对照两组:大体观察见肺脏肿胀、呈灰褐色弥漫性病灶、质硬,淋巴结肿大、切面质硬;组织学观察见肺组织细胞及巨噬细胞增生、弥散性肺泡壁增厚、局灶性肉芽肿性间质肺炎(见中插彩版图7E、G);淋巴结皮质区淋巴小结排列疏松、淋巴细胞减少,副皮质区可见上皮样细胞,胞浆内见嗜酸性包涵体(见中插彩版图7F、H)。具体病理组织图片见图4。
3 讨论
本研究所用的多肽疫苗是根据PCV-2 病原体抗原基因中已知和预测的某段抗原表位的氨基酸多肽序列,耦联到大分子多糖载体上所得到的多肽。大分子量载体作用是增强其免疫效果,传统方法是应用戊二醛等连接分子法将有效抗原肽接到载体蛋白钥孔血蓝蛋白(KLH)、人血清白蛋白(HSA)、卵清蛋白(OVA)、牛血清白蛋白(BSA)及破伤风类毒素(TT)上,但是此类抗原肽-载体复合疫苗中的载体蛋白通常为异体蛋白,因此在免疫接种时容易引起炎症或过敏反应,还会影响抗原肽的特异性,因此选择一种无过敏反应的载体尤为关键。本研究所采用的载体是优选的具有可耦联基团的非蛋白多聚体,与免疫活性多肽耦联,制备成耦联多肽疫苗,试验验证其不但具有显著的免疫活性及稳定性,还避免了传统多肽-载体蛋白疫苗所引起的炎症或过敏反应等毒副作用,极大的提高了多肽疫苗的安全性和特异性,且其具有制备工艺简单、成本低、质量可靠等优点,利于规模化生产。
体液免疫效果是疫苗免疫评价重要标准之一,本试验针对PCV-2 特异性抗体进行动态检测,其结果表明,本研究制备的耦联多肽疫苗具有与市售疫苗相似的免疫效果,可以有效提高机体体液免疫能力。临床症状观察及体征检测同样可以对疫苗免疫效果做出客观评价,临床观察经多肽疫苗免疫的猪在攻毒后未见发病及死亡,增重及体温检测也说明攻毒后的多肽疫苗组动物体征与对照组变化差异明显,与攻毒前体征水平相当,表明耦联多肽疫苗临床免疫具有良好的保护效果。
猪感染PCV-2 后,不但可以通过胎盘进行垂直传播,还可经鼻液和粪便进行水平传播,该病毒对环境理化因子抵抗力极强,在酸性及高温环境下同样可以存活一定时间。因此,有效减少排毒量,减短带毒血症时间,是评价PCV-2 疫苗的重要标准之一。本试验通过检测攻毒后不同阶段的各组动物血液内病毒含量,表明经多肽疫苗免疫的猪能够有效抑制病毒血症的发生。同时,病毒可存在于机体多个器官,并导致相应器官的功能异常,其中淋巴结和肺脏是PCV-2 病毒复制的重要的器官,感染后不但可以造成呼吸功能障碍,更重要的是可以引起机体免疫抑制,为其他病原的感染提供途径,因此,高效PCV-2 疫苗应该具有有效减少淋巴结、肺脏等病毒靶器官内病毒滴度的能力。本试验在耦联多肽疫苗免疫组的淋巴结及肺脏组织样本中未检测出病毒,表明该多肽疫苗具有良好的阻断病毒感染靶器官的能力。病理学观察结果同样表明,实验动物免疫该耦联多肽疫苗后,与对照组相比较,淋巴结和肺脏未出现病理变化,再次说明,本研究所用耦联多肽疫苗可以有效抑制PCV-2 病毒在靶器官内的复制,并减少病毒所致的病理变化,避免机体出现免疫抑制、呼吸功能障碍等临床症状。
综上所述,本研究结果表明,PCV-2 耦联多肽疫苗具有较好的免疫效果及保护率。作为一种候选新型疫苗,其独特的优点能为企业和市场带来新的经济增长点与竞争力,市场空间巨大。同时该疫苗的研制方法也可为其他相关疾病疫苗的研制提供重要的理论基础和技术支持,对我国动物疫苗的研发具有重要的现实意义。
[1]王一平,郭龙军,刘长明,等.猪圆环病毒2 型疫苗的研究进展[J].畜牧兽医学报,2012,43(9):1337-1345.
[2]马萍,汤德元.猪圆环病毒基因及其疫苗的研究进展[J].猪群保健,2009,2:76-80.
[3]邓秋红,郑杰,张锋,等.国内商品化猪圆环病毒疫苗的现状及展望[J].中国兽药杂志,2014,48(2):67-69.
[4]王建龙,赵路易,宋长绪.猪圆环病毒2 型DNA疫苗对小鼠的免疫效果[J].西北农林科技大学学报(自然科学版),2008,36(4):53-57.
[5]李其昌,拓荒,王贵平,等.一种表达多肽疫苗及其制备方法:中国,ZL201110217706.X[P].2013-03-13.
[6]张宁,李茂宁,黄伟坚,等.猪圆环病毒2 型ORF2 截短基因片段真核表达载体的构建及其DNA疫苗的免疫效果[J].中国兽医科学,2009,39(04):327-332.
[7]章勇.猪圆环疫苗响6 元惊雷是噱头还是战斗[J].中国畜牧兽医报(动物保健),2014,7 月27 日第003 版.
[8]兰晓葳,张海燕,马海利.猪圆环病毒病[J].畜牧兽医科技信息,2005,11:39-40.
[9]郎洪武,陈晓春,杨汉春,等.猪圆环病毒病及其生物制品学的研究进展[J].中国兽医科学,2012,42(05):545-550.
[10]尹业师,黄伟坚,陈琼,等.猪圆环病毒感染的病理组织学和致病机理研究进展[J].动物医学进展,2006,27(11):18-21.
