猪苓多糖诱导M2 亚型巨噬细胞向M1 巨噬细胞转化①
2015-03-18江泽波李思明胡金萍
江泽波 赵 晋 李思明 胡金萍 曾 星
(广州中医药大学第二附属医院,广州 510006)
多糖可活化机体免疫细胞,调节白介素及肿瘤坏死因子等细胞因子分泌,在机体抗肿瘤免疫调节等方面备受关注[1,2],是目前常用的免疫调节剂。近期相关研究表明,猪苓多糖可以通过TLR4 信号通路活化巨噬细胞,刺激TNF-α、IL-1β 等炎症因子分泌,并提高膀胱癌大鼠腹腔巨噬细胞CD86、CD40的阳性表达率[3-5],但其对肿瘤相关巨噬细胞作用机制尚未明确。而肿瘤相关巨噬细胞类似于M2 亚型巨噬细胞,两者均具有抗炎、降低肿瘤杀伤来保护机体[6-8]。本文借助肿瘤相关的M2 亚型巨噬细胞模型,观察猪苓多糖对M2 亚型巨噬细胞膜表面分子和相关炎症因子的作用,探讨猪苓多糖启动巨噬细胞可能的机制。
1 材料与方法
1.1 材料 小鼠巨噬细胞系RAW264.7 为广东省中医院中心实验室提供。含丙酮酸钠的高糖DMEM培养基、双抗(Gibco)、胎牛血清(FBS)购于Hyclone 公司,TRIZOL 试剂购于Invitrogen 公司、逆转录试剂盒(Thermo)、荧光定量PCR 试剂盒(罗氏);流式抗体:CD16/32-FITC(ABCCM),CD40-PECY5,大鼠IGg-FITC(eBiscience),Rat IgG2a K Isotype Control PE-Cy5(eBioscience),Rat IgG2a K Isotype Control RPE(ABCAN,USA)Rat IgG2a K Isotype Control FITC(eBioscience),异丙醇、无水乙醇、氯仿(广州化学试剂厂),IL-4(Peprotech,USA);流式抗体CD23-PECY5,CD206-RPE(ABCAN,USA)。
1.2 方法
1.2.1 细胞培养 小鼠巨噬细胞株RAW264.7 用含100 ml/L 胎牛血清、100 U/ml 青霉素和100 μg/ml 氯霉素的高糖DMEM 培养基37℃,50 ml/L CO2培养。实验分为:空白对照组,IL-4 诱导的M2 亚型巨噬细胞,IL-4 +猪苓多糖低、中、高剂量组,猪苓多糖剂量分别为终浓度分别为50、100、200 μg/ml 的PPS 处理。
1.2.2 IL-4 诱导巨噬细胞株RAW264.7 为M2 亚型巨噬细胞及其检测 M2 亚型巨噬细胞模型的构建,根据文献[9]研究,给予终浓度为20 ng/ml 的细胞因子IL-4 诱导巨噬细胞株RAW264.7 极化为替代活化形式的M2 模式的巨噬细胞亚型。诱导24 h,然后收集细胞上清,PBS 洗涤巨噬细胞,消化调整数于流式管当中,加入2 ml 的PBS 洗涤细胞2 次,离心去掉上清,加入PBS 200 μl 重悬细胞,然后加入相应的抗体CD23-PECY5、CD206-RPE 和CD16/32-FITC 各1 μl,对应的同型作为阴性对照。4℃避光孵育30 min,然后PBS 离心去除游离的流式抗体,500 μl PBS 重悬细胞,于流式细胞仪中检测相关膜表面分子的阳性表达率,膜表面分子蛋白特异性验证M2 亚型巨噬细胞的极化成功。同时TRIZOL收集巨噬细胞,以qRT-PCR 检测ARG1、IL-10、TGFβ、iNOSmRNA 的相对表达量,进一步验证M2 亚型的构建成功。
1.2.3 猪苓多糖对M2 亚型巨噬细胞膜分子的影响 诱导小鼠巨噬细胞株RAW264.7 为M2亚型巨噬细胞后,给予相应的不同浓度的猪苓多糖溶液干预24 小时,收集细胞,PBS 洗涤细胞2次,调整细胞浓度,加入相应的流式抗体CD16/32、CD206、CD40 各1 μl,避光孵育30 min,然后加入PBS 洗去游离的流式抗体,加入500 μl 的PBS 溶液重悬细胞,用流式细胞仪检测细胞的膜分子的表达量。
1.2.4 qRT-PCR 检测猪苓多糖对M2 亚型巨噬细胞细胞因子mRNA 的影响 IL-4 刺激24 h 的巨噬细胞去上清,加入相应的药物进行干预24 h,然后每孔加入1 ml 的TRIZOL 反复吹打,收集细胞于无酶的1.5 ml 的EP 管当中,-80℃保存或者继续提取总RNA。按照试剂说明提取总RNA,然后用紫外分光光度计检测RNA 浓度和纯度,按1 μg 的总RNA逆转录合成cDNA,以cDNA 为模板进行扩增iNOS,IL-1β,IL-10,TNF-α mRNA 的基因编码片段。基因引物序列分别为 mus-GAPDH Forward-5'-GTTTTCAG-GGATGAAGCGGC-3',Reverse-5'-TGGGATAGGGCC-TCTCTTGC-3';IL-10Forward-5'-TACTCGGCAAACC-TAGTGCG-3',Reverse-5'-GTGTCCCAACATTCATAT-TGTCAGT-3';IL-1β Forward-5'-TGGGATAGGGCC-TCTCTTGC-3',Reverse-5'-CCATGGAATCCGTGTC-TTCCT-3';TNF-ɑ Forward-5'-GTGTCCCAACATTCA-TATTGTCAGT-3',Reverse-5'-TGGGAAGAGAAACC-AGGGAGA-3';iNOS Forward-5'-TGAGTTCCGAAGCAAGCCAA-3',Reverse-5'-AGACCTCAACAGAGCC-CTCA-3',ARG1 Forward-5'-TACAAGACAGGGCTCCTTTCAG-3',Reverse-5'-TGAGTTCCGAAGCAAGC-CAA-3'。按照实时荧光定量PCR(Real-time PCR)试剂盒的说明:2 × SYBR Green 10 μl、上下游引物终浓度0.4 μmol/L、cDNA模板10 μl、DEPC 水12 μl,反应总体系为20 μl。按照扩增试剂盒的程序:欲变性95℃10 min,变性95℃15 s,60℃34 s 退火,45 个循环。以GAPDH 作为内参,采用2-ΔΔCT法计算相对基因的表达量。
1.3 统计学分析 应用SPSS17.0 统计软件,采用单因素方差分析对实验数据进行处理,以P <0.05值为差异有显著性。
2 结果
2.1 IL-4 诱导巨噬细胞极化为M2 鉴定指标 实验结果如表1、图1 所示,给予IL-4 诱导24 h 后,和未刺激的RAW64.7 比较,CD16/32 表达水平略高,但和空白对照组比较,差异无统计学意义(P >0.05);而CD206分子表达显著增高(P <0.05),提示IL-4 诱导M2 亚型巨噬细胞成功。

表1 IL-4 诱导RAW64.7 极化为M2 亚型膜分子表达的情况(n=3,%)Tab.1 Expression of membrane surface molecules on IL-4-induced M2 macrophages(n=3,%)
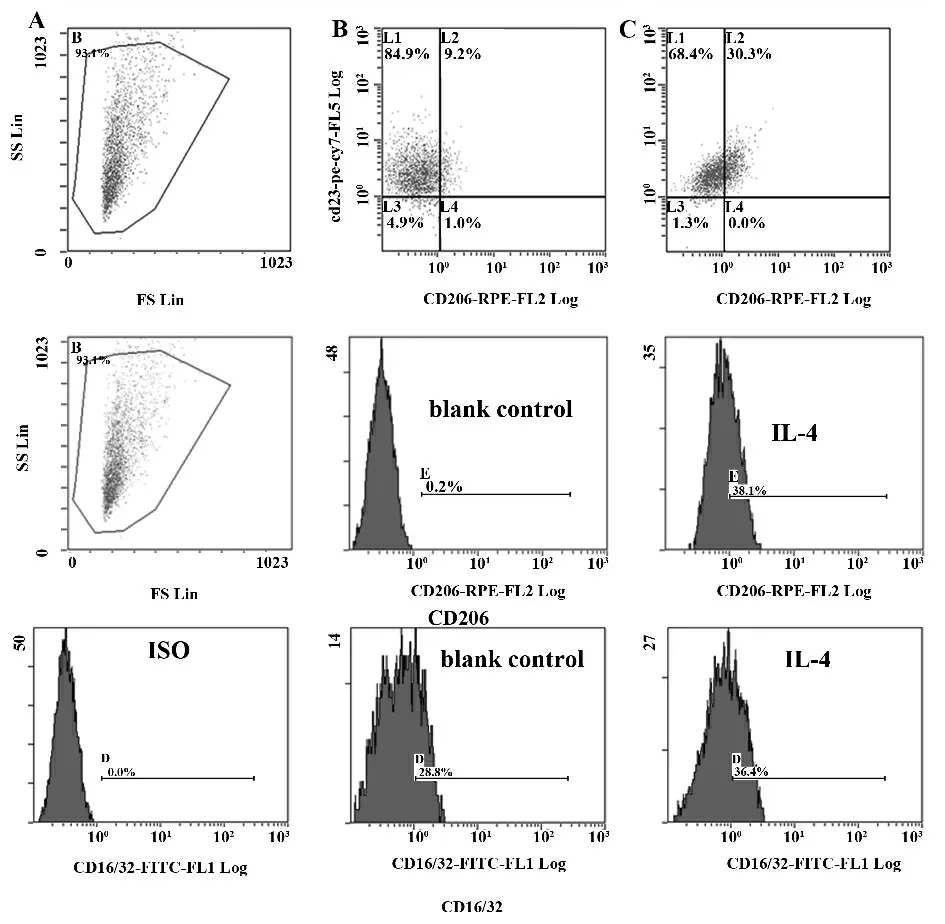
图1 IL-4 诱导的M2 亚型巨噬细胞膜表面分子CD206 和CD16/32 的阳性表达率Fig.1 Expression of CD206 and CD16/32 on IL-4-induced M2 macrophages
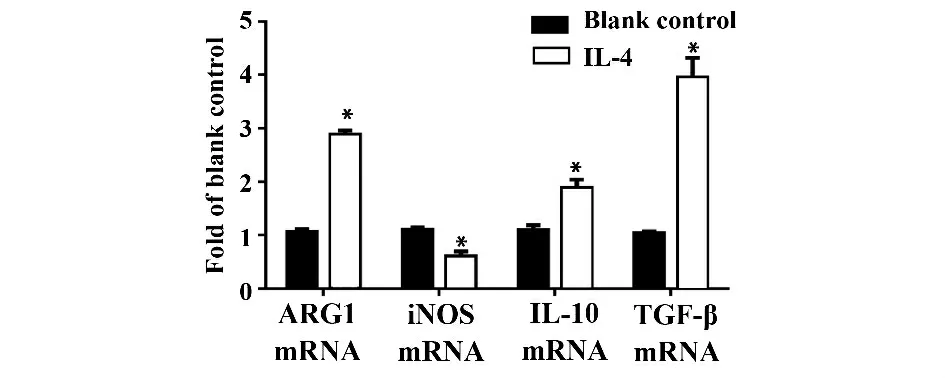
图2 IL-4 诱导的M2 亚型巨噬细胞mRNA 表达量Fig.2 Expression of mRNA on IL-4-induced M2 macrophages

表2 猪苓多糖对M2 亚型巨噬细胞膜分子表达的影响(n=3,%)Tab.2 Expression of membrane surface molecules of PPS on IL-4-induced M2 macrophages(n=3,%)

表3 猪苓多糖对IL-4 诱导的模型细胞因子mRNA 的影响(n=3)Tab.3 Expression of mRNA of PPS on IL-4-induced M2 macrophages(n=3)
2.2 qRT-PCR 鉴定IL-4 诱导巨噬细胞极化为M2亚型巨噬细胞 如图2 所示,给予IL-4 诱导巨噬细胞24 h 后,和空白对照组比较,ARG1 mRNA 的表达量明显升高[(2.88±0.08)倍,P <0.01)],IL-10 mRNA 的相对表达量升高了(1.89±0.15)倍,(P <0.01),TGF-β mRNA 的相对表达量升高了(3.95±0.37)倍,iNOS 减低到(0.605±0.09),和空白对照组比较,差异均具有统计学意义(P <0.01)。
2.3 猪苓多糖对M2 亚型巨噬细胞膜分子的影响给予猪苓多糖干预后,CD206 的表达量降低,CD16/32、CD40 的表达量升高,剂量依赖性明显,和模型组比较,差异具有统计学意义(P <0.01),详见表2。
2.4 猪苓多糖对M2 亚型巨噬细胞模型细胞因子mRNA 的影响 从表3 可知:巨噬细胞模型予猪苓多糖干预后,相应的炎症因子TNF-α、IL-1βmRNA的表达量升高,特异性M1 指标iNOS mRNA 呈现相似的趋势,两者与模型组比较,差异具有统计学意义(P <0.01);IL-10 的表达量随着猪苓多糖剂量的升高而呈正相关趋势。综上可推测猪苓多糖通过提高炎症因子的相对表达量来调节M2 亚型巨噬细胞生物活性。
3 讨论
巨噬细胞是一种具有可塑性和多能性的细胞群体[10],体内外局部微环境的不同直接影响巨噬细胞的分化和功能差异[11,12],目前主要极化两种亚型:经典M1 亚型(Classical activated macrophage)和替代M2 亚型(Alternative activated macrophage),其中M1 亚型主要以抗肿瘤和增强免疫为主,M2 亚型则具有抗炎和介导肿瘤免疫逃逸作用。肿瘤微环境倾向于诱导巨噬细胞向M2 优势活化,作为肿瘤组织中数量最多的抗原提呈细胞,M2 亚型巨噬细胞仅有较弱的抗原提呈能力,高表达CD23、CD206 等膜表面分子,并通过分泌抑制性细胞因子IL-10、TGFβ 等下调免疫应答,降低炎症因子过表达对机体的损害[13,14]。在体外培养条件下,通过Th2 型细胞因子(如IL-4、IL-13 等)可诱导产生M2 亚型巨噬细胞[9],并与体内极化的巨噬细胞具有高度相似的表型和功能,这也是目前研究巨噬细胞异质性的重要手段。
本研究采用经典的Th2 型细胞因子IL-4 诱导RAW264.7 巨噬细胞株24 h,极化后的巨噬细胞高表达M2 特异性的标志物ARG1,表明IL-4 诱导M2亚型巨噬细胞有效可行。造模成功后给予不同剂量的猪苓多糖干预,IL-10 等抑制性炎症因子表达升高,并与浓度呈正相关,且M1 型巨噬细胞特异性的指标iNOSmRNA 同时明显升高,结合既往文献报道,可知猪苓多糖,尤其是高剂量猪苓多糖可促进巨噬细胞由M2 亚型转换M1 亚型,起保护机体作用。随后采用流式细胞术检测了猪苓多糖干预细胞模型后的M1/M2 特异性的膜分子蛋白指标,可见M2 特异性指标CD206 表达率降低,而CD16/32、CD40 等M1 特异性指标反而升高,提示猪苓多糖可活化巨噬细胞由M2 亚型逆转为M1 亚型,体现了人体免疫动态平衡的可控性,同时与机体免疫调节动态变化的连续过程相切合。结合qRT-PCR 检测结果,发现猪苓多糖可以增加IL-1β,TNF-α 等相应炎症因子水平,并提高M1 膜表面分子CD16/32、CD40 表达量,进一步验证了猪苓多糖通过TLR4 途径活化巨噬细胞的同时,可能通过过活化CD14 信号通路起作用。
综上所述,猪苓多糖可有效活化巨噬细胞,起机体免疫调节,抗肿瘤作用。此外,猪苓多糖在抗热休克蛋白过程中可增加抑制性细胞因子IL-10 的分泌而起减轻炎症的作用,除外TLR4 途径及CD14 信号通路,猪苓多糖是否可通过影响IL-10 相关通路来活化巨噬细胞,尚待后续实验进一步验证。
[1]戴 慧,高晓明.多糖特异性免疫识别的分子机制及其免疫生物学意义[J].中国免疫学杂志,2009,25(1):35-39.
[2]刘洪超,蔡林衡,王淑英.猪苓多糖抗肿瘤机制研究进展[J].河南科技大学学报(医学版),2011,29(3):236-238.
[3]李彩霞,曾 星,黄 羽,等.猪苓及猪苓多糖对BBN 诱导的膀胱癌大鼠胸腺、脾指数及CD86 表达的影响[J].免疫学杂志,2012,7(2):116-119.
[4]李心群,许 文.猪苓多糖通过Toll 样受体4 对小鼠骨髓来源树突状细胞作用研究[J].中草药,2011,42(1):118-123.
[5]Li X,Xu W.TLR4-mediated activation of macrophages by the polysaccharide fraction from Polyporus umbellatus,(pers.)Fries[J].J Ethnopharmacol,2011,135(1):1-6.
[6]Buttari B,Segoni L,Profumo E,et al.7-Oxo-cholesterol potentiates pro-inflammatory signaling in human M1 and M2 macrophages[J].Biochem Pharmacol,2013,86(1):130-137.
[7]Davis MJ,Tsang TM,Qiu Y,et al.Macrophage M1/M2 polarization dynamically adapts to changes in cytokine microenvironments in Cryptococcus neoformans infection[J].MBio,2013,4 (3):e213-e264.
[8]曹春雨,王 清,王艳林.肿瘤相关巨噬细胞极化的研究进展[J].生命科学,2013,25(11):1105-1108.
[9]Sica A,Invernizzi P,Mantovani A.Macrophage plasticity and polarization in liver homeostasis and pathology[J].Hepatology,2013,59(5):2034-3042.
[10]尹华华,朱京慈,李 磊.巨噬细胞的异质性[J].细胞与分子免疫学杂志,2004,20(4):510-512.
[11]Tugal D,Liao X,Jain MK.Transcriptional control of macrophage polarization[J].Arterioscler Thromb Vasc Biol,2013,33(6):1135-1144.
[12]Goswami KK,Barik S,Sarkar M,et al.Targeting STAT3 phosphorylation by neem leaf glycoprotein prevents immune evasion exerted by supraglottic laryngeal tumor induced M2 macrophages[J].Mol Immunol,2014,59(2):119-127.
[13]陈新涛,秦建军.肿瘤相关巨噬细胞的起源和表型特征的研究进展[J].医学综述,2013,15:20.
[14]Nam SJ,Go H,Paik JH,et al.An increase of M2 macrophages predicts poor prognosis in patients with diffuse large B-cell lymphoma treated with rituximab,cyclophosphamide,doxorubicin,vincristine and prednisone[J].Leuk Lymphoma,2014,3(3):1-11.
