白·红花生衣多酚物质含量分析方法及提取技术优化
2015-03-18裴云逸
裴云逸
(玉溪农业职业技术学院,云南玉溪653106)
花生为人们的日常食品,也是保健食品。花生衣最常见为呈粉白色和红褐色2种,一般称白皮和红皮。花生衣中含有多种具有生理活性的多酚类物质,对此方面近年来研究较多,主要包括花生衣红色素、原花青素的提取,花生衣色素的抗氧化性研究,关于花生衣多酚组成的报道[1-2],关于通过HPLC-MS技术分离鉴定出花生衣原花青素二聚体和三聚体的报道[3-4],以及有关花生衣原花青素更详细的报道[5],如每100 g花生皮含儿茶素约16.1mg,原花青素二聚体约111.3 mg,三聚体约 221.3 mg,四聚体约 296.1 mg,而关于花生衣多酚的主要成分分析报道很少。
超声辅助提取与微波辅助提取是对植物多酚类物质提取研究较早的2种技术[6-7],这2种提取方法具有省时、高效、节约溶剂等特点。超声辅助提取主要利用了超声波的机械振动作用和空化作用促使有效成分进入溶剂中;微波辅助提取主要利用微波的热效应使细胞内产生急剧压力而破裂,有效成分溢出,同时微波的电磁效应加剧了植物细胞内分子运动,也有助于有效成分的浸出[8]。
笔者对2种辅助提取方法进行对比,并就微波辅助提取采用相同功率辐射法,使得微波辅助提取以控制物料最终温度为基本方法。植物多酚物质含量测定多采用福林酚比色法(Folin-ciocaheu法)或酒石酸铁法,以没食子酸为对照。二者均用于测定具有不同光谱特征的黄酮类化合物的总含量。试验根据花生衣多酚的光谱特征,采用了紫外法,使得花生衣多酚的测定简洁化。
1 材料与方法
1.1 材料
1.1.1 供试原料与试剂。红、白衣花生,玉溪本地农贸市场购买;儿茶素对照品,HPLC≥98%,上海金穗生物科技有限公司;原花青素对照品,HPLC≥98%,上海金穗生物科技有限公司;无水乙醇,优级纯,天津市凤船化学试剂科技有限公司;盐酸,优级纯,广东西陇化工有限公司;超纯水,玉溪农业职业技术学院实验室自制。
1.1.2 主要仪器设备。超声波清洗器,DS-3510 DTH,上海生析超声仪器有限公司;家用微波炉,G80F20,广东格兰仕微波炉电器制造有限公司;紫外可见分光光度计,UV2550,岛津仪器(苏州有限公司);电子天平,BT124S、BT2202S,北京赛多利斯仪器有限公司;可调温电热套,SXKW,北京永光明医药仪器厂;家用多功能料理机,CX-301,中山市九阳小家电有限公司。
1.2 方法
1.2.1 原料处理。秋后收新花生去壳后即可剥皮。干花生仁用少量水喷潮湿,手工剥皮,剥好的花生皮自然晾干后,用家用料理机粉碎,备用。
1.2.2 试验方法。通过对比红、白花生衣多酚物质与原花青素对照品、儿茶素对照品的光谱吸收图像,结合黄酮类化合物的光谱吸收图像特征,确定花生衣多酚物质以原花青素和儿茶素等单体为主。因此采用以原花青素和儿茶素系列溶液在280 nm下吸收值建立标准曲线为对照的紫外法来分析所提取多酚物质含量。采用单因素试验优化超声辅助提取和微波辅助提取条件,比较超声辅助、微波辅助及振荡三者提取的效果。
1.2.3 花生衣多酚物质紫外可见光谱特征分析。称取0.05~0.08 g花生衣粉,用100ml60%的乙醇溶液常温超声辅助提取20 min,过滤,滤液经紫外可见分光光度计UV-2550于190~800 nm进行光谱扫描。同时将原花青素与儿茶素的对照品用无水乙醇配制成浓度为0.01~0.30 mg/ml的溶液(该试验采用制作原花青素和儿茶素对照品标准曲线的系列溶液),同法进行光谱扫描。
1.2.4 花生衣多酚物质含量分析方法。试验根据花生衣多酚物质、原花青素和儿茶素均在280 nm处的紫外吸收特征,测定多酚物质在这一波长下的吸收值,再以原花青素或儿茶素标准曲线为对照,计算含量。原花青素和儿茶素标准曲线以下列方法制作:取原花青素或儿茶素对照品20mg,用无水乙醇配成1 mg/ml的标准储备液20 ml,分别取储备液0.1、0.5、1.0、1.5、2.0、2.5、3.0、4.0ml于10ml容量瓶中,再用无水乙醇稀释至 10 ml,即为 0.01、0.05、0.10、0.15、0.20、0.30、0.40mg/ml的标准系列,测定各标准系列在280 nm下的吸收值,制作原花青素或儿茶素吸收标准曲线。
1.2.5 超声辅助提取与微波辅助提取条件及优化。由于花生衣中原花青素等多酚物质热稳定性较差,微波提取主要利用微波的热特性,所以采用家用微波炉在大剂量溶剂下提取,以防提取剂升温过高迅速蒸发或沸腾从容器溢出。微波辅助与超声辅助提取均采用80ml溶剂提取。
1.2.5.1 提取剂选择。据诸多报道,当以乙醇为提取剂时60%乙醇效果较好[9-11],所以该试验采用60%乙醇为提取剂。
1.2.5.2 超声时间的影响。每次试验均准确称取0.080 00 g花生衣粉,用80 ml 60%乙醇在45℃水浴温度下浸泡10 min,再在此水浴温度下超声辅助提取不同时间,冷却到室温后定容至100ml,过滤,测定吸收值。再以50℃水浴温度同法试验。
1.2.5.3 超声温度的影响。选择白、红2种花生衣粉试验,每组试验以不同水浴温度超声辅助提取25 min,其余同“1.2.5.2”。
1.2.5.4 相同功率下微波时间或温度的影响。将6份0.080 00 g花生衣粉分别用80 ml 60%的乙醇常温下浸泡35min,在 100%功率(700 W)下提取 20、30、35、40、45、50 s,每次测定物料最终温度,冷却后定容至100 ml,过滤,测吸收值。
1.2.5.5 不同微波功率、相同微波辐射能量[以P(%)×t(s)表示]下提取效果比较。根据微波加热原理,在微波电磁场下物料被加热是因为物料吸收微波能(W=Pt),由此设计在相同微波辐射能量下的提取试验。根据“1.2.5.4”的试验结果得出的最佳物料最终温度,依次设计在100% ~20%微波功率下的试验,每次试验记下物料最终温度。
1.2.5.6 微波辅助一次提取与二次提取比较。分别以100%和80%的微波功率在相同微波辐射能量下比较一次提取与二次提取的效果,其中二次提取是在一次提取冷却到室温后再进行。
1.2.5.7 超声辅助、微波辅助与振荡提取效果比较。对同一批花生衣粉分别用80 ml 60%的乙醇按照以下超声、微波及振荡条件提取。
超声辅助提取:将0.080 00 g花生衣粉用80 ml 60%乙醇在55℃下超声提取25 min。冷却后定容,过滤,测吸收值,以儿茶素和原花青素对照曲线计算含量。
微波辅助提取:将0.080 00 g花生衣粉用80 ml 60%乙醇在室温(当时冬天室温10℃左右)下浸泡35 min,再分别以100%微波/35 s、80%微波/44 s、微波60%/58 s提取,冷却至室温后再以同样方法进行二次提取,其他处理同超声辅助提取。
振荡提取:将0.080 00 g花生衣粉用55~60℃的80 ml 60%乙醇浸泡10min,再振荡提取25min,其他处理同超声辅助提取。
2 结果与分析
2.1 花生衣多酚物质光谱特性分析及含量分析方法确立从白、红2种花生衣多酚物质紫外、可见光谱图像特征,可以说明白、红花生衣多酚物质以原花青素及儿茶素等单体为主。首先,比较白、红2种花生衣多酚物质与原花青素、儿茶素溶液的紫外光谱图像(图1),通过对吸收峰的选点检测分析,白花生衣多酚物质的光谱图像与儿茶素的光谱图像的最大吸收峰很相似,分别在212和216 nm处出现最强吸收峰;红花生衣多酚物质的光谱图像与原花青素的光谱图像的最大吸收峰很相似,分别在202和206 nm处出现最强吸收峰,而它们都在280 nm处出现特征吸收峰。其次,从2种花生衣多酚物质光谱图像看不出有较明显的芦丁、桷皮素等其他黄酮类化合物的光谱特征,同时它们的光谱图像与没食子酸的光谱图像也仅有280 nm处特征吸收峰的相同之处,而最大吸收峰完全不同[12-14]。张姣勤通过对几个品种花生衣多酚物质的色谱分离图像研究初步表明,花生衣多酚物质含大量的儿茶素和表儿茶素,此外含有少量酚酸类,以及微量桷皮素、芦丁等,还有一种色谱峰最高的被推断为原花青素[15],这与笔者通过紫外可见光谱分析研究结果基本一致。说明花生衣多酚物质中主要含原花青素及儿茶素等单体,所以计算白、红花生衣多酚物质的含量,可以以原花青素或儿茶素的280 nm吸收值为对照,通过标准曲线来计算含量。
2.2 花生衣多酚的超声辅助提取条件选择 由图2可知,当超声辅助提取时间25 min时,2次试验吸收值均最高,之后有所降低,因此选择超声辅助提取时间为25 min。由图3可知,对于白、红2种花生衣粉,当超声辅助的提取温度为55℃时吸收值最高。由此可以确定超声辅助提取花生衣多酚物质在55℃下提取25 min效果最好。
2.3 花生衣多酚物质的微波辅助提取试验结果 由图4~5以及表1~3可以得出:相同微波功率下,微波时间与物料最终温度呈线性关系,由此可采用微波时间控制最终温度。不同微波功率下,以相同微波辐射能量,即P(%)×t(s)值来控制提取温度。当微波辅助提取温度控制在60~68℃时,提取效果最为理想。
当微波功率大于30%时,以相同的微波辐射能量,即相同P(%)×t(s)值下提取同体积物料时,提取效果基本相同。物料最终温度仅有微小差异,主要是由容器(该试验使用100 ml烧杯)重量的差异所致容器吸热不同而热量损失不同引起。如果在平行试验中让提取容器的类型、体积和重量尽可能一致,温度的差异将很小;当微波功率小于或等于30%时,物料最终温度明显低于前者,热效应降低,提取效果也减弱,可见微波辅助提取主要是其热效应的作用。
微波辅助提取时间除与微波功率有关外,还与实验室室温有关,在不同室温下,物料的初始温度不同,通过微波加热到最佳提取温度范围需要的时间不同,具体需要通过试验来确定。
微波辅助二次提取比一次提取测得的含量高0.44%,所以应采用微波辅助二次提取较为理想。
2.4 花生衣多酚物质超声辅助提取、微波辅助提取及振荡提取的比较 试验比较结果见表4,用3种方法提取的效果有所差异,其中超声辅助提取和微波辅助提取的效果均比振荡提取要好。以儿茶素为对照时超声辅助提取比微波辅助提取高1.26%,微波辅助提取比振荡提取高0.12%,以原花青素为对照时超声辅助提取比微波辅助提取高0.95%,微波辅助提取比振荡提取高0.25%。同时以儿茶素为标准测得多酚物质含量比以原花青素为标准测得含量要高。试验采用微波辅助提取并以儿茶素为对照测得花生衣多酚物质含量与邬建国等以及张姣勤采用微波辅助提取,福林酚法测得结果基本一致[15-16]。而用3种方法提取并以儿茶素为对照时测得含量均比吴克刚等采用一定浓度的乙醇直接提取,并用福林酚法要高一些[17]。
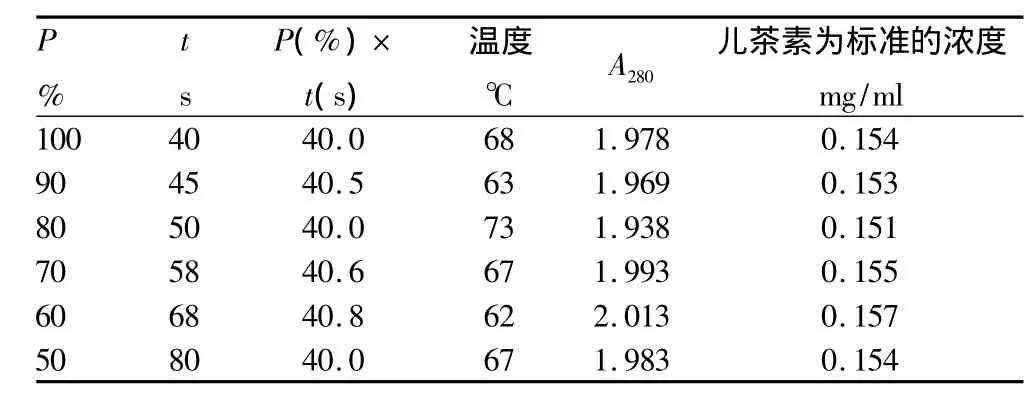
表1 相同微波辐射能量下以不同微波功率提取白花生衣多酚物质的效果
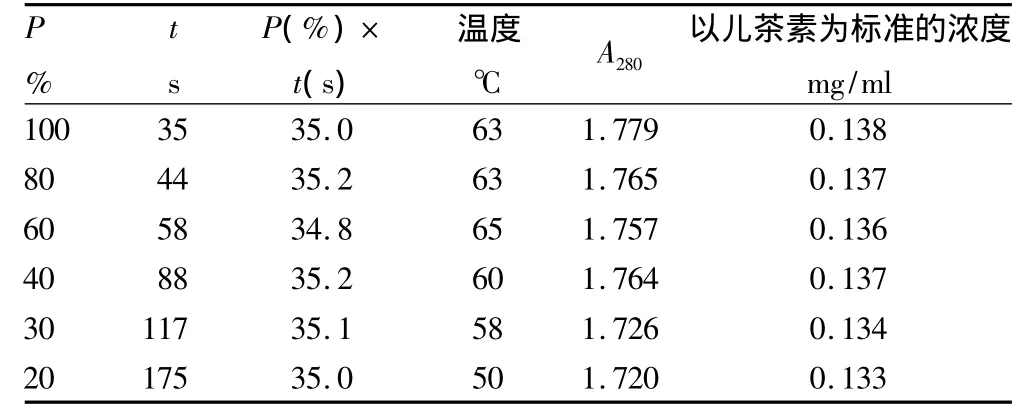
表2 相同微波辐射能量下以不同微波功率提取红花生衣多酚物质的效果
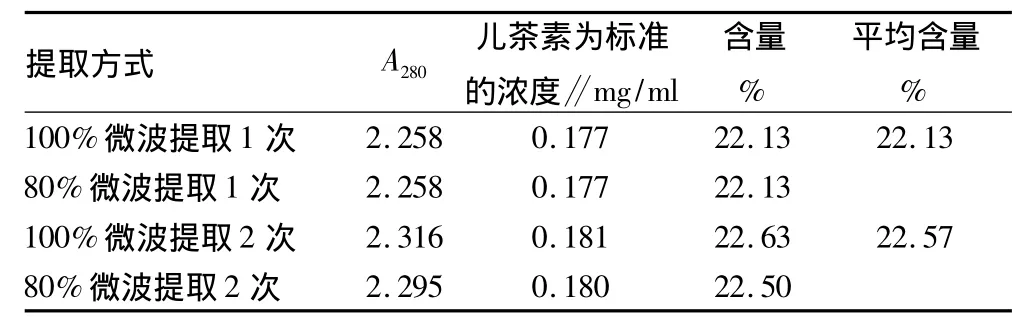
表3 微波辅助提取次数对白花生衣多酚物质提取效果影响

表4 红花生衣多酚物质的超声辅助、微波辅助及振荡提取效果比较
3 结论与讨论
花生衣多酚物质的超声辅助和微波辅助提取都是理想的提取方法,二者各有优缺点。超声辅助提取操作过程较为复杂,比如,需要将超声水浴加热到指定温度再倒入提取器中,还需要可控温超声提取器来控温,同时也要将提取剂加热到提取温度再倒入容量瓶中,所有这些工作耗时而繁琐。微波辅助提取在室温下开始,在不到1min的时间即可完成,简单而省时,但微波二次提取需要在一次提取后冷却到室温,再进行第二次提取;微波辅助提取采用相同微波辐射能量法,在不同微波功率下以微波时间控制提取液最终温度,达到相同提取效果。花生衣多酚物质含量分析采用紫外法符合其光谱吸收特征,结果可靠。
[1]张秀尧,凌罗庆,戴荣兴.花生衣的化学成分研究[J].中国中医杂志,1990,15(6):36 -38.
[2]林樱姬.花生红衣中多酚类物质的提取、纯化与抗氧化、抑菌研究[D].兰州:兰州理工大学,2010.
[3]陈洋,王冰,王佳男,等.RP-HPLC-ESI-MS/MS分离鉴定花生红衣原花青素A 型和B 型二聚体[J].食品科学,2013,34(23):142-146.
[4]杜蕾,李新华.黑、红花生衣中原花色素的分析[J].食品科学,2014,35(4):190 -194.
[5]孙庆杰.花生功能因子的研究与开发[D].青岛:青岛农业大学,2011.
[6]周燕芳,丁利君.超声波辅助提取艾叶黄酮的工艺研究[J].食品与机械,2006,22(4):39 -41.
[7]谢贞建,赵超群,邹联柱,等.普洱茶多酚的提取及抗氧化作用研究[J].食品与机械,2009,25(1):64 -67.
[8]邓雪,黄惠华.微波辅助萃取中茶多酚的传质机理和非热效应的初步研究[J].现代食品科技,2011,27(6):626 -629.
[9]张红梅,金征宇,王静.花生衣红色素微波提取工艺研究[J].安徽农业科学,2005,33(2):297 -299.
[10]陈杰,徐鹤龙.花生红衣褐色素的提取工艺研究[J].广东农业科学,2007(9):76-78.
[11]童愈元,何东平.花生红衣中红色素、原花色素的提取工艺研究[J].农业机械,2011(2):116 -119.
[12]张培成.黄酮化学[M].北京:化学工业出版社,2009:239-243.
[13]张向前,陈宗礼,杨选文,等.陕北红枣中酚类物质的紫外光谱分析[J].中国农学通报,2010,26(24):83 -88.
[14]于帅.板栗仁中多酚类化合物提取及含量测定[D].秦皇岛:河北科技师范学院,2011.
[15]张姣勤.不同品种花生红衣多酚的差异性及功效研究[D].郑州:河南农业大学,2009.
[16]邬建国,陈侃,张晓昱.花生衣总多酚乙醇辅助微波提取条件优化[J].中国食品添加剂,2010(5):103 -106.
[17]吴克刚,袁林,柴向华,等.花生红衣多酚的乙醇提取及清除DPPH自由基能力的研究[J].中国食品添加剂,2012(5):92-96.
