过氧化物酶体增殖物受体γ对血管内皮细胞活性氧生成的影响及机制
2015-03-17王兆君张宝和
王兆君,张宝和
(中国人民解放军海军总医院干部保健科,北京 100048)
·论 著·
过氧化物酶体增殖物受体γ对血管内皮细胞活性氧生成的影响及机制
王兆君,张宝和△
(中国人民解放军海军总医院干部保健科,北京 100048)
目的 分析过氧化酶体增殖物受体γ(PPARγ)在高糖介导血管内皮细胞活性氧(ROS)生成中的影响与机制。方法 采用33.0 mmol/L D-葡萄糖(高糖)进行介导的人脐静脉内皮细胞作为高糖介导组,采用二甲基亚砜处理的人脐静脉内皮细胞作为对照组。分别采用3种PPARγ激动剂吡格列酮、GW9662、京尼平作用于高糖介导组。采用一氧化氮与超氧阴离子荧光探针判定3种药物对血管内皮细胞一氧化氮与ROS的影响,采用蛋白免疫印迹法评估解耦联蛋白2表达水平。结果 高糖介导组ROS与一氧化氮表达水平与对照组比较差异有统计学意义(P<0.05)。3种药物中,吡格列酮对血管内皮细胞ROS、一氧化氮与解耦联蛋白2的作用最强(P<0.05)。结论 PPARγ能够明显缓解高糖介导下血管内皮细胞ROS生成,主要通过上调解耦联蛋白2发挥作用。
血管内皮细胞; 活性氧; 过氧化物酶体增殖物受体γ; 高糖介导
糖尿病是影响人类健康的常见疾病,也是诱发心脑血管病变的主要风险因素,长期血糖异常极易发生心力衰竭、脑卒中、脑梗死等并发症,致患者生命健康受到更严重的影响[1]。血管内皮损伤是心血管疾病发生的早期特征,高糖状态所形成的糖基化终末产物、线粒体功能障碍等情况均会严重损伤血管内皮细胞,而氧化应激是多种潜在风险损害过程的共同环节[2]。既往报道多认为,过氧化酶体增殖物受体γ(PPARγ)能够发挥良好的代谢保护作用,也可通过抗氧化应激缓解心脑血管功能障碍,但PPAPγ对血管内皮细胞活性氧(ROS)的影响情况及主要机制尚缺乏准确定论[3]。本研究通过建立内皮细胞损伤模型,分析PPAPγ在高糖介导血管内皮细胞ROS中的影响情况,现报道如下。
1 材料与方法
1.1 仪器与材料 采用上海汉博生物科技有限公司提供的人脐静脉内皮细胞株。仪器:三洋二氧化碳培养箱,美国Bio-Rad电泳仪与凝胶成像系统,瑞士Kinematica匀浆机,美国Millipore去离子水过滤器,上海光学仪器厂荧光显微镜,美国Beckman pH剂与核酸蛋白分析仪。材料:Gibco 胎牛血清、Sigma 4,5-二氨基乙酰乙酸荧光素、二氢乙啶、抗菌药物、上海通派生物科技有限公司提供的抗GAPDH抗体与抗解耦联蛋白2抗体、GIBCO DMEM培养基。
1.2 方法
1.2.1 细胞培养 采用低糖DMEM培养基装置人脐静脉内皮细胞株,加入1%抗菌药物与10%胎牛血清,混合均匀后置于5%CO2与37 ℃环境中培养。采用同体积二甲基亚砜处理后为对照组;采用33.0 mmol/L D-葡萄糖培养后作为高糖介导组。分别在高糖介导培养中滴入10 μmol/L吡格列酮、5 μmol/L GW9662与10 μmol/L吡格列酮、10 μmol/L京尼平与10 μmol/L吡格列酮,培养时间为1 d。采用6孔板装置培养细胞,各组培养均反复开展3次以上。
1.2.2 DHE染色 采用DHE燃料与二甲基亚砜配置0.01 mol/L储备液,并给予低温避光储存。将40 nmol/L的染色液加入至处理的血管内皮细胞中,置于37 ℃环境中培养30 min。采用NaCl、KCL、NaHCO3、MgSO4、KH2PO4、CaCl2与pH剂制成Krebs溶液,再对荧光显微镜开展3次冲洗。
1.2.3 内皮细胞一氧化氮检测 采用5 mmol/L的DAF-2DA加入至处理的血管内皮细胞中,置于37 ℃环境中培养45 min,再应用Krebs溶液冲洗的荧光显微镜观察,选择FITC滤光片完成照相。
1.2.4 蛋白免疫印迹检测 提取100 mg细胞,并将裂解液加入至细胞中,有效提取蛋白并进行浓度检测。获取50 μg蛋白上样通过聚丙烯酰胺凝胶电泳转移至聚偏二氟乙烯膜上,封闭并将Ⅰ抗与Ⅱ抗加入,给予化学发光试剂处理再行X线片曝光,最后采用凝胶成像系统完成分析。

2 结 果
2.1 各组ROS荧光强度、一氧化氮荧光强度、解耦联蛋白2表达结果 见表1。高糖介导下ROS与一氧化氮表达与同体积二甲基亚砜处理后比较差异有统计学意义(P<0.05),高糖介导+吡格列酮处理后ROS、一氧化氮荧光强度与解耦联蛋白2表达同高糖介导组比较差异有统计学意义(P<0.05),但应用GW9662后ROS、一氧化氮荧光强度及解耦联蛋白2表达与吡格列酮组比较差异有统计学意义(P<0.05),而应用京尼平后,ROS与一氧化氮荧光强度同吡格列酮组比较差异有统计学意义(P<0.05)。

表1 PPARγ对高糖介导人脐静脉内皮细胞ROS、一氧化氮与解耦联蛋白2表达的影响
注:与对照组比较,aP<0.05;与高糖介导组比较,bP<0.05;与高糖介导+吡格列酮组比较,cP<0.05。-表示无数据。
2.2 各组图像表现 见图1。
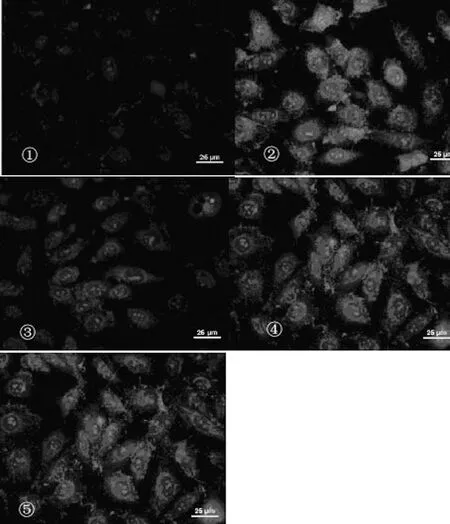
注:①为高糖介导;②为高糖介导+吡格列酮;③为高糖介导+吡格列酮+GW9662;④为高糖介导+吡格列酮+京尼平;⑤为对照组。
图1 各组图像表现
3 讨 论
高糖介导氧化应激水平升高是糖尿病患者发生心脑血管疾病的主要诱发因素,血管内皮细胞则为ROS的首要损伤区域[4]。伴随临床药物不断推陈出新,众多研究均证实PPARγ可有效抑制人体代谢变化,对动、静脉血管发挥良好的保护作用[5-6]。吡格列酮是临床经常用的PPARγ激动剂,可显著抑制患者血糖水平,但其血管内皮细胞保护作用仍缺乏证实[7]。为进一步明确PPARγ激动剂吡格列酮对高糖介导血管内皮细胞ROS的影响,本研究通过建立损伤细胞模型,经不同方式培养观察明确其药理机制。本研究结果显示,高糖介导下血管内皮细胞ROS表达明显上升,而ROS生成抑制作用促使血管内皮保护物一氧化氮水平降低,进而会严重加剧血管内皮的损害程度。吡格列酮应用后高糖介导血管内皮细胞的氧化应激受到显著拮抗作用,其ROS荧光强度显著低于未应用吡格列酮细胞,而相应一氧化氮荧光强度提高,提示吡格列酮可预防高糖缓解中一氧化氮水平降低情况,从而发挥血管内皮保护的作用。
为进一步明确PPARγ对高糖介导血管内皮细胞ROS产生影响的主要机制,本研究还进一步开展解耦联蛋白免疫印迹检验。国外研究显示,PPARγ对解耦联蛋白2 RNA转录表达具有上调作用,而解耦联蛋白2是线粒体内膜中的主要组成蛋白,其介导质子漏对ROS生成具有阻滞作用[8-9]。解耦联蛋白在氧化应激作用下会迅速提高,其表达提升后可增加抗氧化作用,积极保护正常血管内皮细胞功能,通过调节其表达水平进而加强糖尿病血管内皮损伤的预防性作用[10]。本研究采用蛋白免疫印迹法检测PPARγ对解耦联蛋白的影响,结果证实吡格列酮能够提高高糖环境中的蛋白表达水平,吡格列酮应用前、后解耦联蛋白2表达水平差异有统计学意义(P<0.05),由此证实药物对ROS的主要影响机制为解耦联蛋白2表达的变化。
综上所述,PPARγ能够明显缓解高糖介导下血管内皮细胞ROS的生成,主要通过上调解耦联蛋白2发挥其药物效果,可为糖尿病患者的心血管疾病预防提供良好作用。
[1]潘艳丽,郭长策,章秋.呲格列酮对高糖诱导下血管内皮细胞凋亡的影响[J].昆明医科大学学报,2014,35(9):48-51.
[2]张楠,丁俊,章秋,等.呲格列酮对血管内皮细胞及JNK信号通路的影响[J].安徽医科大学学报,2011,46(2):150-153.
[3]王宏,叶丹.二甲双胍联合呲格列酮对2型糖尿病患者血管内皮细胞功能机胰岛素抵抗的影响[J].中国现代医生,2013,51(20):25-27.
[4]陈培红.呲格列酮对2型糖尿病患者血管内皮细胞功能机胰岛素抵抗的影响[J].实用临床医药杂志,2012,16(23):109-111.
[5]黄丹丹,雷闽湘,陈本美,等.呲格列酮对高糖诱导血管内皮细胞凋亡的影响及作用机制[J].中国糖尿病杂志,2009,18(9):709-710.
[6]卢辉和,黎叶飞,盛臻强,等.吡格列酮抗炎作用对代谢综合征患者胰岛素敏感性、血管内皮细胞功能的影响[J].实用临床医药杂志,2012,16(19):38-39.
[7]盛臻强,黎叶飞,卢辉和.吡格列酮的抗氧化作用对代谢综合征患者血管内皮细胞功能的影响[J].南通大学学报,2012,32(3):191-193.
[8]Bugge A,Siersbaek M,Madsen MS,et al.A novel intronic peroxisome proliferator-activated receptor gamma enhancer in the uncoupling protein (UCP) 3 gene as a regulator of both UCP2 and 3 expression in adipocytes[J].J Biol Chem,2010,285(23):17310-17317.
[9]Ma S,Ma L,Yang D,et al.Uncoupling protein 2 ablation exacerbates high-salt intake-induced vascular dysfunction[J].Am J Hypertens,2010,23(8):822-828.
[10]Sasaki S,Inoguchi T.The role of oxidative stress in the pathogenesis of diabetic vascular comlications[J].Diabetes Metab J,2012,36(4):255-261.
Effect and mechanism of PPARγ on the generation of ROS in vascular endothelial cells
WANGZhao-jun,ZHANGBao-he△
(DepartmentofCadreHealth,NavyGeneralHospitalofPLA,Beijing100048,China)
Objective To investigate the effect and mechanism of PPARγ on the generation of reactive oxygen species (ROS) in vascular endothelial cells induced by high concentration glucose.Methods Human umbilical vein endothelial cells cultured with 33.0 mmol/L D-glucose (high concentration glucose) were set as high concentration glucose induced group,which treated by DMSO were set as control group.High concentration glucose induced group was treated by 3 kinds of PPAPγ agonists,including pioglitazone,GW9662 and genipin.Effects of 3 kinds of drugs on NO and ROS in vascular endothelial cells were assessed by using the fluorescent probes of NO and superoxide anion.The expression level of uncoupling protein 2 was determined by Western blot.Results There were significant differences of the levels of NO and ROS between high concentration glucose induced group and control group induced by DMSO (P<0.05).Among 3 kinds of drugs,pioglitazone had the strongest effects on the levels of ROS,NO and uncoupling protein 2 (P<0.05).Conclusion PPARγ can significantly alleviate the generation of ROS in vascular endothelial cells induced by high concentration glucose,which plays a role mainly through the up-regulation of uncoupling protein 2.
vascular endothelial cell; reactive oxygen species; PPARγ; high concentration glucose induced
王兆君,女,硕士,主治医师,主要从事老年人群的冠心病和糖尿病方面的研究。△
,E-mail:Zbh129778@sina.com。
10.3969/j.issn.1672-9455.2015.24.012
A
1672-9455(2015)24-3643-02
2015-05-05
2015-07-15)
