Notch1基因检测对不同分型急性髓系白血病的诊断价值*
2015-03-17王方平张平安邓亚云
王方平,张平安,邓亚云,吴 薇
(武汉大学人民医院检验科 430060)
·论 著·
Notch1基因检测对不同分型急性髓系白血病的诊断价值*
王方平,张平安△,邓亚云,吴 薇
(武汉大学人民医院检验科 430060)
目的 研究不同分型的急性髓系白血病(AML)患者骨髓中单个核细胞Notch1基因mRNA的表达。方法 收集初诊的102例AML患者(M1型18例,M2型41例,M3型16例,M4型14例,M5型13例)和34例对照者(非白血病和健康人,其中非白血病患者和健康人Notch1基因mRNA表达无差异)骨髓,采用实时荧光定量聚合酶链反应检测Notch1基因mRNA表达情况。结果 102例AML患者骨髓中Notch1基因mRNA表达量相对于对照组升高了477.7倍,差异有统计学意义(t=51.0,P<0.05)。不同分型AML患者骨髓中,M1、M2、M4、M5型AML之间Notch1基因mRNA表达量无差异,但均低于M3型,与M3差异有统计学意义(t=4.87,5.24,3.26,5.75,P<0.05)。结论 不同分型的AML患者骨髓Notch1基因表达均存在异常,并且发现M3型与其他类型AML表达有差异,该机制可能表明Notch1基因在不同亚型AML发生和发展中所起作用不同。
急性髓系白血病; 骨髓单个核细胞; Notch1基因; 聚合酶链反应
急性髓系白血病(AML)全世界的发病率为2.25/10万人,我国发病率为5.68/10万人,是成年人最常见的急性白血病[1]。目前AML的治疗仍以化疗为主,但化疗药物的耐受及化疗缓解后复发仍然是治疗的主要障碍,因此迫切需要寻求新的治疗方法。Notch基因是一个由细胞外亚基NEC(NEC)和跨膜亚基NTM(ICN)组成的二聚体跨膜受体,哺乳动物体内表达4种Notch受体,5种Notch配体[2]。配体结合到受体,引起γ分泌酶切割掉细胞外亚基NEC,并释放出细胞内亚基ICN[3]。释放出的ICN转移到细胞核内,诱导相关致癌基因的表达[2]。近年来,关于Notch信号通路在恶性白血病中的报道充满争议,Lobry等[4]和Kannan等[5]研究表明,Notch信号通路的活化能抑制AML患者细胞的生长。但Kode等[6]认为,成骨细胞中活化的β链蛋白激活刺激Jagged1的表达,随后激活Notch基因在造血干细胞中表达,最终导致AML发生。上述研究表明,Notch基因可能具有致癌与抑癌的双重作用,这可能是由于组织来源不同、肿瘤发展阶段差异及疾病属于不同亚型等导致[7]。因此,本研究收集患者骨髓细胞,采用实时荧光定量聚合酶链反应(PCR)技术检测不同分型AML患者骨髓单个核细胞中Notch1基因mRNA的表达量,探讨Notch1基因与AML不同分型之间的关系,为不同分型AML白血病的诊断及预后评估提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料 收集2013年6月至2015年5月以形态学、免疫学、遗传学和分子生物学诊断标准确诊为AML的102例初诊患者骨髓标本作为AML组,其中男52例,女50例。根据FAB分型标准将AML分为M1型18例,M2型 41例,M3型16例,M4型14例,M5型13例。以34例非AML白血病患者和健康人骨髓作为对照组。
1.2 试剂与仪器 Trizol和SYBR Premix Ex Taq II由TaKaRa公司提供,反转录试剂盒由Thermo SCIENTIFIC公司提供。PCR分析仪由Applied Biosystem Inc公司生产,VII7荧光定量PCR分析仪由ABI公司生产。
1.3 研究方法
1.3.1 引物设计 利用美国国立生物技术信息中心网站中提供的Notch1 mRNA序列和BLAST进行引物设计,见表1。所有引物均由上海维基生物科技有限公司合成。

表1 基因Notch1、β-actin的上、下游引物
1.3.2 mRNA提取和反转录 采集研究对象骨髓2 mL于EDTA抗凝试管中,按照淋巴细胞分裂液说明书(天津美德太平洋科技有限公司)提取单个核细胞。Trizol法提取总mRNA并将其进行纯度分析,当A260 nm/A280 nm为1.8时方可用于下一步研究。取11 μL RNA模板进行反转录,加入1 μL oligo引物混匀并瞬时离心,65 ℃ 5 min,反应体系:4 μL Reaction Buffer,2 μL Mix,1 μL RI,1 μL RT。反应条件:42 ℃ 60 min,72 ℃ 10 min,4 ℃保存。得到的cDNA产物置于-20 ℃保存备用。
1.3.3 荧光定量PCR检测 反应体系为cDNA 1 μL,上、下游引物各1 μL,SYBR Premix Ex Taq Ⅱ 10 μL,ROX Ⅱ 0.4 μL,ddH2O 7.6 μL,总体积20 μL。2个基因(Notch1、β-actin)的扩增反应条件均为94 ℃30 s预变性,94 ℃20 s,60 ℃20 s,72 ℃35 s,50个循环。溶解曲线条件:95 ℃15 s,60 ℃1 min,95 ℃15 s。对AML各组及AML组和对照组基因mRNA的表达采用目标扩增产物达到设定阈值所经历的循环次数(Ct)值进行比较。扩增效率验证:本研究分别对Notch1和β-actin基因进行10倍稀释,稀释5种梯度,目的基因和内参基因扩增效率相差小于5%,且在98%~102%,可以认为扩增效率近似相等。

2 结 果
2.1 实时荧光定量PCR分析Notch1表达 以cDNA作为模板,进行实时PCR扩增,制作标准曲线和溶解曲线。结果表明,Notch1及β-actin溶解曲线只有单一峰。琼脂糖凝胶电泳图可以看出目的条带单一,见图1,而且目的基因片段的长度与预期设计的长度符合,说明引物特异性较好。Notch1及β-actin的标准曲线及二者的扩增效率分别为98%、102%,可以认为二者扩增效率近似相等。
2.2 AML组与对照组Notch1基因mRNA表达情况 对实验组和对照组Notch1基因mRNA的表达进行检测发现,AML患者组Notch1 mRNA表达高于对照组,差异有统计学意义(P<0.05),且M3与M1、M2、M4型、M5型之间Notch1 mRNA表达水平差异有统计学意义(P<0.05),见表1、2。
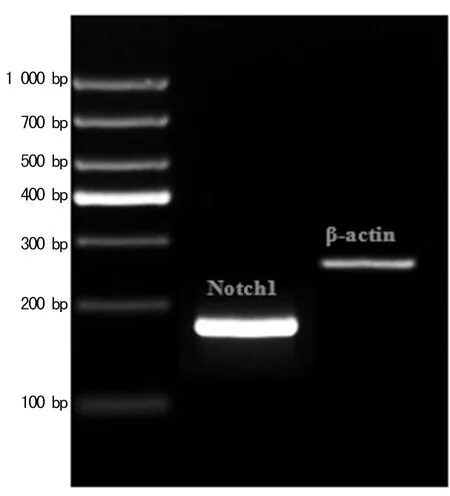
图1 琼脂糖凝胶电泳图
表1 不同分型AML组和对照组之间Notch1 mRNA ΔCt值

组别Mean±SΔΔCt2-(ΔΔCt)PΔCt(Notch1) AML-M17.7±0.9-8.7415.90.05 AML-M27.6±0.9-8.8445.70.05 AML-M36.4±0.6-10.010240.05 AML-M47.3±0.5-9.1548.70.05 AML-M58.1±0.6-8.3315.20.05 AML7.5±0.9-8.9477.70.05 Control16.4±0.8---
注:ΔΔCt=ΔCtAML组-ΔCt对照组。
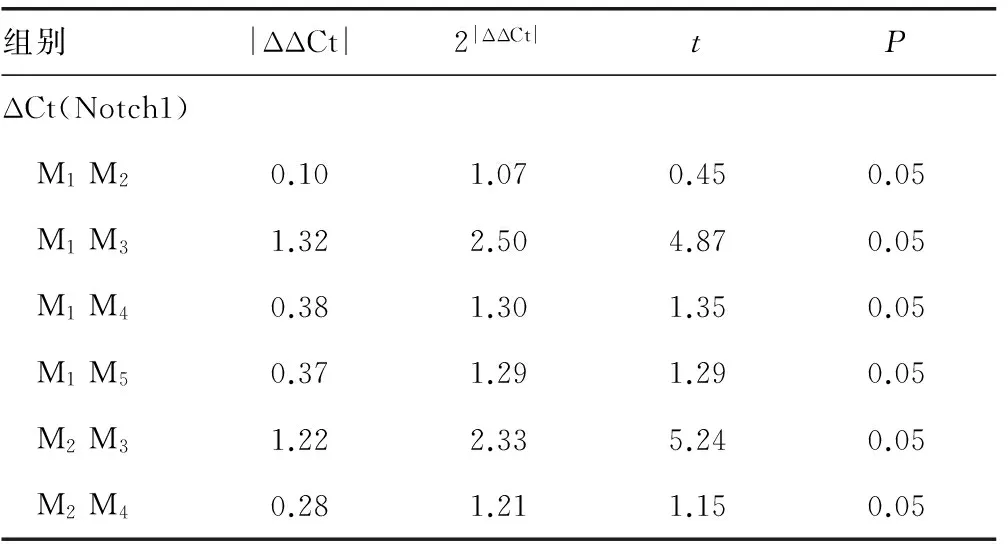
表2 不同分型患者组之间Notch1 mRNA ΔCt值两两比较

续表2 不同分型患者组之间Notch1 mRNA ΔCt值两两比较
注:ΔΔCt=ΔCtMN-ΔCtMM(N>M)。
3 讨 论
Notch基因在细胞生长发育过程中起关键作用,参与多系统干细胞自我更新和分化,而且Notch信号传导失调在血液恶性肿瘤和其他各种实体肿瘤中都有报道[9-10]。Notch基因广泛参与肿瘤细胞的信号调节,在T细胞淋巴瘤、宫颈癌中,活化的Notch基因起致癌作用[11-12]。而在神经胶质瘤中它又是一种肿瘤抑制剂[13]。研究发现,白血病的发生与Notch基因及其介导的信号传导通路密切相关,Notch信号参与调节淋巴细胞成熟的多个阶段,在T急性淋巴细胞白血病中Notch1信号通路的分子机制不明,突变的Notch1基因可能与其他多种致癌因子共同作用[14]。
FAB分型是根据骨髓细胞形态学和细胞化学特征,尤其是原始细胞的数量和形态来分型,一共分为M0~M78型,其中M3型白血病又叫急性早幼粒性白血病,具有特殊的临床表现、形态特征,以及区别于其他亚型的基因特征。近来Grieselhuber等[15]报道,初期的急性早幼粒细胞白血病(APL)骨髓标本与其他AML亚型相比较Jagged1表达量较高,在细胞系水平诱导PML-RARA的表达提高了Jagged1蛋白表达水平,从而加强了γ分泌酶切割细胞外亚基NEC,Notch抑制剂能减少APL细胞的生长,这表明活化的Notch基因可能在APL中扮演着致癌角色。γ分泌酶抑制剂(GSI)可通过抑制Notch基因受体或配体抑制Notch基因活性[3]。因此,Notch基因抑制剂是一种非常有前途的抑癌剂,用来治疗某些癌症,如APL和急性淋巴细胞性白血病等[3]。
本研究发现,Notch1基因不仅在健康人与AML患者单核细胞内表达显著不同,升高了477.7倍(t=51.0,P<0.05),而且在不同FAB分型的AML中表达也有差异。其中M3型比M1、M2、M4及M5型表达量高,差异有统计学意义(P<0.05),这可为临床诊断及治疗M3型AML提供辅助依据。
目前Notch基因抑制剂作为一种前瞻性治疗药物,已经有了较为深入的研究,以上研究为利用GSI治疗不同分型AML提供了一定的指导作用。
[1]刘玉琴,赵凤菊,陈万青,等.中国2009年白血病发病和死亡资料分析[J].中国肿瘤,2013,22(7):528-534.
[2]Tohda S.NOTCH signaling roles in acute myeloid leukemia cell growth and interaction with other stemness-related signals[J].Anticancer Res,2014,34(11):6259-6264.
[3]Tohda S,Nara N.Expression of Notch1 and Jagged1 proteins in acute myeloid leukemia cells[J].Leuk Lymphoma,2001,42(3):467-472.
[4]Lobry C,Ntziachristos P,Ndiaye-Lobry D,et al.Notch pathway activation targets AML-initiating cell homeostasis and differentiation[J].J Exp Med,2013,210(2):301-319.
[5]Kannan S,Sutphin RM,Hall MG,et al.Notch activation inhibits AML growth and survival:a potential therapeutic approach[J].J Exp Med,2013,210(2):321-337.
[6]Kode A,Manavalan JS,Mosialou I,et al.Leukaemogenesis induced by an activating catenin mutation in osteoblasts[J].Nature,2014,506(7487):240-244.
[7]Espinoza I,Miele L.Notch inhibitors for cancer treatment[J].Pharmacol Ther,2013,139(2):95-110.
[8]Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res,2001,29(9):45-50.
[9]Bigas A,Espinosa L.Hematopoietic stem cells:to be or Notch to be[J].Blood,2012,119(14):3226-3235.
[10]Ntziachristos P,Lim JS,Sage J,et al.From fly wings to targeted cancer therapies:a centennial for notch signaling[J].Cancer Cell,2014,25(3):318-334.
[11]Yousif NG,Sadiq AM,Yousif MG,et al.Notch1 ligand signaling pathway activated in cervical cancer:poor prognosis with high-level JAG1/Notch1[J].Arch Gynecol Obstet,2015,292(4):899-904.
[12]Yang L,Zhang S,George SK,et al.Targeting Notch1 and proteasome as an effective strategy to suppress T-cell lymphoproliferative neoplasms[J].Oncotarget,2015,6(17):14953-14969.
[13]Yao J,Zheng K,Li C,et al.Interference of Notch1 inhibits the growth of glioma cancer cells by inducing cell autophagy and down-regulation of Notch1-Hes-1 signaling pathway[J].Med Oncol,2015,32(6):174-182.
[14]Weerkamp F,van Dongen JJ,Staal FJ.Notch and Wnt signalling in T-lymphocyte development and acute lymphoblastic leukemia[J].Leukemia,2006,20(7):1197-1205.
[15]Grieselhuber NR,Klco JM,Verdoni AM,et al.Notch signaling in acute promyelocytic leukemia[J].Leukemia,2013,27(7):1548-1557.
Study on the diagnostic value of Notch1 mRNA in different subtypes of acute myelocytic leukemia patients*
WANGFang-ping,ZHANGPing-an△,DENGYa-yun,WUWei
(DepartmentofClinicalLaboratory,RenminHospitalofWuhanUniversity,Wuhan,Hubei430060,China)
Objective To explore the expression of Notch1 mRNA of mononuclear cells in marrow of patients with different subtypes of acute myelocytic leukemia (AML).Methods Marrow samples were respectively collected from 102 cases of newly diagnosed patients with AML (AML group,including 18 cases of M1,41 cases of M2,16 cases of M3,14 cases of M4and 13 cases of M5) and 34 cases of controls (control group,including non-hematopathy patients and healthy individuals,who had similar expression levels of Notch1 mRNA).Expression levels of Notch1 mRNA were detected by real-time quantitative PCR.Results Comparing with control group,the expression level of Notch1 mRNA of AML group increased by 477.7 times,and was significantly higher than that of control group (t=51.0,P<0.05).There were no differences of the expression levels of Notch1 mRNA among the patients with M1,M2,M4and M5leukemia (P>0.05),however,they were significantly lower than that of the patients with M3leukemia,with statistical differences(t=4.87,5.24,3.26,5.75,P<0.05).Conclusion AML patients had abnormal expression of Notch1 gene in marrow,and the expression level of Notch1 gene in M3 leukemia patients were significantly different from the patients with other subtypes of AML,which indicated that Notch1 mRNA plays different roles in different subtypes of AML.
acute myelocytic leukemia; bone marrow mononuclear cells; Notch1; PCR
国家自然科学基金资助项目(81200389)。
王方平,女,硕士,检验医师,主要从事免疫学检验研究。△
,E-mail:zhangpingan@aliyun.com。
10.3969/j.issn.1672-9455.2015.24.003
A
1672-9455(2015)24-3617-03
2015-06-19
2015-08-10)
