siRNA干扰NF-E2相关因子2对喉鳞状细胞癌化疗敏感性的影响*
2015-03-17徐吉周争李吉平
徐吉周争李吉平
·实验研究·
siRNA干扰NF-E2相关因子2对喉鳞状细胞癌化疗敏感性的影响*
徐吉1周争1李吉平1
目的 探讨小片段干扰RNA(siRNA)干扰NF-E2相关因子2(NF-E2-related factor 2,Nrf2)对人喉癌Hep2细胞化疗敏感性的影响及凋亡的差异。方法 体外培养人喉癌细胞系Hep2,设立实验组和对照组,实验组(Hep2/siRNA组)采用脂质体转染法,转染siRNA至Hep2细胞系,对照组(Hep2/siRNA-control组)转染空质粒siRNA-control。经Western Blot验证其转染效果后,采用CCK-8法检测计算Hep2/siRNA与Hep2/siRNA-control经不同浓度梯度顺铂(分别为1、2、4、8、16μg/ml)处理后的细胞增殖抑制率及IC50值。通过凋亡试剂盒分别染色Hep2/siRNA与Hep2/siRNA-control细胞系,采用流式细胞仪检测两组细胞的凋亡率。结果实验组的Nrf2蛋白表达比对照组发生下调,经不同浓度梯度顺铂处理24 h后,Hep2/siRNA细胞系增殖抑制率相对Hep2/siRNA-control逐渐升高,顺铂浓度为4μg/ml时,对照组细胞增殖率为35.55%±6.14%,而实验组细胞增殖率为46.07%±5.21%,IC50值下调,细胞凋亡率由17.1%(对照组)升高至26.6%(实验组)。结论 siRNA干扰Nrf2基因可增强Hep2细胞系对顺铂的敏感性。
喉癌; NF-E2相关因子2; 小片段干扰RNA; 化疗敏感性; 顺铂
喉癌是耳鼻咽喉头颈外科常见恶性肿瘤之一,其致病机理尚不明确。多数研究提示,喉癌的发生发展与吸烟关系密切[1],喉癌患者中吸烟者占95%,且吸烟量和时间与喉癌发病呈正相关,而氧化应激与吸烟关系密切[2,3],被认为是肿瘤发生发展的重要因素。近年来研究发现,吸烟可影响化疗药物疗效,减弱肿瘤化疗效果[4]。NF-E2相关因子2(NF-E2-related factor 2,Nrf2)作为重要转录因子,其介导的Nrf2-ARE通路是最重要的抗氧化信号通路之一,处于氧化应激的中心地位[5],最新研究发现其组成性表达增高可促进肿瘤发生与肿瘤耐药[6,7]。本研究拟通过观察小片段干扰RNA(siRNA)干扰抑制人喉癌细胞Hep2细胞系中Nrf2基因的表达,探讨其对化疗药物顺铂(CDDP)治疗喉癌的敏感性的影响。
1 材料与方法
1.1 实验材料 细胞系:人喉癌上皮Hep2细胞株;主要试剂:胎牛血清FBS;RMPI1640培养基,opti-MEM培养基均购自美国Hyclone公司;培养瓶、多细胞培养板购自美国Corning公司;Western电泳仪购自美国Invitrogen公司;lipo2000转染试剂、胰蛋白酶购自Invitrogen,Annexin V-FITC/PI细胞凋亡试剂购自凯基公司,质粒siRNA、Hep/siRNA-control购自广州瑞博生物公司,顺铂购自上海仁济医院药剂科。
1.2 研究方法
1.2.1 细胞培养 人喉癌细胞系Hep2用RPMI 1640培养基(含10%胎牛血清)在37℃、95%空气饱和湿度、5%CO2培养箱培养,并适时传代。
1.2.1 细胞质粒转染 Hep2细胞接种于6孔板培养,每孔105个细胞,融合度70%~80%,制备下述溶液,溶液A:10μl siRNA质粒溶于250μl双无opti-MEM培养基;溶液B:5μl Lipofectamine 2000溶于250μl双无opti-MEM培养基中,静置5 min;溶液C:混匀溶液A和溶液B,室温孵育15 min,将溶液C滴入六孔板中;4 h后更换常规培养基培养(实验组)。同法转染空质粒siRNA-control作为对照组(即Hep2/siRNA-control组)。Hep2组不作任何处理。
1.2.3 Western Blot检测转染效果 ①提取Hep2、Hep2/siRNA两种细胞于EP管,加入0.5 ml裂解液并吹打,裂解30 min后离心机12 000转离心10 min,吸取上清液备用;②制备分离胶与浓缩胶,取等量样品蛋白加入1倍体积的2×SDS上样缓冲液,沸水浴5 min;③每个样品孔加入40μg处理好样品,电泳浓缩胶40 V、30 min,分离胶110 V、70 min至溴酚蓝抵达凝胶底边;④将备好的转移用海绵、滤纸、PAGE胶、PVDF膜按三明治结构放入电泳槽,加入足量转膜缓冲液,加盖转印90 min;⑤转膜后用TBST洗PVDF膜,加入脱脂奶粉封闭1 h再次洗膜;⑥加入一抗,室温孵育1 h后摇床上摇动,并再次TBST洗膜3次;⑦加入二抗杂交,同上一步孵育摇动并洗膜;⑧取膜加入发光试剂ECL在暗室胶片曝光显影,并予凝胶成像系统采集图像,扫描制片。
1.2.4 CCK-8法检测顺铂对转染后Hep2细胞系增殖抑制的影响 顺铂的使用浓度结合血浆峰浓度(peak plasma concentration,PPC)及预实验结果,采用4.0μg/ml。具体步骤为:收集对数生长周期的Hep2、Hep2/siRNA、Hep2/siRNA-control细胞,按每孔3×103细胞密度、每孔100μl种于96孔板;培养24 h后向培养板加入系列稀释的顺铂(终浓度分别为1μg/ml、2μg/ml、4μg/ml、8μg/ml、16μg/ml),在培养箱中孵育24 h;每孔加入10 μl CCK-8试剂,孵育2 h,酶标仪在480 nm处测定其吸光值,计算细胞增殖抑制率及半抑制浓度(50%inhibitory concentration,IC50)。细胞增殖抑制率(%)=(1-实验组OD值/阴性对照组OD值)× 100%。运用Graphpad Prism 5.0软件计算IC50值。
1.2.5 细胞凋亡分析检测 采用荧光显微镜与流式细胞仪分别检测细胞凋亡,步骤如下:PBS漂洗、胰酶消化后收集(1~5)×105细胞;加入500μl的Binding Buffer悬浮细胞,加入5μl Annexin VFITC混匀后,加入5μl Propidium Iodide,混匀,室温、避光、反应5~15 min;上述细胞悬液滴于盖玻片上,给予DAPI染色,均匀覆盖于荧光显微镜观察并照片;打开校正流式细胞仪检测,激发波长Ex=488 nm,发射波长Em=530 nm。调节Annexin V -FITC的绿色荧光通过FITC通道(FL1)检测;PI红色荧光(流式Ex=488 nm,Em≥630 nm)通过FL3
通道检测。荧光补偿调节:使用经凋亡诱导处理的正常细胞,作为对照进行荧光补偿调节去除光谱重叠和设定十字门的位置。四象限中,右下象限表示早期凋亡细胞,右上象限为晚期凋亡细胞。通过流式细胞仪读取凋亡率。
1.3 统计学方法 运用SPSS 19.0统计软件,计算各组抑制率的平均值(%),采用随机区组设计方差分析不同浓度梯度CDDP作用下,Hep2组、Hep2/siRNA组及Hep2/siRNA-control组细胞的抑制率。
2 结果
2.1 Nrf2-siRNA的转染效果 实验组的Hep2/siRNA蛋白表达量明显低于Hep2组(图1)。
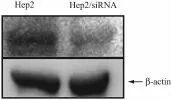
图1 Nrf2-siRNA转染前后Western Blot结果
2.2 不同浓度梯度CDDP处理Hep2、Hep2/siRNA、Hep2/siRNA-control三组细胞24 h后CCK -8检测结果(表1) 由表1可见,Hep2组与Hep2/siRNA-control组细胞抑制率比较,差异无统计学意义(P>0.05),Hep2/siRNA组细胞抑制率高于Hep2、Hep2/siRNA-control组,差异均有统计学意义(P<0.05);随CDDP药物浓度增高,各组抑制率也逐渐提高,当CDDP浓度为4μg/ml时Hep2/siRNA的细胞抑制率明显高于对照组(P<0.05)。Hep2、Hep2/siRNA、Hep2/siRNA-control三组IC50分别为7.90、5.270、8.107μg/ml。
表1 不同浓度梯度CDDP作用下各组细胞的抑制率(%,±s)
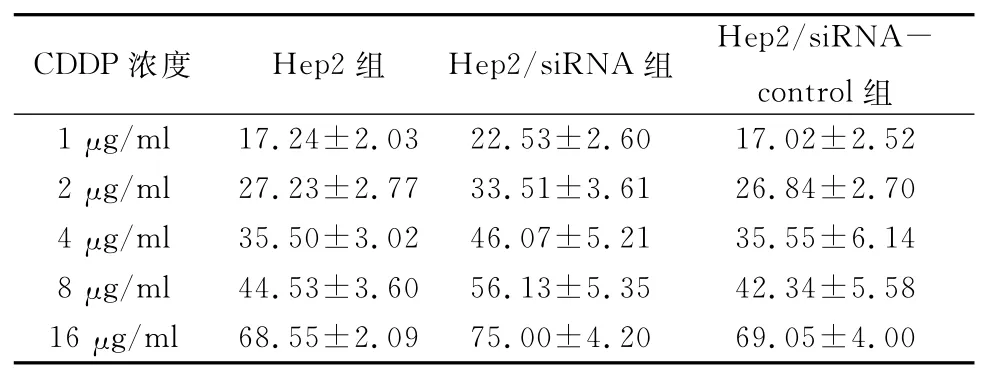
表1 不同浓度梯度CDDP作用下各组细胞的抑制率(%,±s)
CDDP浓度Hep2组Hep2/siRNA组Hep2/siRNA-control组1μg/ml 17.24±2.03 22.53±2.60 17.02±2.52 2μg/ml 27.23±2.77 33.51±3.61 26.84±2.70 4μg/ml 35.50±3.02 46.07±5.21 35.55±6.14 8μg/ml 44.53±3.60 56.13±5.35 42.34±5.58 16μg/ml 68.55±2.09 75.00±4.20 69.05±4.00
2.3 CDDP对Hep2、Hep2/siRNA、Hep2/siRNA -control组细胞凋亡的影响
2.3.1 荧光显微镜观察 图2显示Hep2、Hep2/siRNA、Hep2/siRNA-control三组细胞荧光染色后照片,蓝色显影为4',6-二脒基-2-苯基吲哚(即DAPI)染色后固定的细胞(a、d、g);绿色显影为Annexin V染色后细胞,提示早期凋亡(b、e、h);红色显影为PI染色后细胞,提示晚期凋亡(c、f、i)。
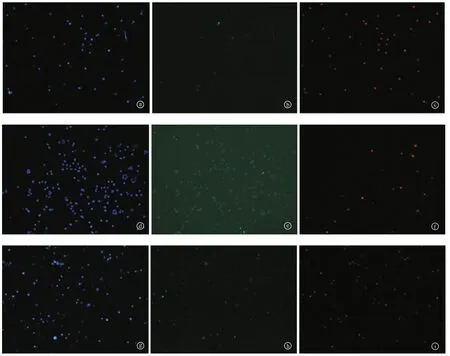
图2 Hep2、Hep2/siRNA、Hep2/siRNA-control组细胞凋亡染色荧光照片
2.3.2 流式细胞仪检测结果 CFlow Plus软件示左上象限Q1为坏死细胞,左下象限Q3为正常细胞,右上象限Q2为晚期凋亡与坏死细胞,右下象限Q4为早期凋亡细胞(图3)。以Q2+Q4细胞占总细胞数的百分比计算细胞凋亡率。加入CDDP孵育24 h后CDDP药物浓度为4μg/ml时,Hep2、Hep2/siRNA、Hep2/siRNA-control三组细胞凋亡率分别为18.4%、26.6%、17.1%,其中,Hep2/siRNA组较Hep2/siRNA-control组的细胞凋亡率绝对值升高9.5%。
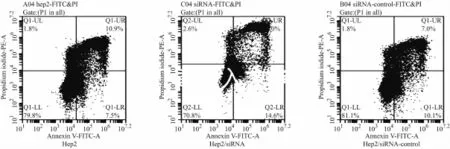
图3 三组细胞Hep2、Hep2/siRNA、Hep2/siRNA-control给予4μg/ml顺铂24 h后在凋亡试剂盒诱导后流式细胞仪检测四象限图
3 讨论
随着肿瘤的发病率增高,肿瘤耐药性的研究逐渐受到重视,但因各类抗肿瘤药物结构各异、机制不同,耐药性研究也困难,特别是恶性肿瘤多耐药性的出现,使得耐药机制的研究更显得迫在眉睫[8]。喉癌是耳鼻咽喉头颈外科常见的恶性肿瘤,化疗药的应用在其综合治疗中起着重要的作用,但化疗药物的耐药性一直以来是其进一步应用所面临的难题[]。
Nrf2是重要的转录因子,它可以进入细胞核内与其下游多个基因启动子区域的抗氧化反应元件(antioxidant response element,ARE)结合,诱导靶基因如血红素加氧酶-1(HO-1)、NADH-醌氧化还原酶(NQO1)的表达,参与抗氧化反应调控。Nrf2-ARE信号通路主要受keap1调控[10],后者为Cullin3依赖的E3泛素酶连接底物,可捕捉Nrf2并迅速使其泛素化,然后转至蛋白酶体降解,从而使Nrf2在未受到刺激时保持低水平。Kelch样环氧氯丙烷相关蛋白-1(Keap1)上有着敏感的氧分压变化感受器[11],一旦细胞内活性氧(reactive oxygen species,ROS)生成增多,Keap1分子构象适应性改变而使Nrf2逃脱,Nrf2则进入核内调控下游基因表达,从而发挥抗氧化作用[12]。
Nrf2在肿瘤发展中的作用尚不十分明确,Nrf2信号通路的增强可以激活细胞防御系统,促进细胞在不利环境下存活,但研究发现Nrf2表达增高可促进癌症发生及肿瘤耐药[7,13,14]。Homma等[15]发现Nrf2可促进人肺癌细胞的增殖及耐药性;Hayden等[16]发现Nrf2可促进膀胱癌对顺铂耐药。
本研究结果显示,siRNA干扰Nrf2基因后,喉癌Hep2细胞增殖抑制率较未转染时升高,同时其凋亡率也升高。而顺铂是已知的一类经典烷化剂抗肿瘤药物,其抗肿瘤机制在于诱导caspase-3的细胞凋亡作用[17,18],干扰Nrf2后细胞凋亡率升高即促进Hep2细胞对顺铂的敏感性,提示Nrf2在抗肿瘤作用中起着促进耐药的作用;而这一作用也与Nrf2在肺癌[19,20]、膀胱癌[16]、胰腺癌[6]等其他研究中的作用相一致。
总之,本研究运用siRNA技术敲除Nrf2基因探究其在化疗敏感性中的作用,结果提示Nrf2-ARE通路可能在肿瘤耐药中起着重要作用,此为干扰技术在抗恶性肿瘤中的运用提供了细胞水平的实验支持。但Nrf2-ARE抗氧化通路参与耐药的具体环节仍有待进一步研究,其上下游调控基因、转录及蛋白表达、修饰等也需进一步实验分析。
1 Lee KW,Kuo WR,Tsai SM,et al.,Different impact from betel quid,alcohol and cigarette:risk factors for pharyngeal and laryngeal cancer[J].Int J Cancer,2005,117:831.
2 Szyfter K.Molecular and cellular changes following exposure to tobacco smoke causing laryngeal cancer.An outline of the problem[J].Przegl Lek,2004,61:1197.
3 Zang LY,Stone K,Pryor WA.Detection of free radicals in aqueous extracts of cigarette tar by electron spin resonance[J]. Free Radic Biol Med,1995,19:161.
4 An Y,Kiang A,Lopez JP,et al.Cigarette smoke promotes drug resistance and expansion of cancer stem cell-like side population[J].PLoS One,2012,7:e47919.
5 Zhang DD,Lo SC,Sun Z,et al.Ubiquitination of Keap1,a BTB-Kelch substrate adaptor protein for Cul3,targets Keap1 for degradation by a proteasome-independent pathway[J].J Biol Chem,2005,280:30091.
6 Hong YB,Kang HJ,Kwon SY,et al.Nuclear factor(erythroid-derived 2)-like 2 regulates drug resistance in pancreatic cancer cells[J].Pancreas,2010,39:463.
7 Rushworth SA,Macewan DJ.The role of Nrf2 and cytoprotection in regulating chemotherapy resistance of human leukemia cells[J].Cancers(Basel),2011,3:1605.
8 Housman G,Byler S,Heerboth S,et al.Drug resistance in cancer:an overview[J].Cancers(Basel),2014,6:1769.
9 Haigentz M Jr,Silver CE,Hartl DM,et al.Chemotherapy regimens and treatment protocols for laryngeal cancer[J].Expert Opin Pharmacother,2010,11:1305.
10 Hayes JD,Mc Mahon M,Chowdhry S,et al.Cancer chemoprevention mechanisms mediated through the Keap1-Nrf2 pathway[J].Antioxid Redox Signal,2010,13:1713.
11 Sun Z,Zhang S,Chan JY,et al.Keap1 controls postinduction repression of the Nrf2-mediated antioxidant response by escorting nuclear export of Nrf2[J].Mol Cell Biol,2007,27:6334.
12 Kensler TW,Wakabayashi N,Biswal S.Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J].Annu Rev Pharmacol Toxicol,2007,47:89.
13 Kansanen E,Kuosmanen SM,Leinonen H,et al.The Keap1-Nrf2 pathway:Mechanisms of activation and dysregulation in cancer[J].Redox Biol,2013,1:45.
14 Wang XJ,Sun Z,Villeneuve NF,et al.Nrf2 enhances resistance of cancer cells to chemotherapeutic drugs,the dark side of Nrf2[J].Carcinogenesis,2008,29:1235.
15 Homma S,Ishii Y,Morishima Y,et al.Nrf2 enhances cell proliferation and resistance to anticancer drugs in human lung cancer[J].Clin Cancer Res,2009,15:3423.
16 Hayden A,Douglas J,Sommerlad M,et al.The Nrf2 transcription factor contributes to resistance to cisplatin in bladder cancer[J].Urol Oncol,2014,32:806.
17 Reedijk J,Lohman PH.Cisplatin:synthesis,antitumour activity and mechanism of action[J].Pharm Weekbl Sci,1985,7:173.
18 Lee JU,Hosotani R,Wada M,et al.Mechanism of apoptosis induced by cisplatin and VP-16 in PANC-1 cells[J]. Anticancer Res,1997,17:3445.
19 Ji L,Li H,Gao P,et al.Nrf2 pathway regulates multidrugresistance-associated protein 1 in small cell lung cancer[J]. PLoS One,2013,8:e63404.
20 Kim HR,Kim S,Kim EJ,et al.Suppression of Nrf2-driven heme oxygenase-1 enhances the chemosensitivity of lung cancer A549 cells toward cisplatin[J].Lung Cancer,2008,60:47.
(2014-11-11收稿)
(本文编辑 李翠娥)
lnhibition of Nrf2 by siRNA Regulates Chemosensitivity of Laryngeal Cancer to Cisplatin
Xu Ji,Zhou Zheng,Li Jiping
(Department of Otorhinolaryngology,Head and Neck Surgery,Renji Hospital,School of Medicine,Shanghai Jiaotong University,Shanghai,200127,China)
Objective To determine the inhibitory effect of the synthetic Nrf2 siRNA on the expression of Nrf2 gene in human laryngeal cancer cell lines Hep2 and to investigate the effects of Nrf2 siRNA on chemosensitivity of laryngeal carcinoma to cisplatin by detection growth and apoptosis in Hep2 cells.Methods The recombinant plasmid control siRNA and Nrf2 siRNA were transfected into Hep2 cells,and western blot analysis of Nrf2 expression in Hep2 cells was performed 48 h after transfection.In order to determine whether Nrf2 siRNA can enhance the sensitivity of Hep2 laryngeal cells to cisplatin,we treated Hep2 cells with different concentrations of cisplatin after 24 h,and evaluated these cells for proliferation,and apoptosis.CCK-8 and flow cytometry assay were used for determination of cells proliferation and apoptosis in Hep2 cells.We calculated the inhibition rate and IC50 of the cell after treating with different concentrations of ciplatin.Results The laryngeal carcinoma cell stain Hep2 was transfected by Nrf2 siRNA and control siRNA respectively.The result of western blot showed the Nrf2 expression was significantly impeded at protein levels.CCK-8 assay showed the proliferation of Hep2/Nrf2 siRNA and Hep2/control siRNA was inhibited to 35.55%to 46.07%at 24 h respectively after treating with 4μg/ml cisplatin.The chemosensitivity to cisplatin in Hep2/Nrf2 siRNA was markly increased compared with Hep2/control siRNA.The IC50 in Hep2/Nrf2 siRNA was 5.27μg/ml contrast to 8.107μg/ml compared in Hep2/control siRNA.The result of flow
Laryngeal cancer; Nrf2; siRNA; Chemosensitivity; CDDP
10.3969/j.issn.1006-7299.2015.04.012
时间:2015-6-17 9:56
R739.6
A
1006-7299(2015)04-0381-05
* 上海市科学技术委员会上海自然基金项目(13ZR1425300)
1 上海交通大学医学院附属仁济医院耳鼻咽喉科(上海 200127)
徐吉:男,江苏人,硕士研究生,主要研究方向为鼻及鼻相关疾病的基础研究。
李吉平(Email:drlijiping@163.com)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20150617.0956.027.html
cytometry analysis showed the apoptosis rate after Nrf2 depletion was increased from 17.1%to 26.6%.Conclusion This study demonstrates that Nrf2 siRNA effectively inhibits Nrf2 gene expression in Hep2 cells leading to growth suppression and induction of apoptosis in Hep2 cells under cisplatin.The use of siRNA technique may provide a novel therapeutic approach to treat laryngeal cancer for enhance chemosensitivity.
