老年性聋患者言语半球优势的功能磁共振成像研究
2015-03-17邓意红陈贤明梁永辉王翠霞罗萍
邓意红陈贤明梁永辉王翠霞罗萍
·临床研究·
老年性聋患者言语半球优势的功能磁共振成像研究
邓意红1,2,3陈贤明1梁永辉1王翠霞1罗萍1
目的 应用血氧水平依赖功能磁共振成像(blood oxygenation level dependent-functional magnetic resonance imaging,BOLD-f MRI)研究老年性聋患者言语声刺激下听觉皮层激活的半球优势及耳别优势的变化。方法 选取18例健康青年志愿者(青年组)、10例正常听力老年人(老年组)及10例老年性聋患者(老年性聋组)为研究对象,分别进行单音节言语任务下的f MRI检测,刺激声频率为1 k Hz,声强90±3 dB SPL,进行大脑激活偏侧性分析,以偏侧化指数(laterality inelex,LI)表示,LI≥0.20为左侧大脑半球优势,LI≤-0.20为右侧大脑半球优势,-0.20≤LI≤0.20为双侧大脑半球优势;观察老年性聋患者半球优势变化(或耳别优势变化)。结果 青年组左、右耳分别刺激时,偏侧化指数分别为-0.58、0.37;老年组左、右耳分别刺激时,偏侧化指数分别为-0.24、0.28,老年性聋组左、右耳刺激时,偏侧化指数分别为-0.18、0.25。左、右耳行听觉任务时,青年组耳别优势为1:2.06,表现为右耳(左脑)优势;老年组为1:1.51,老年性聋组为1:1.61,右耳优势减弱。结论 青年人单耳刺激大脑皮层的激活存在明显的偏侧性,表现为对侧半球传导优势,并以左耳的对侧化传导更明显,衰老与耳聋后听皮层存在功能重组,出现对侧半球传导优势减弱的趋势。青年人行听觉任务时表现为右耳(左脑)优势,衰老后右耳优势减弱(左耳劣势增强),而这种变化可能是老年人言语识别能力下降的原因之一。
老年性聋; 言语; 听皮层; 功能磁共振成像; 偏侧化
人的大脑有两个半球,由于胼胝体的连接,左、右两个半球的信息可在瞬间进行交流,因此,正常人的大脑是作为一个整体而起作用的,在加工不同类型的信息时,左右两侧半球又表现出不同的优势性,如:语言的处理主要在左侧半球,音乐的处理主要在右侧半球。听皮层中枢对言语分辨能力有着重要的作用,以往的脑磁图研究发现老年人在激活时间、程度和空间位置方面均发生了重组[1]。随着年龄的增长,老年人常出现言语识别功能减退,可能与老年人听皮层发生功能重组影响半球优势有关。血氧水平依赖功能磁共振成像(functional magnetic resonance imaging,BOLD-f MRI)技术不仅能动态观察大脑在不同功能状态下听皮层及相关脑区的激活变化,还可提供精确的解剖定位和病理信息,为听皮层在不同功能状态下半球优势的研究提供了可靠的方法。本研究采用言语声进行听觉任务的脑部功能磁共振成像研究,分析衰老、耳聋对皮层功能的影响,探讨衰老引起言语识别能力下降的可能中枢机制。
1 资料与方法
1.1 研究对象 研究对象为18例健康青年志愿者(青年组),男11名,女7名,年龄23~28岁,平均25±1.32岁;10例正常听力老年人(老年组),男6例,女4例,年龄60~70岁,平均66±1.76岁,125~8 000 Hz平均纯音听阈≤25 dB HL;10例老年性聋患者(老年性聋组),男5例,女5例,年龄60~70岁,平均64±2.16岁,耳聋时间为1~5年,平均3.6年,耳聋分级按WHO1997年标准,其程度均为轻度聋(26~40 dB HL),平均听阈左耳35±4.08 d B HL,右耳34.5±4.38 d B HL。三组受试者外耳道、鼓膜均正常,声导抗检测示中耳功能正常,均无眩晕等前庭系统症状,无神经、精神疾病,无认知障碍及全身其他疾病,均为右利手。本研究获得南京军区福州总医院伦理委员会批准。每位受试者于磁共振检查前均清楚地了解测试方法、目的及相关知识,并签署知情同意书。
1.2 听觉言语刺激材料及方法 选择郗昕等[2]编制的《普通话言语测听——单音节识别率测试》材料,经Adobe Audition3.0软件剪辑、转换,编辑单纯左声道及单纯右声道各30组,每组持续时间20 s,含5个单音节词,词间的间隔时间为4 s。言语声频率为1 k Hz,声强为90±3 d B SPL(每个词的声强与总体平均声强差不超过3 d B)。声音由电脑输出至磁共振专用听觉刺激装置,通过磁共振兼容的气动式耳机(声发生器位于磁场外)传到受试者双耳,并于耳机周围垫以海绵。
通过E-Prime软件编制刺激程序,分别随机为左耳、右耳施加单纯左声道(Le)、单纯右声道
(Re)刺激声,每组声音循环两次,每次刺激持续时间10 TR(TR=2 s);对照状态时不施加声音刺激,简写为S,持续时间10 TR;扫描90 TR,持续时间3 min。受试者在接受检查前先试听实验所用刺激声音,正式实验后前20秒为适应时期,不计入数据处理。整个扫描过程中受试者保持身体静止不动,均匀呼吸,自然闭上眼睛;集中精力听耳机发出的声音,注意听汉字并尽可能听懂是什么词,但不能发出声音,不做其他的思维活动。
1.3 f MRI检查 采用Siemens Magnetom Verio Tim 3.0T磁共振机,全身扫描仪及头部正交线圈。所有受试者定位后进行3D像及f MRI扫描,扫描参数如下:①全脑3D像:快速梯度回波序列,T1加权SPGR序列采集矢状位,包括所有的大脑和小脑半球。TR 6.5 ms,TE 2.8 ms,FA 20度,层厚1.3 mm,无间隔扫描,FOV 240 mm×240 mm,扫描矩阵256 mm×256 mm。②f MRI的采集参数:采用TR T2加权EPI序列,TR 2 000 ms,TE 40 ms,FA 90度,层厚5 mm,间距1.5 mm,FOV 240 mm× 240 mm,扫描矩阵64 mm×64 mm;20层连续扫描以覆盖全脑,采集时相与刺激内容相对应,共采集90 TR,时间3 min。
本试验选用言语声作为刺激声,言语声是复杂声音,初级、次级听觉皮层与言语中枢均参与言语的处理,本实验选择颞横回、颞上回等广义听皮层所在区域作为感兴趣区,比较其偏侧化指数、耳别优势。激活范围阈值设定为30个体素,即连续激活体素数达到30个以上的区域被认为是有意义激活区,对脑激活区定位,计算感兴趣脑区(region of interest,ROI)激活体素,计算偏侧化指数(laterality index,LI),公式为:LI=(Lv-Rv)/(Lv+Rv);Lv、Rv分别为左、右两侧ROI的激活体积[3,4]。LI≥0.20提示左侧大脑半球优势,LI≤-0.20提示右侧大脑半球优势,-0.20≤LI≤0.20提示双侧大脑半球优势[5]。分析耳别优势(ear advantage,EA),EA=LeBv:ReBv,LeBv为左耳行听觉任务时两侧ROI激活总体积,ReBv为右耳行听觉任务时两侧ROI激活总体积,数值大者为耳别优势侧。
1.4 统计学方法 在Matlab平台上的SPM5软件包进行离线后处理。预处理包括数据转换、时间对齐、运动校正、空间标准化和空间平滑处理,其中三维平移超过1 mm、三维旋转度超过1度的数据视为头动过大,予以舍弃(青年组中有2例头动过大,数据予以舍弃);空间标准化结果为Talairach坐标系下的体素集。经过预处理后,对符合要求的受试者数据进行组内分析,组内分析采用单样本t检验获得三组的单耳听觉任务时组内平均脑激活图。统计阈值P<0.001(未校准),在SPSS20.0统计软件下,采用单因素方差分析,完成三组间ROI激活体积比较及偏侧性分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组间激活的半球优势偏侧性比较 青年组左、右耳分别给言语声刺激时,偏侧化指数分别为-0.58、0.37(图1),正常听力老年组左、右耳分别刺激时偏侧化指数分别为-0.24、0.28(图2),老年性聋患者左、右耳分别刺激时偏侧化指数分别为-0.18、0.25(图3)。各组左、右耳言语声刺激时左、右半球激活体素及LI值见表1。
2.2 各组间激活的耳别优势比较 青年组左、右耳给言语声刺激时,耳别优势为1:2.06,表现为右耳优势(左脑优势);老年组为1:1.51,老年性聋组为1:1.61,可见老年组和老年性聋组右耳优势减弱(表1)。
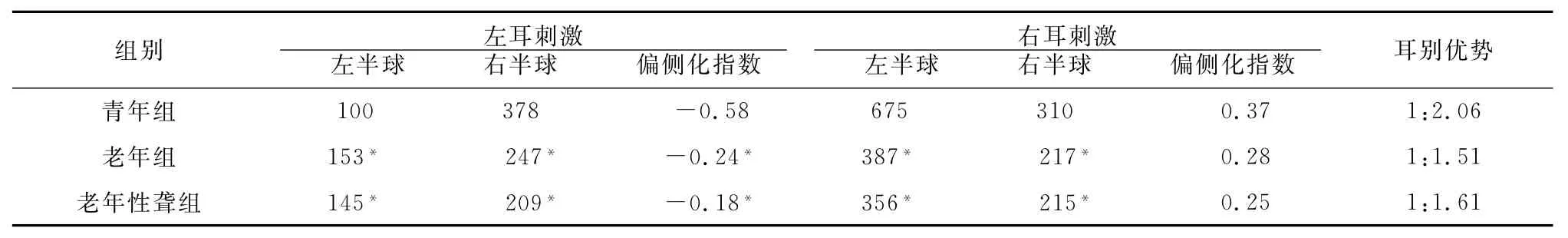
表1 各组左、右耳分别给声刺激时左、右半球激活体素(个)△、偏侧化指数及耳别优势比较
3 讨论
听觉系统的f MRI研究的重要问题是MR扫描噪声问题,扫描噪声血流动力学反应使组块式MR功能设计模式的基线信号增加,从而使施加的外界刺激引起的血流动力学变化测量起来更加困难[6]。另一方面连续长时间暴露于这种噪声,会分散受试者注意力,出现适应效应,使BOLD信号变化下降,影响脑功能成像。Shah等[7]研究表明将复杂的背景噪声与施加的声音刺激分开,涉及到耳蜗及听皮质复杂的相互作用(即耳蜗掩蔽),掩蔽效应多在800~1 200 Hz频率范围内,可干扰1 k Hz的纯音刺激[8]。而且MR扫描噪声结束后,耳蜗掩蔽效应仍持续存在,此期间耳蜗对新刺激的反应力低,这是因为耳蜗神经纤维存在400 ms的恢复期,MR扫描噪声越大,这种恢复期持续时间越长[9]。MR扫描噪声对简单、复杂的声音刺激的影响不同,耳蜗主要负责纯音的分辨,而听皮质则主要负责复杂声音刺激的处理。日常生活中,言语是人们交流的主要方式,并且言语频率多在500~2 000 Hz。为更好地反映听皮层的功能状态,减少听皮质和耳蜗同时处理外加刺激,因而本研究采用的刺激声频率是居中的言语频率段,即1 k Hz言语刺激声,与1 k Hz的纯音不同,该刺激声可被受试者清晰地感受到;另外为进一步抑制背景噪声,本试验扫描时辅以耳机周围垫海绵以使耳机与耳廓周围皮肤紧密接触,减少受试者出现的适应效应。
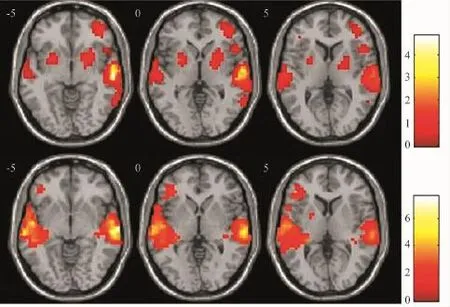
图1 青年组分别行左耳(上行)、右耳(下行)听觉任务时的平均脑激活图

图2 老年组分别行左耳(上行)、右耳(下行)听觉任务时的平均脑激活图
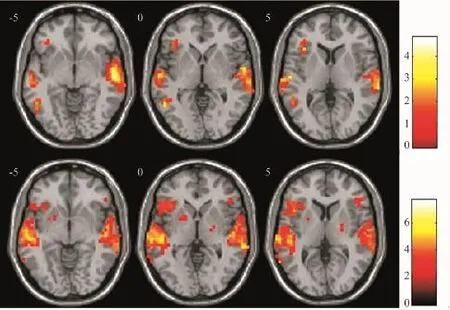
图3 老年性聋组分别行左耳(上行)、右耳(下行)听觉任务时的平均脑激活图
听皮层不仅存在着结构的不对称性,也存在功能的不对称性。一侧耳的投射纤维30%上行到同侧半球,而70%上行到对侧半球,即神经纤维主要交叉到对侧,从而导致了刺激耳对侧的听觉中枢激活程度及范围超过刺激同侧的听觉中枢。研究结果证实,对于单侧刺激,听力正常者刺激耳对侧皮层有很强的一侧化反应(对侧激活幅度大于同侧激活幅度)[10~13]。本研究中正常听力青年人单耳行听觉任务刺激时刺激耳对侧听皮层的激活体积与强度明显大于同侧,表现为对侧半球传导优势,偏侧化指数分别为-0.58(左耳刺激)、0.37(右耳刺激),与上述大部分研究结果一致。
各种原因引起的耳聋都可以导致皮层投射和/或皮层下结构的重组,而这种重组可导致半球优势的改变。关于耳聋引起皮层功能重组的研究最多的就是单侧感音神经性聋,Tschopp等[14]对14例长期单侧耳聋患者予以1 k Hz纯音刺激时,听皮质反应亦存在着同侧半球优势;陈贤明等[15]利用磁共振波谱研究突发性聋患者听皮层的激活情况,发现这类人群听皮层的激活亦为同侧半球为主;电生理的研究结果显示:耳聋3周内听皮质对纯音的刺激表现为对侧半球优势,而随着耳聋时间的延长,则表现为同侧半球优势[16,17]。随着年龄的增长,听觉中枢及以下核团神经元发生退行性病变以致数量减少[18],这会直接影响到任务刺激时BOLD信号的变化。Piefke等[19]利用功能磁共振分别对青年人及老年人施以视觉工作记忆任务,发现青年人明显激活左侧半球,而老年人对等地激活双侧大脑的背外侧,右侧半球的激活明显增加;说明随着年龄的增长,大脑皮层发生了功能重组,并且还会使半球优势发生改变,表现为对侧优势减弱,而同侧优势增强。文中结果显示正常听力老年人与老年性聋患者单耳刺激时,两侧ROI激活偏侧化指数较青年人明显降低,甚至老年性聋组左耳刺激时表现出无偏侧性。这是由于老年性聋集合了衰老与耳聋的双重因素,并且皮层功能的重组并非从耳聋后才出现,而是从衰老时就已经开始,因此,与听力正常老年人相比老年性聋患者大脑皮层更易发生功能重组。若今后对同一年龄组不同听力障碍程度的老年性聋者进行听觉中枢功能的评估,可能可更好地解释耳聋与衰老对皮层中枢功能重组的影响。
左侧大脑半球是语言的优势半球,以往研究发现采用简单的声音刺激大多以右侧听觉皮层激活为主,而采用相对复杂的声音,尤其是涉及到语音的刺激常常以左侧听觉皮层激活更明显[20,21]。本研究采用言语刺激声,结果示青年组右耳接受声刺激时双侧听觉皮层激活体积较左耳接受声刺激高,耳别优势体积比(LeBv:ReBv)为1:2.06,说明大脑对语言的处理表现为右耳(左脑)优势,这与过去行为学上的双耳分听、Wada实验、脑功能成像研究结果一致;但是老年组与老年性聋组耳别优势体积比(LeBv:ReBv)分别为1:1.51、1:1.61,较青年组降低,说明随着年龄的增长,由于听觉中枢的老化,出现右耳优势减弱(或左耳劣势增强),这与过去的双耳分听试验结果一致[19,22]。
综上所述,随着衰老的出现,老年性聋患者与正常听力老年人大脑皮质存在着逐渐加重的退行性改变,从而发生功能重组,这种重组一方面表现在行听觉性言语任务时脑激活体积与信号强度减低,另一方面表现在半球优势的对侧化传导减弱。依据BOLD-f MRI原理[23],激活体积与信号强度减低反映了中枢神经细胞被激活的数量减少和程度下降;另外,两半球功能信息进行交流通过胼胝体的连接而实现,对侧化传导程度受同侧与对侧激活程度的影响,本研究发现对侧化传导优势减弱并非因为同侧激活增强,而主要是对侧皮层激活减弱引起,这说明衰老后胼胝体的连接减少了。老年人即使听力正常,也常存在言语识别障碍,说明衰老后皮层功能重组可引起言语识别障碍;同样,耳聋也可导致皮层功能的重组,老年性聋集合了衰老与耳聋的双重因素,因此,老年性聋患者大脑皮层较听力正常老年人更易发生功能的重组。文中结果显示,两组老年人之间左、右耳给言语声刺激时,左、右大脑半球激活体积差异不大,说明轻度老年性聋患者皮层功能的重组可能主要是由衰老引起。
除了双耳对称性听力减退外,老年性聋者还存在言语交流困难,表现为能听见说话的声音,但却不能理解其意思。本研究发现左、右耳给言语声刺激时,老年人较青年人大脑皮层激活偏侧性明显减弱,提示老年人除了耳蜗病变外,还存在听觉中枢的改
变,这可能是影响老年人言语识别障碍的原因。
1 苗英章,王宝山,孙吉林,等.老年人大脑听觉皮质功能区老化的神经磁学研究[J].中国临床康复,2006,10:10.
2 郗昕,冀飞.普通话言语测听-单音节识别率测试[CD].北京:解放军卫生音像出版社,2009.
3 Gaillard WD,Balsamo L,Xu B,et al.f MRI language task panel improves determination of language dominance[J].Neurology,2004,63:1403.
4 Ruff IM,Petrovich BNM,Peck KK,et al.Assessment of the language laterality index in patients with brain tumor using functional MR imaging:effects of thresholding,task selection,and prior surgery[J].Am J Neuroradiol,2008,29:528.
5 Gaillard WD,Balsamo L,Xu B,et al.Language dominance in partial epilepsy patients identified with an f MRI reading task[J].Neurology,2002,59:256.
6 Moelker A,Pattynama PM.Acoustic noise concerns in functional magnetic resonance imaging[J].Hum Brain Mapp,2003,20:123.
7 Shah NJ,Steinhoff S,Mirzazade S,et al.The effect of sequence repeat time on auditory cortex stimulation during phonetic discrimination[J].Neuroimage,2000,12:100.
8 Di SF,Formisano E,Seifritz E,et al.Functional fields in human auditory cortex revealed by time-resolved f MRI without interference of EPI noise[J].Neuroimage,2001,13:328.
9 Heil P,Rajan R,Irvine DR.Topographic representation of tone intensity along the isofrequency axis of cat primary auditory cortex[J].Hear Res,1994,76:188.
10 Langers DR,Backes WH,van Dijk P.Representation of lateralization and tonotopy in primary versus secondary human auditory cortex[J].Neuroimage,2007,34:264.
11 Langers DR,van Dijk P,Backes WH.Lateralization,connectivity and plasticity in the human central auditory system[J].Neuroimage,2005,28:490.
12 Menendez-Colino LM,Traserra J,Falcon C,et al.Results of a functional magnetic resonance study of the primary auditory cortex(I):general characteristics and individual outcomes[J].Acta Otorrinolaringol Esp,2009,60:160.
13 Jancke L,Wustenberg T,Schulze K,et al.Asymmetric hemodynamic responses of the human auditory cortex to monaural and binaural stimulation[J].Hear Res,2002,170:166.
14 Tschopp K,Schillinger C,Schmid N,et al.Detection of central auditory compensation in unilateral deafness with functional magnetic resonance tomography[J].Laryngorhinootologie,2000,79:753.
15 陈贤明,梁永辉,陈自谦,等.突发性聋患者急性期听皮层代谢1H-MRI研究[J].听力学及言语疾病杂志,2011,19:525.
16 Bilecen D,Seifritz E,Radu EW,et al.Cortical reorganization after acute unilateral hearing loss traced by f MRI[J].Neurology,2000,54:765.
17 Tschopp K,Schillinger C,Schmid N,et al.Detection of central auditory compensation in unilateral deafness with functional magnetic resonance tomography[J].Laryngorhinootologie,2000,79:753.
18 Sha SH,Kanicki A,Dootz G,et al.Age-related auditory pathology in the CBA/J mouse[J].Hear Res,2008,243:87.
19 Piefke M,Onur OA,Fink GR.Aging-related changes of neural mechanisms underlying visual-spatial working memory[J].Neurobiol Aging,2012,33:1284.
20 Illes J,Francis WS,Desmond JE,et al.Convergent cortical representation of semantic processing in bilinguals[J].Brain Lang,1999,70:347.
21 季倩,郑凯尔,陈峰,等.正常人及脑肿瘤患者听觉性中英文语言刺激的f MRI研究[J].实用放射学杂志,2007,23:886.
22 Brauer J,Neumann J,Friederici AD.Temporal dynamics of perisylvian activation during language processing in children and adults[J].Neuroimage,2008,41:1484.
23 Magistretti PJ,Pellerin L,Rothman DL,et al.Energy on demand[J]Science,1999,283:496.
(2014-04-21收稿)
(本文编辑 李翠娥)
fMRl Study of Speech Processing in Presbycusis Patients
Deng Yihong*,Chen Xianming,Liang Yonghui,Wang Cuixia,Luo Ping
(*Department of Otolaryngology Head and Neck Surgery,Fuzhou General Hospital of PLA,Fuzhou,350025,China)
Objective To study the brain functional activation under speech stimulation in presbycusis patients using blood oxygenation level dependent functional magnetic resonance imaging(BOLD-f MRI).Methods Eighteen normal hearing young volunteers,10 normal hearing elderly people and 10 presbycusis patients received f MRI under auditory task.Experimental tasks included monosyllabic verbal stimulating at tone of 1 k Hz and sound intensity to 90 dB±3 dB(after ambient noise detector Smart Sensor AR844 measurement and calibration)randomly transmitted to left and right ear.Following block design,each stimulus was repeated twice.The lateralization of brain activation analysis observed changes in hemispheric dominance cases(or ear advantage change).We observed brain activation analysis and changes of hemispheric lateralization advantage(or ear advantages).SPM5 software was used to deal with the original pictures in the off-line work station to get fictional maps,volume and intensity of the activated brain regions of interest,and calculate the laterality index(LI).Results To young people,regardless of left or right ear stimulation,the contralateral(region of intrest,ROI)activation volume and intensity significantly increased compared to ipsilateral,appearing contralateral hemispheric dominance,and laterality index were-0.58(left ear stimulation)and 0.37(right ear stimulation).Compared to young people,elderly people with normal hearing and presbycusis contralateral hemisphere conduction advantage was significantly reduced under monaural stimulation,and the laterality indexes were-0.24,0.28(the aged group),-0.18,0.25(presbycusis group).Young people received the left and the right ear auditory task respectively,and the ratio of the total volume of bilateral ROI activation was 1:2.06,appearing to the right ear advantage(left brain dominance).While the aged and presbycusis group manifested as right ear advantage decreased(left ear advantage enhanced),whose the total volume ratio was 1:1.51 for the old normal subjects and 1:1.61 for the hearing impaired seniors.Conclusion Auditory verbal tasks activated brain regions in the superior temporal gyrus and middle temporal gyrus were most obvious.Aging may cause these brain regions to be activated weaker,appearing to the trend of contralateral hemisphere.The aging and deafness lead to the cortical reorganization.This may be one of the reasons for the declined speech recognition.
Presbycusis; Speech; Auditory cortex; f MRI; Laterality
10.3969/j.issn.1006-7299.2015.04.008
时间:2015-3-3 14:39
R764.43+6
A
1006-7299(2015)04-0361-06
1 南京军区福州总院耳鼻咽喉头颈外科(福州 350025); 2 福建医科大学福总临床学院; 3 佛山市禅城区中心医院
邓意红,女,湖南人,硕士,主要从事耳鼻咽喉科临床工作。
陈贤明(Email:fzchxming@sina.com)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20150303.1439.030.html
