基于核糖体RNA ITS1-5.8S-ITS2基因序列的十二指肠钩虫分子系统发育分析
2015-03-17汪家旭苏成豪黄建炜李国伟
汪家旭,苏成豪,黄建炜 ,叶 曦,李国伟
基于核糖体RNA ITS1-5.8S-ITS2基因序列的十二指肠钩虫分子系统发育分析
汪家旭1,苏成豪1,黄建炜1,叶 曦2,李国伟2
目的 通过克隆十二指肠钩虫的ITS1-5.8S-ITS2,初步分析钩口属的系统发育,构建基于ITS1、ITS2的圆线目线虫的系统进化树,为进一步研究其遗传进化关系奠定基础。方法 从厦门海沧东孚镇收集标本,分离,形态鉴定为十二指肠钩虫,分别克隆了供试钩虫的ITS1-5.8S-ITS2序列,经NCBI网站的BLAST比对以及基于ITS1和 ITS2序列的钩口属的系统发育分析。结果 供试钩虫的ITS1、5.8S和ITS2序列,它们的长度分别为366 bp、153 bp和221 bp,登陆http://www.ncbi.nlm.nih.gov进行BLAST,在数据库中没有与之相匹配的序列,将获得的序列作为新的序列上传至GenBank中进行注册,各序列的GenBank登录号分别为:5.8S rRNA基因:EU344796、ITS1-5.8S-ITS2: EU344797。结论 从系统进化树中,本实验的供试十二指肠钩虫均与GenBank中已公布的十二指肠钩口线虫自然聚类在一起。
十二指肠钩虫;ITS1-5.8S-ITS2基因; 系统发育分析
Supported by the Key Construction Project Fund of the Xiamen Medical Center (No. [2012]285)
真核生物细胞核的核糖体RNA基因簇在不同的真核生物中存在于不同的染色体上[1],真核生物细胞核的核糖体RNA基因簇中的串联重复序列,在进化上表现出相当的一致性,并且在种内的独特性序列的同质性相对较高,但其它非独特性序列仍有一定的差异性[2]。本文试验标本源自厦门市海沧区东孚镇纯十二指肠钩虫感染者,首先克隆分离株5. 8 SrDNA基因、ITS1和ITS2的完整序列;然后,利用ITS1和ITS2的序列进行虫种的分子鉴定以及分析钩口属常见钩虫的系统发育关系,结果报告如下。
1 材料与方法
1.1 供试虫种 结合人体肠道寄生虫的年度常规粪检普查,收集海沧区东孚镇洪塘村钩虫感染患者粪便,按常规“T”试管滤纸培养法,于27 ℃恒温箱,获得试验所需钩蚴。经幼虫形态学鉴定为纯十二指肠感染患者。收集的十二指肠钩蚴用PBS或生理盐水(pH 7.3)洗涤3遍, 无水乙醇洗涤3遍,-20 ℃或-70 ℃保存备用。
1.2 细菌菌株及质粒 大肠杆菌(Escherichiacoli)DH5α菌株由本室保存,TA克隆载体pMD18-T及其试剂盒购自TAKALA公司。
1.3 引物 参照文献[3]设计扩增钩虫18S rRNA基因的引物:NC18SF1 5’-AAAGATT A GCCATGCA-3’ (forward)和NC5BR 5’-GCAGGTTCACCTACAGAT-3’ (reverse)。参照文献[4]设计扩增钩虫ITS1-5.8S-ITS2基因的引物:NC16 5’-AGTTCAAT CGCAATGGCTT-3’ (forward)和NC2 5’-TTAGTTTCTTTTCCTCCGCT-3’ (reverse) 。用于菌落PCR筛选的引物为TA克隆载体pMD18-T的通用引物M13-47:5’-CGCCAGGGTTTTCCCAGTCACGAC-3’(forward)和RV-M:5’-GAGCGGA TAACAATT TCACACAGG-3’(reverse)。测序引物为M13-47和RV-M。
1.4 钩虫基因组DNA粗提物的制备 钩虫基因组DNA粗提物的制备参照Subbotin等[5]的方法并稍作修改。
1.5 钩虫ITS1-5.8S-ITS2基因的克隆 PCR扩增钩虫ITS1-5.8S-ITS2基因的引物为NC16和NC2,模板为上述钩虫基因组DNA粗提物。PCR的反应条件均为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,循环数30;72 ℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳鉴定。
1.6 PCR扩增产物 PCR扩增产物按Gel extraction kit的操作指南进行纯化、连接、转化、菌落PCR筛选等。菌落PCR反应为阳性的克隆,加适量含30%甘油和Amp(100 μg/mL)的LB培养液,于-70 ℃冷冻保藏。选取阳性克隆2个,送上海英俊公司测序。
1.7 基于ITS区的钩虫种类的分子鉴定 测序后得到的供试钩虫样品的ITS1-5.8S-ITS2序列,通过NCBI网站的nucleotide blast程序进行比对分析,根据最高同源性原则,分别确定供试钩虫样品的ITS1、5.8S和ITS2序列;然后,用生物软件Clustalx 1.8对供试钩虫的ITS1和ITS2序列与从GenBank中搜寻的其他钩口属线虫的ITS1和ITS2序列进行比对分析;最后,通过生物软件MEGA 3.1[6]分别构建基于ITS1和ITS2序列的钩口属线虫的系统进化树,并根据与供试钩虫亲缘关系最近GenBank中已公布的钩虫种类来判断供试钩虫样品的种类。
1.8 圆线目的系统发育分析 分别从GenBank中搜寻圆线目线虫的ITS1、ITS2序列,分别编辑为适合生物软件Clustalx 1.8和MEGA 3.1分析的文件形式。先用Clustalx 1.8软件进行比对分析,然后,用MEGA 3.1软件分别构建基于ITS1、ITS2的圆线目线虫的系统进化树。
2 结 果
2.1 钩虫 ITS1-5.8S-ITS2基因的PCR扩增 以NC16和NC2为引物,以基因组DNA粗提物为模板,PCR扩增钩虫的ITS1-5.8S-ITS2基因。如图1所示,在约900 bp处均有一条特异的扩增条带,与预期的片段大小相符合。
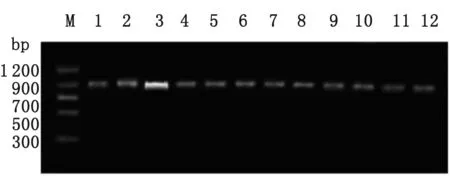
M: DNA marker.
图1 钩虫ITS1-5.8S-ITS2基因的PCR扩增
Fig.1 PCR amplification of ITS1-5.8S-ITS2 gene of hookworm
2.2 菌落PCR筛选与测序分析 ITS1-5.8S-ITS2基因的PCR扩增产物与pMD18-T的连接产物转化大肠杆菌DH5α,经蓝白斑筛选后,先分别挑取9个白色菌落于LB培养液中进行培养;然后,分别制备用于菌落PCR的模板;最后,用pMD18-T载体的通用引物M13-47和RV-M,进行菌落PCR筛选。从图2可以看出,在ITS1-5.8S-ITS2重组子的菌落PCR筛选中,除了5和7号克隆为阴性外,其余克隆均为阳性,将其中的1和3号送上海英俊公司测序,测序引物为M13-47。
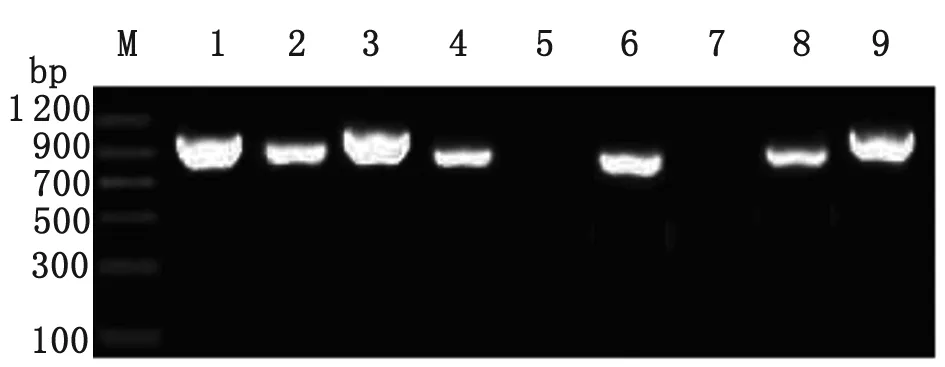
M: DNA marker;PCR products of bacterium colony 1-9, respectively.
图2 ITS1-5.8S-ITS2重组子的菌落PCR筛选
Fig.2 Screening of ITS1-5.8S-ITS2 recombinants by bacteria colonies PCR
测序获得的序列全长836 bp,通过NCBI网站的nucleotide blast程序进行比对分析,根据最高同源性原则,分别确定供试钩虫样品的ITS1、5.8S和ITS2序列,结果见图3。从图3可以看出,克隆到的供试钩虫的ITS1和ITS2的序列与已公布的十二指肠钩口线虫的同源性分别为99%和100%。
根据比对结果,本研究克隆到的ITS1-5.8S-ITS2序列的结构组成如图4所示,从图中可以看出,克隆到的供试钩虫的5.8S rDNA、ITS1和ITS2的长度分别为153 bp、366 bp和221 bp。

图3 供试钩虫ITS1和ITS2序列的BLAST比对结果

The sequences of ITS1, 5.8S rRNA and ITS2 were indicated, respectively.
2.3 用于钩虫种类分子鉴定的ITS1和ITS2序列 运用NCBI网站的CoreNucleotide程序,从GenBank+EMBL+DDBJ+PDB数据库中分别搜寻到已公布的5种钩口属线虫的ITS1和ITS2序列,同时以1种板口属线虫作为群外种(见表1)。

表1 ITS1和ITS2序列被用于分子鉴定的钩虫种类
2.4 钩虫种类的分子鉴定与钩口属系统发育分析 先用生物软件Clustalx 1.8对供试钩虫的ITS1和ITS2序列与从数据库中搜寻到的其他钩虫的ITS1和ITS2序列进行多序列比对分析。然后,通过生物软件MEGA 3.1,采用邻接法分别构建基于ITS1和ITS2序列的钩口属线虫的系统进化树。其中,采用的取代模型为Nucleotide:p-distance,间隙区采用完全删除的方式,并以美洲板口线虫线虫作为群外种。最后通过自举分析进行置信度检测,自举数据集为1 000次。

A , B: The phylogenetic relationships of the genusAncylostomainferred from ITS1 and ITS2 sequences, respectively.
图5 钩虫种类的分子鉴定与钩口属系统发育分析
Fig.5 Molecular identification of species of hookworm and phylogenetic analysis of Genus:Ancylostoma
基于ITS1和ITS2序列的钩口属线虫的系统进化树,分别如图5 A和B所示。在两支系统进化树中,本实验的供试钩虫均与GenBank中已公布的十二指肠钩口线虫自然聚类在一起,因此,可以判定供试钩虫为十二指肠钩口线虫。
3 讨 论
3.1 供试钩虫的ITS1-5.8S-ITS2克隆 本研究利用扩增线虫rDNA的通用引物,克隆了供试钩虫的ITS1-5.8S-ITS2。将获得的序列在GenBank中进行注册,各序列的GenBank登录号分别为:5.8S rRNA基因为EU344796、ITS1-5.8S-ITS2 为EU344797。
由于实验过程中,钩虫虫体无法大量获得,因此不能按常规的酚-氯仿抽提法提取供试钩虫的基因组DNA。作者采用的做法是制备微量的钩虫基因组DNA粗提物,即将少量的钩虫幼虫虫体撕裂成数断;转入200 μL的Eppendorf 管中,加入线虫裂解缓冲液,利用液氮罐,将虫体反复冻融使虫体破裂;最后通过蛋白酶 K 的消化作用,使钩虫基因组DNA释放出来;经离心,上清即为钩虫基因组DNA粗提物。实验结果证实,上述方法可以获得符合要求的钩虫的基因组DNA。
克隆到的ITS1-5.8S-ITS2序列全长836bp,通过NCBI网站的nucleotide blast程序进行比对分析,结果表明,供试钩虫的ITS1和ITS2的序列与分别为99%和100%(图3)。ITS1序列与已公布的十二指肠钩口线虫的同源性没有达到100%,可能是不同地理株系之间在ITS1区具有遗传多样性。根据最高同源性原则,分别确定供试钩虫的ITS1、5.8S和ITS2序列,它们的长度分别为366 bp、153 bp和221 bp(图4)。
3.2 基于ITS1和ITS2序列的钩虫种类的分子鉴定与钩口属系统发育分析 分别以ITS1和ITS2序列对5种钩口属线虫进行属内系统发育分析,同时以1种板口属线虫作为群外种。从两支系统进化树中(图5A和B)可以看出,本实验的供试钩虫均与GenBank中已公布的十二指肠钩口线虫自然聚类在一起,因此,可以判定供试钩虫为十二指肠钩口线虫。
在基于ITS1和ITS2序列所构建的2个系统进化树中,钩口属的5种线虫被聚类为2个姐妹群,其中,十二指肠钩口线虫、犬钩口线虫和猫钩口线虫组成1个类群,巴西钩口线虫和锡兰钩口线虫组成另1个类群。这些结果说明,十二指肠钩口线虫与犬钩口线虫的亲缘关系最近,其次是猫钩口线虫;而巴西钩口线虫和锡兰钩口线虫的亲缘关系最近。
[1]Indik ZK, Tartof KD. Long spacers among ribosomal genes ofDrosophilamelanogaster[J]. Nature, 1980, 284(5755): 477-479.
[2]Hills DM, Dixon MT. Ribosomal DNA: molecular evolution and phylogenetic inference[J]. Quarterly Rev Biol, 1991, 66(4): 411-453.
[3]Chilton NB, Huby-Chilton F, Gasser RB. The evolutionary origins of nematodes within the order Strongylida are related to predilection sites within hosts[J]. Mol Phylogenetics Evol, 2006, 40(1): 118-128.
[4]Chilton NB, Huby-Chilton F, Gasser RB. First complete large subunit ribosomal RNA sequence and secondary structure for a parasitic nematode: phylogenetic and diagnostic implications[J]. Mole Cell Probes, 2003, 17(1): 33-39.
[5]Subbotin SA, Vierstraete A, De Ley P. Phylogenetic relationships within the cyst- forming nematodes (Nematoda: Heteroderidae) based on analysis of sequences from the ITS Regions of ribosomal DNA[J]. Mol Phylogenetics Evol, 2001, 21(1): 1-16.
[6]Kumar S, Tamura K, Nei M. MEGA3: Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment[J]. Brief Bioinformatics, 2004, 5: 150-163.
[7]Hotez PJ, Hawdon J, Schad GA. Hookworm larval amphiparatenesis: theCaenorhabditiselegansDaf-c paradigm[J]. Parasitol Today, 1993, 9: 23-26.
[8]Hawdon JM, Jones BF, Homan DR, et al. Cloning and characterization ofAncylostoma-secreted protein. A novel protein associated with the transition to parasitism by infective hookworm larvae[J]. Biolog Chem, 1996, 22: 6672-6678.
[9]Hawdon JM, Datu B. The second messenger cyclic GMP mediates activation inAncylostomacaninuminfective larvae[J]. Int Parasitol, 2003, 33: 787-793.
[10]Zhan B, Liu Y, Badamchian M, et al. Molecular characterization of theAncylostoma-secreted protein (ASP) family from the adult stage ofAncylostomacaninum[J]. Int Parasitol, 2003, 33: 897-907.
Molecular phylogenetic analysis ofAncylostomaduodenalesbased on ITS1-5.8SrRNA-ITS2 gene sequence
WANG Jia-xu1,SU Cheng-hao1,HUANG Jian-wei1,YE Xi2,LI Guo-wei2
(1.XiamenCenterforDiseaseControlandPrevention,Xiamen361021,China;2.CenterforDiseaseControlandPreventionofHaicangCity,Haicang361026,China)
ITS1-5.8S-ITS2 genes ofAncylostomaduodenaleswas cloned and sequenced in this study. We collected specimens from Dongfu Town, Haicang District, Xiamen City after morphological identification forAncylostomaduodenale. Hookworm ITS1-5.8S-ITS2 sequence was tested, and the length of ITS1, 5.8S and ITS2 sequences were 366 bp, 153 bp and 221 bp, respectively. The genes of 5.8S rRNA and ITS1-5.8S-ITS2 as new sequences were registered in GenBank, and their number was EU344796 and EU344797, respectively. Based on ITS1 and ITS2 sequence and phylogenetic analysis ofAncylostoma, results have further confirmed that above materials wasAncylostomaduodenales, and the molecular level were accordance well with that of morphological identification.
Ancylostomaduodenale; ITS1-5.8S-ITS2 gene; phylogenetic analysis
1.厦门市疾病预防控制中心,厦门 361021; 2.厦门市海沧区疾病预防控制中心,厦门 361026
10.3969/cjz.j.issn.1002-2694.2015.07.010
R383.1
A
1002-2694(2015)07-0640-05
2014-06-10;
2015-03-30
厦门市医学中心/重点专科建设项目基金(厦卫科教中医[2012]285号)
