香港海鸥形菌多重PCR及嵌合荧光PCR检测方法的建立与应用
2015-03-17沈林海孔庆鑫孙建荣韦凌娅王英红倪晓平
沈林海,孔庆鑫,孙建荣,徐 虹,金 慧,韦凌娅,查 捷,王英红,倪晓平
香港海鸥形菌多重PCR及嵌合荧光PCR检测方法的建立与应用
沈林海,孔庆鑫,孙建荣,徐 虹,金 慧,韦凌娅,查 捷,王英红,倪晓平
目的 建立香港海鸥形菌(Laribacerhongkongensis, LH)的多重PCR(multi-PCR)及嵌合荧光法(SYBR Green I)PCR检测方法,并对其在临床及环境微生物方面的应用前景进行评价。方法 通过对62株香港海鸥形菌16S RNA 基因和16S-23S rRNA基因间隔区(16-23S rRNA intergenic spacer region, ISR)进行PCR扩增和多序列比对,设计两对特异性引物,建立多重PCR体系,用15种细菌性腹泻标准菌株及临床菌株进行PCR特异性和敏感性检验;并在此基础上针对两对引物分别用嵌合荧光PCR法进行浓度梯度检测,以确定最低检测限。结果 香港海鸥形菌多重PCR法特异性为100%,最低检出限为5×103CFU/mL菌液;而嵌合荧光PCR法两对引物的最低检出限均达到5×102CFU/mL菌液。结论 该法的建立为临床及环境微生物学提供了一种快速和灵敏的香港海鸥形菌检测手段。
香港海鸥形菌;多重PCR;嵌合荧光PCR
香港海鸥形菌(Laribacerhongkongensis, LH)作为一种新的食源性腹泻病原菌, 2001年首次分离自中国香港的1例酒精性肝硬化患者的血液和胸腔脓液中[1]。随后在Woo PC等人开展的一项多中心病例-对照研究中,LH在腹泻病人及淡水鱼中均被分离检出,并被证实该菌与社区获得性腹泻和旅行性腹泻有关[2-3]。Marcos和Dupont将香港海鸥形菌与产肠毒素脆弱类杆菌、产酸克雷伯菌同时列入2004-2007年间新发现的3种引起人类急性细菌性腹泻的病原体[4]。2011年,韩国也在1例肝硬化病人的血液中首次分离到香港海鸥形菌[5]。
Lau等人对香港地区的自然水源进行调查,发现香港海鸥形菌能在淡水水源中生长[6],又在2007年对香港地区多种淡水生物开展香港海鸥形菌带菌调查,发现中国虎纹蛙也是LH的携带者[7]。我们于2005年始开展腹泻患者与淡水鱼的LH分离工作,于2005年11月在中国内地首次从一名社区获得性腹泻患者中分离到该菌[8],并从3种淡水鱼中分离到多株LH[9]。2006年,我们首次从涉禽小白鹭粪便样品中分离到LH,并证实小白鹭为LH的携带者,并可能造成LH在不同水源间的传播[10]。
香港海鸥形菌的分离和培养相对困难,目前还没有LH的商业化鉴定试剂,自动化鉴定系统也不能对其进行鉴定,16S rRNA基因测序技术被认为是细菌鉴定的金标准,能对大多数细菌进行快速和准确的鉴定,因此也被应用于香港海鸥形菌基因诊断[1,8]。然而,基于测序的细菌鉴定方法依赖昂贵的测序仪,并需要多个工作日,并不适用于香港海鸥形菌的常规诊断及其快速诊断,因此建立香港海鸥形菌快速、准确的分子诊断方法已势在必行。
1 材 料
1.1 菌株 62株香港海鸥形菌均由本实验室于2005-2007年间分离,其中10株分离自社区获得性腹泻患者粪便标本,12株分离自小白鹭粪便标本,40株分离自淡水鱼中后肠段拭子。所有菌株均经表型鉴定及16S RNA基因测序方法进行确诊[8]。
嗜水气单胞菌(ATCC 7966)、空肠弯曲杆菌(ATCC 33560)、鼠伤寒沙门氏菌(ATCC 14028)、宋内志氏志贺菌(ATCC 9290)、副溶血性弧菌(ATCC 17802)、脆弱拟杆菌(ATCC 25285)、白色念珠菌(ATCC 90028)、粪肠球菌(ATCC 29212)、克雷伯氏菌属(ATCC 13883)、变形杆菌(ATCC 12453)及艰难梭菌、大肠杆菌、类志贺邻单胞菌、痢疾志贺菌、福氏志贺菌等临床分离株均由澳大利亚Westmead医院感染性疾病与微生物研究中心提供。
1.2 主要仪器与试剂 普通PCR扩增仪、电泳系统和凝胶成像系统均为Bio-Rad公司产品;7500型荧光定量PCR仪为Applied Biosystems公司产品;基因组DNA提取试剂盒、PCR反应试剂购自德国Qiagen公司;SYBR Green I 嵌合荧光PCR试剂盒购自大连宝生物公司;引物由澳大利亚基因组研究设备有限公司合成。
2 方 法
2.1 菌株DNA提取 从麦康凯培养基上调取香港海鸥形菌单个菌落到LB琼脂平板上,37 ℃培养24 h后,用接种环挑取3~5个菌落用于细菌基因组DNA提取。
2.2 香港海鸥形菌LH ISR序列PCR扩增及测序 引物LHISR1-F和LHISR1-R分别对应细菌16S rRNA基因和23S基因保守区域[11],用于扩增香港海鸥形菌16S-23S rRNA基因间隔区全长序列,引物序列见表1。PCR反应总体积为25 μL,含1×PCR缓冲液,1.5 mmol/L Mg2+,100 μmol/L dNTPs,500 nmol/L上下游引物,0.5 U热启动酶,2 μL模板DNA。PCR反应程序为95 ℃ 热启动15 min, 94 ℃ 变性1 min, 60 ℃ 退火1 min, 72 ℃ 延伸2 min,循环35次,72 ℃ 10 min,4 ℃ 结束程序。PCR扩增产物经2%琼脂糖(含1∶20 000 GelRed染料)电泳,在凝胶成像系统下进行分析,符合预期的PCR产物经纯化后送测序作进一步分析。
2.3 多序列比对分析和多重PCR引物设计 将182个16S rRNA基因序列(包含60个LH、102个Chromobacterium、14个Vogesella和 6个Microvirgula的16S rRNA基因序列)以及本实验测序所得的62个LH ISR基因序列作多序列比对分析(Clustal W 1994),分析结果用于LH种特异性引物设计。利用Primer 5.0引物设计软件自行设计两对引物LH16S-F/LH16S-R和LHISR2-F/LHISR2-R,并用BLASTn搜索软件进行引物特异性分析,引物序列见表1。
2.4 定量DNA模板的制备和多重PCR检测方法的建立 将香港海鸥形菌菌株LHHZ242含量由5×107CFU/mL 10倍梯度稀释到5×10-1CFU/mL,不同浓度分别提取DNA模板进行多重PCR检测。多重PCR反应总体积为25 μL,含1×PCR缓冲液,1.5 mmol/L Mg2+,100 μmol/L dNTPs,500 nmol/L各条引物,0.5 U热启动酶,2 μL模板DNA。PCR反应程序为95 ℃热启动15 min, 94 ℃变性1 min, 60 ℃退火1 min, 72 ℃ 延伸2 min,循环35次,72 ℃ 10 min,4 ℃ 结束程序。PCR扩增产物经2%琼脂糖(含1∶20 000 GelRed染料)电泳,在凝胶成像系统下进行分析。
2.5 嵌合荧光法的PCR反应体系 参照试剂盒说明书,反应总体积为25 μL,含1×SYBR Premix EXTAQTMII,400 nmol/L上下游引物,1×ROX Reference Dye,4 μL模板DNA。荧光PCR反应程序为Stage 1:95 ℃ 预变性30 s;Stage 2:95 ℃ 5 s,60 ℃ 34 s,循环40次;Stage 3:95 ℃ 15 s,60 ℃ 1min,95 ℃ 15 s。
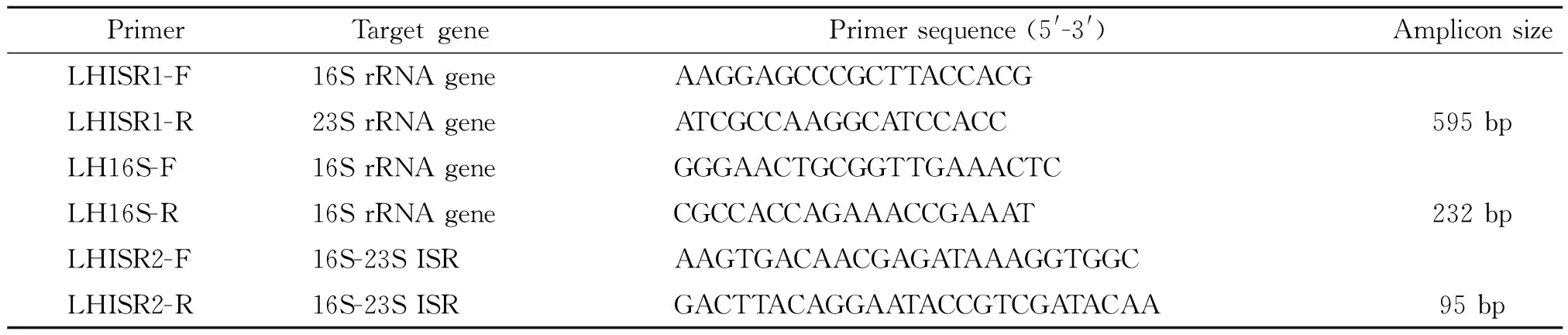
表1 PCR引物序列
3 结 果
3.1 多序列比对分析结果 香港海鸥形菌16S rRNA基因高度保守,总长为1 524 bp的序列仅有0~3个碱基差异,相似度大于99.8%,其多态性碱基位置为第424、425和430。香港海鸥形菌的16S-23S rRNA基因间隔区长度为恒定471 bp,且高度保守,仅有0~5个碱基差异,相似度大于98.9%,其多态性碱基位置为第53、355、358、374和379。
3.2 多重PCR特异性检测结果 利用多重PCR法对10个标准菌株和5个临床分离菌株DNA进行PCR特异性检验。结果表明,62株香港海鸥形菌DNA菌扩增出两条目的条带,229 bp和95 bp,其他DNA样品未见特异性扩增条带(图1)。

M: DNA marker; 1: LHHZ242 positive control; 2: Blank control; 3-17: DNA of reference strains.
图1 香港海鸥形菌多重PCR特异性检测电泳图
Fig.1 Multi-PCR electrophoresis for specific detection of LH
3.3 多重PCR敏感度检测结果 多重PCR法对稀释度为5×107CFU/mL至5×10-1CFU/mL的香港海鸥形菌菌液DNA模板进行敏感度检测,结果发现,两对引物均在第5泳道出现最弱条带,检测的敏感度为5×103CFU/mL(图2)。
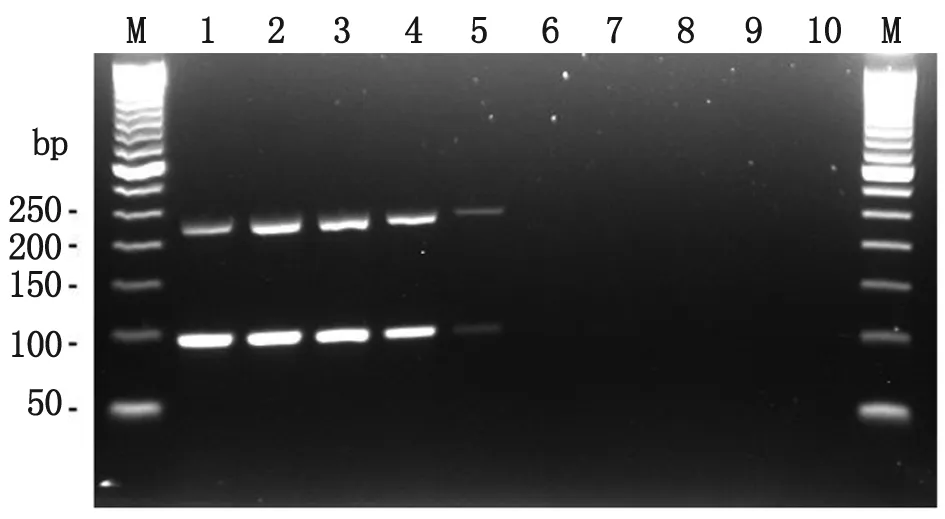
M: DNA marker; 1-9: Various bacterial suspension of LHHZ242 from 5×107CFU/mL to 5×10-1CFU/mL; 10: Blank control.
图2 香港海鸥形菌多重PCR敏感度检测电泳图
Fig.2 Sensitiveness of multi-PCR for detection of LH
3.4 嵌合荧光PCR法检测结果 用嵌合荧光PCR法对稀释度为5×107CFU/mL至5×10-1CFU/mL的香港海鸥形菌菌液DNA模板进行浓度梯度检测,结果显示:引物LH16S-F/LH16S-R和LHISR2-F/LHISR2-R均可检测到6个浓度的信号,其最低检测限均为5×102CFU/mL菌液(图3)。
4 讨 论
细菌16S rRNA基因相对保守,但又存在着9或10个变异区,不同属和种间都有不同程度的差异。16S-23S rRNA基因间隔区(16-23S rRNA intergenic spacer region, ISR)的进化速度是16S rRNA基因的10倍[12],并且其两端的序列高度保守,使得它可以用于亲缘性异常接近菌种的鉴别,也能用于细菌的分型[11]。自香港海鸥形菌被首次发现以来,还未见香港海鸥形菌16S rRNA基因序列或16S-23S rRNA基因间隔区序列的同源性分析报道。本研究发现,香港海鸥形菌16S rRNA基因序列高度保守,且与其他亲缘菌株序列有较大差异;其16S-23S rRNA基因间隔区长度恒定并高度保守,并在GenBank数据库中未发现相识性序列。因此,香港海鸥形菌16S rRNA和ISR区域均可作为种特异性PCR引物设计区。Yuen KY等用系统进化树的方法发现Chromobacterium,Microvirgula和Vogesella等菌属与LH的亲缘关系最近[1],而有趣的是这些细菌都能从水环境中检出。通过对这些细菌的16S rRNA基因序列进行比对,我们设计的LH种特异性引物能够特异性扩增LH基因,而不会扩增这些亲缘关系最近的细菌基因。这就使我们能快速鉴定环境样品中的LH,为研究环境中LH的来源和分布提供了条件,也为研究和寻找LH新种或亚型提供了可能。其次,我们用临床常见肠道致病菌检测引物的特异性,发现引物并不能扩增这些菌株的16S rRNA基因或ISR基因,并且均未发现非特异性扩增条带。所以本实验设计的种特异性引物能用于临床细菌样品的LH PCR鉴定,而两对引物构成的多重PCR体系更能提高检出的特异性,而并不影响PCR反应的灵敏度。
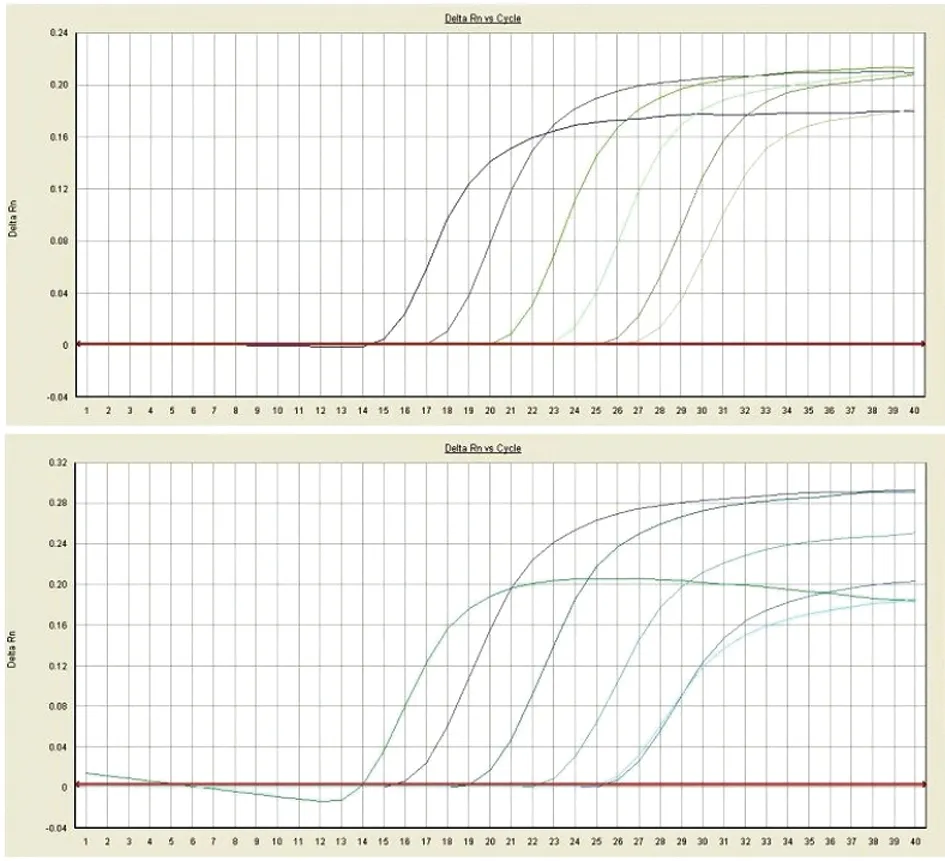
Amplification curve of primers LH16S-F/LH16S-R; Fig below: Amplification curve of primers LHISR2-F/LHISR2-R; Concentration gradient: Various bacterial suspension of LHHZ242 from 5×107CFU/mL to 5×10-1CFU/mL.
图3 香港海鸥形菌嵌合荧光PCR法敏感度检测结果
Fig.3 Sensitiveness of SYBR Green I real-time RAM for detection of LH
香港海鸥形菌在SS、XLD、CCDA、TCBS等培养基上不生长或者生长不良,虽然Lau SK等人发现改良头孢哌酮麦康凯(CMA)可以作为分离LH的合适培养基,但其在CMA上生长缓慢,37 ℃下培养48 h后菌落大小约为0.5~1 mm,且菌落形态特征不明显、为无色透明扁平状,且难以在混杂的众多菌落中区分和挑取[9,13]。可疑菌落挑取后,还需要细菌分纯、表型和生化鉴定等步骤。因此,用传统微生物鉴定法分离LH很大程度上依赖于检验者长期积累的经验和技术,不仅费时费力,且容易漏检和误检。而种特异性多重PCR方法能在培养24 h后即能对难挑菌落和可疑菌落进行鉴定,虽不能完全取代传统培养分离法,但更为迅速和灵敏。
嵌合荧光PCR法为一种简单的实时荧光定量PCR,所用染料 SYBR Green I 能结合于双链DNA微槽而增加荧光强度,从而具有高灵敏度,而引物特异性决定了嵌合荧光PCR的特异性[14]。本研究采用嵌合荧光PCR法分别检测香港海鸥形菌16S rRNA基因和ISR基因,结果显示其荧光强度与模板浓度成正比,最低检测限均达到5×102CFU/mL菌液,为普通PCR灵敏度的10倍。而且嵌合荧光PCR免去了琼脂糖凝胶电泳的步骤,明显缩短了检测时间。因此,嵌合荧光PCR法拥有高特异性、高灵敏度及快速检测等优势,更适用于香港海鸥形菌爆发流行的快速诊断,或者大批量及低浓度样品的检测。
(澳大利亚Westmead医院感染性疾病与微生物研究中心对本研究提供了资助及实验所用菌株,孔繁荣博士在研究实施及论文写作期间给予了精心的协助和指导,在此一并感谢!)
[1]Yuen KY, Woo PC, Teng JL, et al.Laribacterhongkongensisgen. nov., sp. nov., a novel gram-negative bacterium isolated from a cirrhotic patient with bacteremia and empyema[J]. J Clin Microbiol, 2001, 39(12): 4227-4232. DOI: 10.1128/JCM.39.12.4227-4232.2001
[2]Woo PC, Lau SK, Teng JL, et al. Association ofLaribacterhongkongensisin community-acquired gastroenteritis with travel and eating fish: a multicentre case-control study[J]. Lancet, 2004, 363(9425): 1941-1947. DOI: 10.1016/S0140-6736(04)16407-6
[3]Woo PC, Lau SK, Teng JL, et al. Current status and future directions forLaribacterhongkongensis, a novel bacterium associated with gastroenteritis and traveller's diarrhoea[J]. Curr Opin Infect Dis, 2005, 18(5): 413-419.
[4]Dupont HL. Advances in defining etiology and new therapeutic approaches in acute diarrhea[J]. J Infect, 2007, 55(5): 385-393.
[5]Kim DS, Wi YM, Choi JY, et al. Bacteremia caused byLaribacterhongkongensismisidentified asAcinetobacerlwoffii: report of the first case in Korea[J]. J Korean Med Sci, 2011, 26(5): 679-681. DOI: 10.3346/JKMS.2011.26.5.679
[6]Lau SK, Woo PC, Fan RY, et al. Isolation ofLaribacterhongkongensis, a novel bacterium associated with gastroenteritis, from drinking water reservoirs in Hong Kong[J]. J Appl Microbiol, 2007, 103(3): 507-515.
[7]Lau SK, Lee LC, Fan RY, et al. Isolation ofLaribacterhongkongensis, a novel bacterium associated with gastroenteritis, from Chinese tiger frog[J]. Int J Food Microbiol, 2009, 129(1): 78-82. DOI: 10.1016/j.ijfoodmicro.2008.10.021
[8]Ni XP, Ren SH, Sun JR, et al.Laribacterhongkongensisisolated from a patient with community-acquired gastroenteritis in Hangzhou City[J]. J Clin Microbiol, 2007, 45(1): 255-256. DOI: 10.1128/JCM.01400-06
[9]Ni XP, Sun JR, Xiang HQ, et al. Establishment and application of a set of diagnosing methods forLaribacterhongkongensis[J]. Chin J Health Lab, 2007, 17(12): 2162-2164. (in Chinese) 倪晓平, 孙建荣, 项海青, 等. 香港海鸥形菌检验技术的建议与应用[J]. 中国卫生检验杂志, 2007, 17(12): 2162-2164.
[10]Ni XP, Sun JR, Kong QX, et al. Isolation ofLaribacterhongkongensisfrom Little Egrets (Egretta garzetta) in Hangzhou, China[J]. Lett Appl Microbiol, 2011, 52(5): 465-467. DOI: 10.1111/j.1472-765X.2011.03024.x
[11]Gurtler V, Stanisich VA. New approaches to typing and identification of bacteria using the 16S-23S rDNA spacer region[J]. Microbiology, 1996, 142(Pt 1): 3-16.
[12]Nathalie LB, Herve P, Irene M, et al. 16S rRNA to 23S internal transcribed spacer sequence analyses reveal inter- and intra-specific Bidobacterium phylogeny[J]. Int J Sys Bacteriol, 1996, 46(1): 102-111.
[13]Lau SK, Woo PC, Hui WT, et al. Use of cefoperazone MacConkey agar for selective isolation ofLaribacterhongkongensis[J]. J Clin Microbiol, 2003, 41(10): 4839-4841. DOI: 10.1128/JCM.41.10.4839-4841.2003
[14]Zhang XC, Zhu KR, Huang RN, et al. Evaluation of a rapid real-time PCR assay for detection the bacteria carrier level ofNeisseriameningitidesin health population in Chendu city[J]. Mod Prevent Med, 2009, 36(9): 1710-1712. (in Chinese) 张晓春, 朱昆蓉, 黄蓉娜, 等. 嵌合荧光PCR法在调查成都市正常人群脑膜炎奈瑟氏菌携带率中的应用及评价[J]. 现代预防医学, 2009, 36(9): 1710-1712.
Development and application of multi-PCR and SYBR Green I real-time ramification amplification method for detection ofLaribacerhongkongensis
SHEN Lin-hai,KONG Qin-xin,SUN Jian-rong,XU Hong,JIN Hui,WEI Ling-ya,ZHA Jie,WANG Ying-hong,NI Xiao-ping
(HangzhouCenterforDiseaseControlandPrevention,Hangzhou310006,China)
We aimed to establish multi-PCR and SYBR Green I real-time ramification amplification method (RAM) for detection ofLaribacerhongkongensis, and evaluate the applications of two methods in both clinical and environmental microbiology. Full-length of the 16S rRNA gene and 16S-23S rRNA intergenic spacer region (ISR) sequences of 62L.hongkongensisisolates were obtained by PCR based sequencing. Two species-specific primer pairs targeting 16S rRNA gene and ISR were designed for multi-PCR and SYBR Green I real-time RAM for detection ofL.hongkongensis, and the specificity and sensitivity of two methods were evaluated by 15 strains associated with bacterial diarrhea. Results showed that LH species-specific multi-PCR assay had high specificity (100%) and the minimum detectable level was 5×103CFU/mL; the minimum detectable levels of two primer pair were both 5×102CFU/mL by SYBR Green I real-time RAM. The multi-PCR method and SYBR Green I real-time RAM provide rapid and reliable alternative to conventional methods to identifyL.hongkongensis, and may have applications in both clinical and environmental microbiology.
Laribacterhongkongensis; multi-PCR method; SYBR Green I real-time RAM
Ni Xiao-ping, Email: hznixp@163.com
倪晓平,Email: hznixp@163.com
杭州市疾病预防控制中心,杭州 310021
10.3969/cjz.j.issn.1002-2694.2015.07.014
R446.5
A
1002-2694(2015)07-0659-04
2014-07-18;
2015-01-28
浙江省重点科技创新团队项目(2011R50021);杭州市科技计划引导项目(2014-2)

Funded by the Program for Zhejiang Leading Team of Science Technology Innovation and the Science and Technology Guiding Projects of Hangzhou city (No. 2014-2)
