美国《Emerging Infectious Diseases》2014年第12期
2015-03-17有关人兽共患病论文摘译
有关人兽共患病论文摘译
美国《Emerging Infectious Diseases》2014年第12期
有关人兽共患病论文摘译
P1969 新型蛋白酶敏感型朊毒体病,一类无传染性的独特的朊毒体变异//Abigail B. Diack1, Diane L. Ritchie1, Alexander H. Peden,等
新型蛋白酶敏感型朊毒体病(VPSPr)可能发生在人朊蛋白基因(PRNP)第129密码子为各种基因型的人中。与其他人类朊毒体病相比,其特征在于具有独特的生物化学谱带。我们将基因型为缬氨酸纯合子(VV)的2名患者和基因型为甲硫氨酸缬氨酸杂合子的1名患者的脑组织分别接种于能表达人PRNP的转基因小鼠以研究VPSPr的传染性。在所有接种小鼠中均未观察到临床症状或空泡变性。当受到来自基因型为VV的VPSPr患者脑组织攻击后,小鼠的脑组织出现朊蛋白小颗粒聚集,其中一些类似于VPSPr患者脑组织中的微小斑块。用同一品系鼠比较VPSPr和散发型克雅氏病的传染性表明VPSPr具有独特的生物学特性。此外,我们认为VPSPr人传人能力有限。
P1980 新西兰牛和人的产志贺毒素大肠埃希菌O157∶H7基因型的地理分布//Patricia Jaros, Adrian L. Cookson, Donald M. Campbell,等
产志贺毒素大肠埃希菌(STEC)O157∶H7是全球公共卫生领域关注的人畜共患的病原体。为了比较2008-2011年间获得的来自不同牛和人的STEC 菌株O157∶H7基因型的局部和大尺度地理分布情况,我们采用脉冲场凝胶电泳和编码志贺毒素噬菌体插入(SBI)分型技术,应用多变量方法,将来自新西兰北岛及南岛的菌株与澳大利亚和美国的菌株进行比较。南北两岛的STEC O157∶H7种群构成明显不同,同时证明了小尺度空间结构的存在。这种种群分布情况与食源性暴发传播不符,而与局限性传播相符。新西兰、澳大利亚和美国分离株之间SBI型别分布明显不同。我们的研究结果证明曾经有一个不断进化的全球流行STEC O157∶H7菌株亚种输入新西兰,并局限在牛和人类之间传播。
P1999 接种MERS-CoV单峰骆驼上呼吸道中病毒的复制和排出//Danielle R. Adney, Neeltje van Doremalen, Vienna R. Brown,等
2012年,中东地区出现与人类严重呼吸系统疾病相关的新型冠状病毒。流行病学调查表明中东呼吸综合症冠状病毒(MERS-CoV)人兽共患传播可能源自单峰骆驼。在这里,我们提供了骆驼作为MERS-CoV贮存宿主的实验证据。我们对3只成年骆驼接种人MERS-CoV分离株,每只骆驼主要表现为一过性的上呼吸道感染。受MERS-CoV感染后临床症状较轻,但每只骆驼均从上呼吸道排出大量病毒。在接种后的7天中在鼻分泌物中可检测到感染性病毒,接种后的35天仍可检测到病毒RNA。单峰骆驼排毒方式以及病毒具有感染上呼吸道的倾向,可能有助于解释自然感染病毒的骆驼未见系统性疾病发生以及骆驼传染骆驼以及骆驼传人的传播方式的効力。(图1、图2)

A)观察到3号骆驼鼻腔分泌物排出,在实验的头2周每只接种病毒的骆驼均有鼻腔分泌物排出。 B)分别用带几何图形的线条表示每只骆驼直肠温度。水平线表示接种病毒前观测的这些单峰骆驼正常的温度范围,按照平均值±3×计算。
图1 接种中东呼吸综合征冠状病毒(MERS-CoV)后单峰驼骆的临床症状。
P2006 新型蛋白酶敏感型朊毒体病的传播特性//Silvio Notari, Xiangzhu Xiao, Juan Carlos Espinosa,等
新型蛋白酶敏感型朊毒体病(VPSPr),是一种新近发现的、看似散发的人类朊毒体病,它与克雅氏病(CJD)明显不同,但与格斯特曼综合征(GSS)有共同点。然而,与独具遗传倾向的GSS相反,VPSPr中未检测到朊蛋白(PRP)基因变异,这表明VPSPr可能是我们长期探究的GSS的一种散发形式。由于VPSPr这种非典型特征而提出其可传播性的问题,此为朊毒体病的典型特性。我们将VPSPr脑匀浆接种到能表达不同水平人朊蛋白(PrPc)的转基因小鼠脑中。第一代有54%被攻击的小鼠表现出病理病变,34%的小鼠带有与VPSPr类似的异常PrP。令人惊奇的是,在第二代未发生朊毒体病。我们认为VPSPr是可传播的。因此,可以确定它是一种朊毒体病。然而,我们推测可能由于正常人的PrPc缺乏有效转化基质(或是鼠脑并非最佳的环境),因此在第一代后不能再维持复制。(图3、图4)
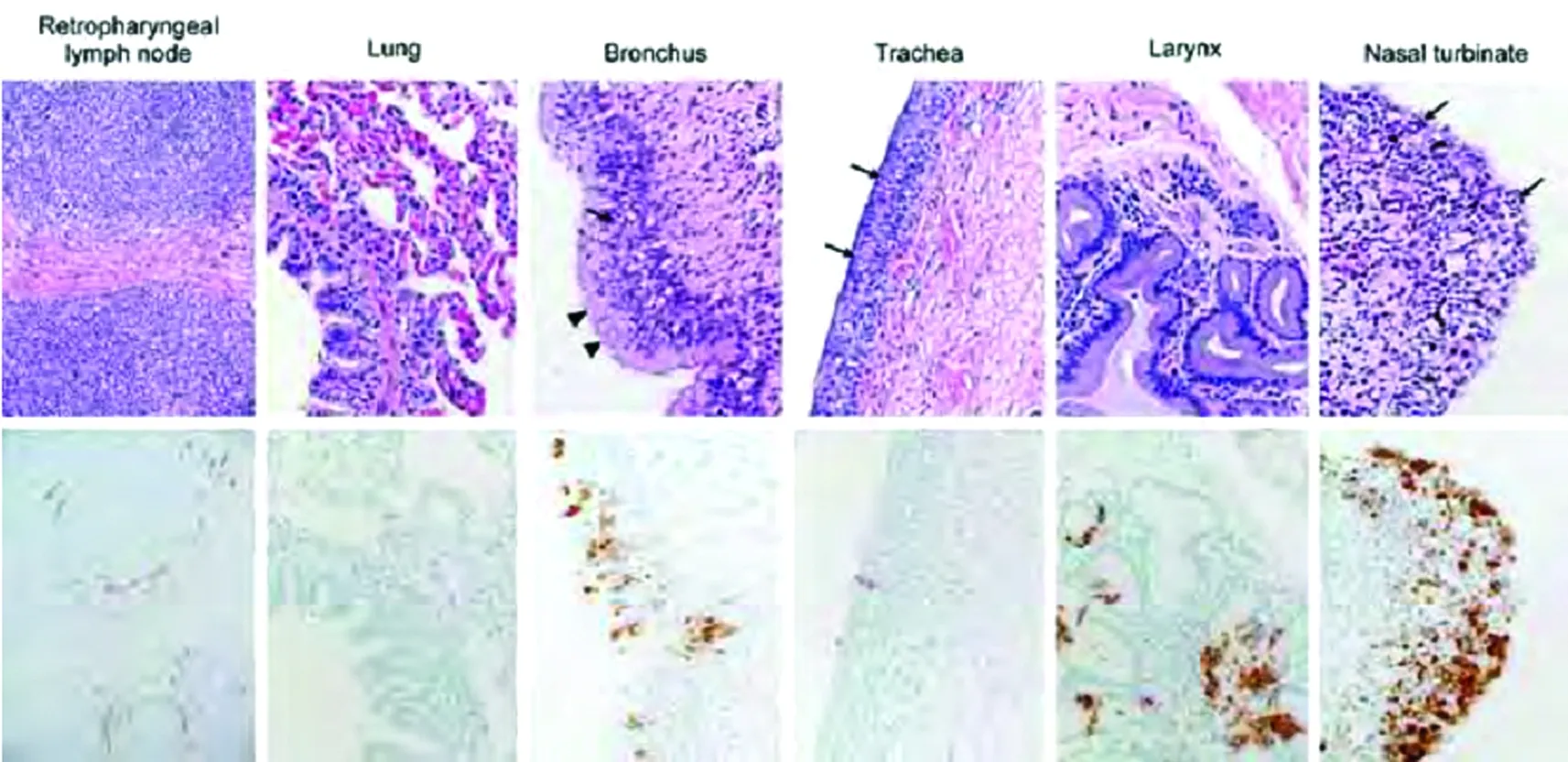
图2 1号骆驼接种中东呼吸综合症冠状病毒(MERS-CoV)5天后组织病理学改变。组织采集后,用苏木精-伊红染色(上排图片)。抗MERS-CoV免疫组化结果(下排图片)可见棕红色染色。鼻甲骨、气管和支气管假复层上皮发生退行性变,表现为杯状细胞和纤毛缺失,细胞核成团聚集伴有嗜中性粒细胞的浸润(以箭号标示)。箭头标示残余的未受损的纤毛。放大倍数×400。

A-C)斑块最常位于海马槽和胼胝体的临界处,常常成排聚集分布。它们或是紧密地聚集或是部分融合产生多核斑块。PrP免疫染色(A,B)显示斑块成细长形,周围围绕PrP沉积物。它可出现在聚集的不同时期(苏木精-伊红染色),其中斑块核心显得光滑,缺乏典型的库鲁斑块的刺状外观(C)。 D-F)第二种类型的病变由朊毒体颗粒状沉积构成(D和E)与海马腔隙分子层海绵状变性同层分布(F)。G-J)Tg(HuPrP129V×3小鼠中斑块较少,但所在位置和外观与Tg(HuPrP129V)×8小鼠相似。相比之下,在Tg(HuPrP129M)×2-阳性小鼠中PrP聚集体普遍较松散仅少数形成真正的斑块(I和J)。PrP单克隆抗体为3F4.。在图A、D、G和I的方框中标记区域分别用图B、E、H和J显示高倍的放大图。PrP:朊毒体蛋白,VPSPr:新型蛋白酶敏感型朊毒体病, Tg:转基因小鼠。图A 、E标尺=250μm。图B,C,H和J 标尺=25μm。图D标尺=500μm。图F,G和I标尺=100μm 。
图3 一项研究VPSPr传播特征的组织学和免疫组化结果。 A-E)在Tg(HuPrP129V)×8小鼠中观察到两种典型的病变。
