狂犬病病毒CTN-1株在鸡胚细胞驯化过程中G基因和滴度分析
2015-03-17刘永娣王春华朱士茂丁玉江郭采平
李 慧,刘永娣,罗 姗,王春华,朱士茂,张 佩,丁玉江,郭采平
狂犬病病毒CTN-1株在鸡胚细胞驯化过程中G基因和滴度分析
李 慧,刘永娣,罗 姗,王春华,朱士茂,张 佩,丁玉江,郭采平
目的 研究狂犬病病毒CTN-1株在鸡胚细胞驯化过程中的特性。方法 利用RT-PCR反应扩增CTN-1株19个代次的G蛋白基因,获得cDNA进行序列测定;并以免疫荧光法测定各代次毒株在细胞中的滴度。结果 序列测定显示:CTN-1株在鸡胚细胞驯化过程中G蛋白基因序列发生不同程度变异且逐步积累,从第30代开始,G蛋白基因序列趋于稳定。与CTN-1株相比,CTN-1鸡胚细胞驯化株在G蛋白的第147、333、389、421和485位氨基酸发生了突变。与此相对应,CTN-1株鸡胚细胞驯化株滴度逐渐趋于稳定,并于第33-58代滴度维持在10~101 g细胞荧光转化灶单位/mL左右。G蛋白同源性分析表明,CTN-1株鸡胚细胞驯化株与我国近期不同区域分离得到的街毒株具有较高同源性,其G蛋白氨基酸同源性为89.3%~99.0%。结论 CTN-1株在鸡胚细胞驯化过程中G蛋白基因发生稳定变异,滴度在传代后33-58代达到较高水平,稳定性较好,适于我国狂犬病防治的实际应用。
狂犬病病毒;CTN-1;G蛋白;序列测定;滴度
狂犬病病毒(Rabies virus, RV)属于弹状病毒科、狂犬病病毒属的一种严格嗜神经性病毒,可以引起人兽共患病,一旦发病,死亡率几乎为100%[1]。全世界每年因狂犬病死亡的人数约为55 000,其中绝大多数病例发生在发展中国家[2]。我国是狂犬病高发国家,发病和死亡人数仅次于印度,居世界第2位[2]。至今人们仍未能完全了解RV的致病机理,接种狂犬病疫苗是预防狂犬病发生最重要和最有效的措施[3]。
当前在我国使用的人用狂犬病疫苗株有aG,PV和CTN株[4]。CTN-1是我国拥有自主知识产权的毒株,最早在1956年从山东淄博市狂犬病患者分离[3]。目前已对CTN-1株的基因组和结构基因序列、表型、生物学和抗原性等进行了全面研究,发现相比于其他疫苗株,CTN-1株与近30年来在中国不同区域分离得到的流行RV街毒株的亲缘关系更为密切,表明CTN-1株更适合用于我国的狂犬病防治[5]。目前有关CTN-1株的研究基本为Vero细胞适应株的报道,且当前我国人用狂犬病疫苗也全部是以Vero细胞作为培养基质[3],而对于CTN-1株适应于原代鸡胚细胞(Chicken embryo cells,CECs)的生物学特性还未有研究报道[6]。本研究对CTN-1株在鸡胚细胞驯化过程中不同代次毒株的滴度及G蛋白基因的序列进行测定,观察病毒滴度和G蛋白基因序列与病毒驯化代次之间的关系,为评价CTN-1鸡胚细胞驯化株(CTN-1 chicken embryo cells domesticated strain,简写为CTNCEC-Dom株)用于中国疫苗生产的适用性、有效性和稳定性提供理论依据。
1 材料与方法
1.1 毒株和细胞 CTNCEC毒株:取CTN-1株(来源:中国食品药品检定研究院,vero细胞5代,即CTN-1V5)先经vero细胞传8代后再经原代鸡胚细胞连续传代获得的不同代次的鸡胚细胞毒株。取CTNCEC-1、5、6、10、15、20、25、26、27、30、31、32、33、36、40、45、50、55和60毒株分别进行滴度和序列测定。原代CECs为本疫苗研究室从9~11日龄鸡胚中制备得到;BSR细胞来自中国疾病预防控制中心病毒病预防控制研究所惠赠。
1.2 主要试剂 QIAampViral RNA Mini Kit试剂盒购自QIAGEN公司;First Strand Cdna Synthesis Kit(ReverTra Ace-α-)试剂盒购自TOYOBO公司;Platinum Taq DNA HIF I Polymerase (5 U/蘈l)购自Invitrogen公司;PureLink Quick Gel Extraction and PCR Purification Combo Kit购自Invitrogen公司。
1.3 引物设计及合成 G蛋白基因特异性测序引物参考CTN-1全基因组序列(GenBank序列号FJ959397)。使用DNAStar软件中的PrimerSelect工具设计,序列分别为CTN-MGL-F1 (5′-ATACGGGCTTAACTCCAACCT-3′,参考序列位置3157-3177 nt)和CTN-MGL-R (5′-GCTCGGCCTCTGACTCAAT-3′,参考序列位置5453-5471 nt)。引物由北京六合华大基因科技股份有限公司合成。
1.4 病毒RNA的提取及PR-PCR CTN-1株驯化过程中不同代次RV经原代鸡胚细胞传一代,收集细胞培养上清液,用QIAamp UltraSens Virus Kit从上清液提取狂犬病病毒RNA,用ReverTra Ace-α-逆转录成CDNA。
1.5 PCR扩增及测序 PCR反应体系(50 μL)如下:10 × PCR缓冲液5 μL,CDNA模板1 μL,10 mmol/L DNTP 1 μL,20 μmol/L的上下游引物各1 μL,Platinum Taq DNA HIF I Polymerase (5 U/μL) (Invitrogen公司) 0.2 μL,去离子水40.8 μL,PCR循环参数为:94 ℃预变性3 min;94 ℃ 30 s,52 ℃ 30s,68 ℃ 3 min,30个循环;68 ℃延伸10 min。1%琼脂糖凝胶电泳检测扩增产物,用PureLink Quick Gel Extraction and PCR Purification Combo Kit回收扩增产物。然后将回收的扩增片段连接到PMD18-T载体(TaKaRa公司),转化后挑取阳性克隆进行序列测定。
1.6 病毒滴度测定 应用细胞荧光转化灶单位实验(Fluorescence Focus Units Assay, FFU)测定各毒株的滴度[7]。在96孔微量培养板中3倍系列稀释病毒样品,并加入BSR细胞悬液至终浓度为1 × 105个细胞/孔,混匀置37 ℃,5% CO2培养24 h。弃培养液,用PBS洗1次,然后每孔加入50 μL 80%冷丙酮于4 ℃固定20 min。弃丙酮,室温放置待丙酮挥发后,加入工作浓度的荧光素标记抗狂犬病病毒N蛋白单抗(Millipore, 5100),50 μL/孔,37 ℃孵育30 min,PBS洗3次,加甘油后置荧光显微镜下观察结果,取>10和<10个荧光灶的相邻两孔稀释度的数据进行计算。病毒滴定(FFU/mL)=[(低稀释度的荧光平均数+高稀释度的荧光平均数× 3)/2]×稀释倍数×1 000/50[6]。
2 结 果
2.1 CTNCEC 1-60代19个毒株G蛋白核苷酸序列的比较 本研究选取的19个代次毒株G蛋白核苷酸数量及其编码框架均没变化,各代次编码框具有高度一致性,均在99.7%以上,详见表1。从表中可看出,CTN-1株为了适应鸡胚细胞,G基因序列发生了一定的变化。从鸡胚细胞传代第1代开始,CTN-1的G蛋白基因在第4538、4636、4826和5251位核苷酸位点发生突变,分别由G、A、T和C变成了A、G、C和A,这些突变位点一直保持到第5代;从第6代开始,G蛋白基因新增加4371位突变,相应核苷酸由G突变成A,这些突变在第5、10、20和25代毒株中保持不变;从第26代开始,G蛋白基因在第4635位核苷酸发生突变,由C变成A;第27代次毒株G蛋白基因序列与26代相同;从第30代开始,G蛋白基因序列再增加一个突变,第3812位核苷酸由A变成G,毒株G蛋白基因序列保持稳定,至60代序列不再发生变化。
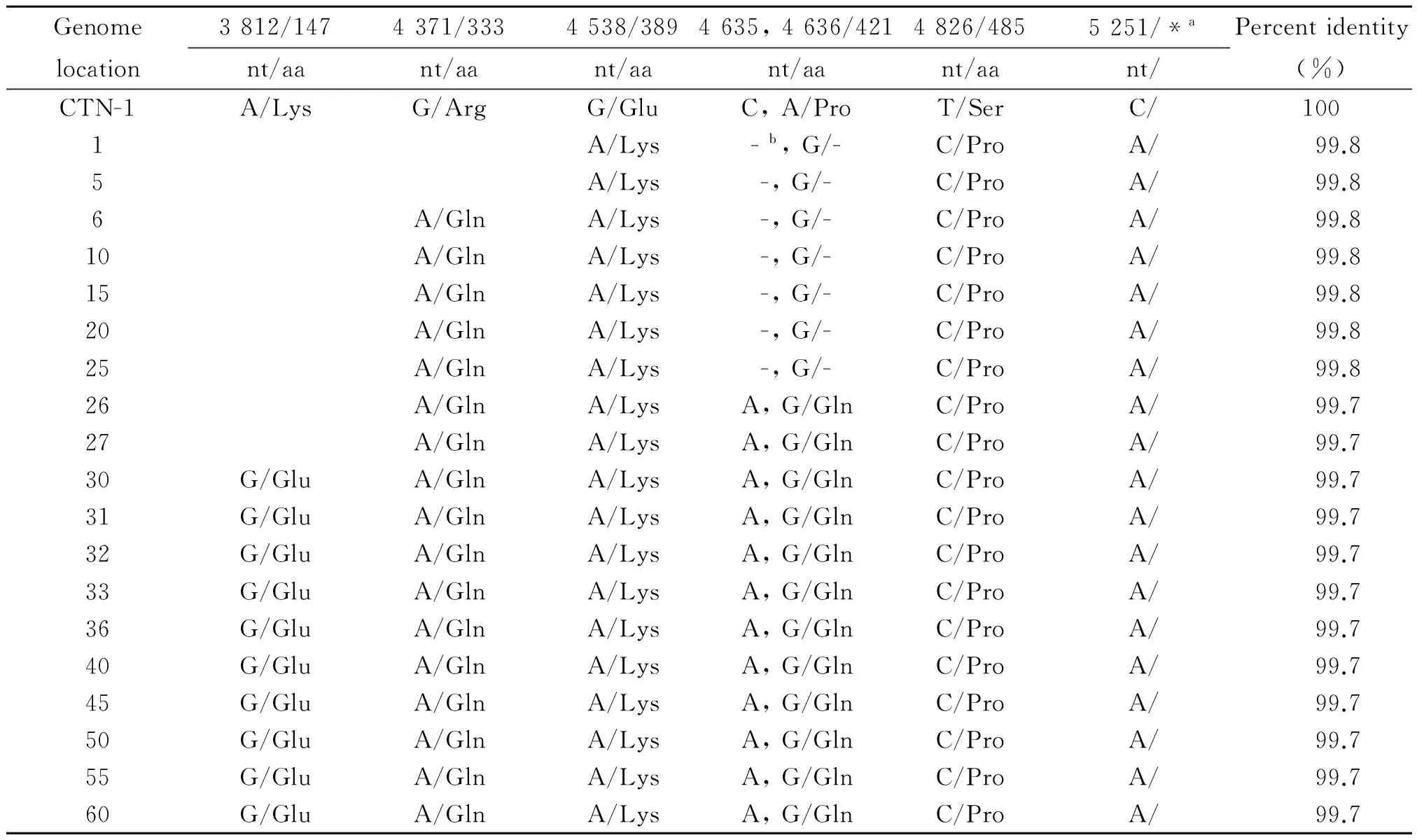
表1 各代次CTNCEC毒株G蛋白基因核苷酸及氨基酸序列变化
Note:anucleotide in the 3′ UTR of the G gene,bno change.
2.2 CTNCEC 1-60代19个毒株G蛋白氨基酸序列的比较 研究表明,G蛋白是RV的主要保护性抗原,是RV结构蛋白中唯一能够诱导宿主产生中和抗体的蛋白[3]。序列分析表明,从30代开始,CTN-1在鸡胚细胞中稳定后,G蛋白在第147 (K→E)、333 (R→Q)、389 (E→K)、421 (P→Q)和485 (S→P)位氨基酸发生突变(表1)。在这些位点突变的氨基酸中,已知第147和333位氨基酸对于RV致病性至关重要,单一突变任何一个氨基酸就足以严重削弱病毒的致病力。此外,G蛋白的第194位氨基酸没有发生突变,因此不会发生因G蛋白第194 (N→K)和333位氨基酸(K→Q)同时突变而增强毒株对成年鼠致病性的情况[8]。这些结果表明,CTN-1株在鸡胚细胞传代过程中对小鼠的致病力逐渐减弱。因此,我们把CTNCEC-30代定为CTNCEC-Dom株。
2.3 CTNCEC 1-60代19个毒株滴度的变化 利用细胞荧光转化灶单位实验(Fluorescence Focus Units Assay, FFU)测定各代次毒株的滴度,结果如图1所示。从CTN-1在鸡胚细胞上传第1代开始,病毒滴度从9.0 lgFFU/mL下降到4.7 lgFFU/mL,第5代开始,毒株的滴度随着传代次数的增加而增加;到第30代左右,病毒滴度趋近稳定,病毒滴度在58代前维持在7.0 ~7.5 lgFFU/mL左右。
2.4 CTNCEC-Dom株G蛋白氨基酸同源性分析 为了进一步研究CTNCEC-Dom株G蛋白与其他疫苗株或近期我国不同区域分离得到的野生街毒株直接的亲缘关系,从GenBank中选取若干种已公开发表的RV疫苗株和街毒株的G蛋白基因序列(如表2中所示),与CTNCEC-Dom株的G蛋白进行氨基酸同源性比较分析。同时,我们也对G蛋白的抗原位点II、III和线性表位G5进行了同源性分析,结果见表2所示。通过比较发现,CTNCEC-Dom株与疫苗株G蛋白全长同源性在89.3%~
图1 各代次CTNCEC毒株鸡胚细胞传代病毒滴度曲线图
99.0%之间,抗原位点II同源性在91.6%~99.4%之间,抗原位点III在89.3%~96.4%之间,线性表位G5之间的同源性在89.5%~100.0%之间。当与街毒株进行比较时,G蛋白全长、抗原位点II、抗原位点III和线性表位G的同源性分别为86.3%~96.8%、83.2%~98.2%、85.7%~96.4%和89.5%~97.4%。可见CTNCEC-Dom株与疫苗株G蛋白以及国内多数狂犬病街毒株G蛋白的亲缘关系密切,其中CTNCEC-Dom株与其出发母株CTN-1的同源性最高,G蛋白全长、抗原位点II、抗原位点III和线性表位G的同源性高达99.0%、99.4%、96.4%和100.0%。
表2 CTNCEC-Dom株G蛋白氨基酸序列与其他疫苗株和街毒株同源性分析
Tab.2 Homologies of the chicken embryo cell-domesticated virus strain G protein with those of other vaccine and street strains isolated

StrainAccessionno.HostAreayearAminoacidhomology(%)Full-lengthAntigensiteIIAntigensiteIIIG5VaccineCTN-1FJ959397HumanChinaShandong195699.099.496.4100.0strainsSAG2EF206719DogFrance-92.094.092.992.1ERAEF206707DogUSA193592.293.492.994.7SADB19M31046DogUSA193592.094.092.992.1HEP-FluryAB085828DogUSA193992.294.696.489.5FluryLEPDQ099524DogGermany-92.494.689.392.1PM1503DQ099525CowGermany-89.591.692.994.7PVM13215DogFrance188292.294.096.494.73aGL04522DogChinaBeijing193189.392.296.494.7IsolatedHN10EU643590DogChinaHunan200796.898.296.497.4streetBD06EU549783DogChinaHebei200692.994.692.992.1strainsDRVDQ875051DeerChinaJilin198986.683.292.994.7MRVDQ875050MouseChinaHenan198988.792.292.994.7FJ008FJ866835DogChinaFujian200893.595.292.992.1JX08-45GU647092ErmineChinaJiangxi200896.096.496.497.4GuizhouA10(H)EU267745HumanChinaGuizhou200491.693.489.394.7Hebei0(H)EU267752HumanChinaHebei200792.795.892.992.1HNDB28EU008927DogChinaHunan200594.395.892.992.1Hubei0703081EF643518CowChinaHubei200794.195.892.992.1WG430DQ849060DogChinaHunan200593.995.892.992.1WG432DQ849059DogChinaHunan200593.995.892.992.1Yunnan_MD06EU253477DogChinaYunnan200693.595.892.992.1FY1DQ849044DogChinaAnhui200493.995.892.992.1Yue1DQ849070DogChinaGuangxi199793.595.892.992.1JiangsuWx0(H)EU267772HumanChinaJiangxi200492.093.492.992.1NCDQ849064DogChinaJiangxi200493.795.892.994.7CQ92DQ849072DogChinaChongqing199294.896.496.494.7Yunnan_Qj07EU275240DogChinaYunnan200793.795.892.992.1YunnanTc06EU275242DogChinaYunnan200693.594.692.989.5
3 讨 论
CTN-1株于1956年分离自山东省死于狂犬病患者的脑组织,并先后在小鼠脑内和人二倍体细胞株多次连续传代而获得。此毒种后来又经在Vero细胞上连续多次传代而适应该细胞[3]。因CTN-1株与国内大多数街毒株的同源性高于其他疫苗株,因此更适合制备用于预防中国狂犬病的灭活疫苗[5]。当前我国使用的狂犬病疫苗绝大多数是Vero细胞培养的,而Vero细胞属于传代细胞系,存在一定的致癌风险[9]。鸡胚细胞作为原代细胞,其基因型保持不变,在应用上非常安全[6]。本研究对本公司得到的CTNCEC-Dom株的一些生物学特征进行分析,为其应用于我国的狂犬病疫苗生产中的优势提供理论依据。
CTN-1在鸡胚细胞驯化过程中滴度逐渐增加,并在第30代左右滴度维持稳定,表明此时CTN-1已经适应鸡胚细胞。G蛋白是RV的主要保护性抗原,是RV结构蛋白中唯一能够诱导宿主产生中和抗体的蛋白。研究表明,G蛋白抗原位点II中的第147、184、198~200以及34~42位氨基酸对于RV致病力至关重要,这些氨基酸的突变将严重削弱RV的致病力[3];而第333~338位氨基酸是抗原位点III的中和抗体主要结合部位,尤其是第333、336和338位的氨基酸最为重要[3]。从序列分析、与其他RV疫苗株和街毒株的G蛋白基因序列同源性比较发现,CTNCEC-Dom株跟多数疫苗株和国内街毒株具有高度的同源性,其中与CTN-1株的同源性最高,全长同源性达可达99.0%,线性表位同源性可达到100.0%,抗原位点II为99.4%,最低是抗原位点III为96.4%,这是因为CTNCEC-Dom株G蛋白在第147、333、389、421和485位氨基酸发生突变,其中包括对于RV致病性至关重要的第147和333位氨基酸,因此会大大降低毒株对成年小鼠的致病性[8-9];G蛋白第389和421位氨基酸在一些RV流行街毒株中高度保守,特别是第421位的脯氨酸在不同狂犬病病毒属中也高度保守,推测这两个氨基酸的突变可能会影响毒株在细胞中的复制。因G蛋白的第485位氨基酸位于G蛋白膜内区,且在不同毒株之间保守性较低,推测该位点的突变可能会影响G蛋白与病毒粒子内部的病毒蛋白或者与宿主蛋白的相互作用[3]。
虽然已有大量的研究表明CTN-1更加适合我国人用狂犬病疫苗的生产[5],且已有CTN-1疫苗上市,但这些疫苗全部是基于Vero传代细胞系。尽管国外已有纯化鸡胚细胞疫苗上市,并且已有研究证明纯化鸡胚细胞培养疫苗和人二倍体细胞疫苗的效果可比,是WHO推荐的疫苗之一,但目前国内还没有鸡胚细胞适应株的报道。本文对CTNCEC-Dom株的一些生物学特征进行研究,并分析了其与其他疫苗株和街毒株的G蛋白同源关系,为该毒株的应用提供基础数据。
[1]Knobel DL, Cleaveland S, Coleman PG, et al. Re-evaluating the burden of rabies in Africa and Asia[J]. Bull World Health Organ, 2005, 83(5): 360-368.
[2]Zhang YZ, Xiong CL, Xiao DL, et al. Human rabies in China[J]. Emerg Infect Dis, 2005, 11(12): 1983-1984. DOI: 10.3201/eid1112.040775
[3]Yu YX. Rabies virus and rabies vaccine[M]. Beijing: China Medical Science Press, 2009:86-92. (in Chinese) 俞永新. 狂犬病和狂犬病疫苗[M]. 北京:中国医药科技出版社, 2009:86-92.
[4]Jiao W, Yin X, Li Z, et al. Molecular characterization of China rabies virus vaccine strain[J]. Virol J, 2011, 8: 521. DOI: 10.1186/1743-422X-8-521
[5]Shi LT, Yu YX, Liu JH, et al. Analysis of full-length gene sequence of a rabies vaccine strain CTN-1for human use in China[J]. Chin J Virol, 2010, 26(3): 195-201. (in Chinese) 石磊泰, 俞永新, 刘景华,等. 中国狂犬病疫苗生产株CTN-1 全基因序列分析 [J]. 病毒学报, 2010, 26(3): 195-201.
[6]Guo C, Wang C, Luo S, et al. The adaptation of a CTN-1 rabies virus strain to high-titered growth in chick embryo cells for vaccine development[J]. Virol J, 2014, 11(1): 85-92. DOI: 10.1186/1743-422X-11-85
[7]Smith JS, Yager PA, Baer GM. A rapid reproducible test for determining rabies neutralizing antibody[J]. Bull World Health Organ, 1973, 48(5): 535-541.
[8]Faber M, Faber ML, Papaneri A, et al. A single amino acid change in rabies virus glycoprotein increases virus spread and enhances virus pathogenicity[J]. J Virol, 2005, 79(22): 14141-14148. DOI: 10.1128/JVI.79.22.14141-14148.2005
[9]Prehaud C, Coulon P, LaFay F, et al. Antigenic site II of the rabies virus glycoprotein: structure and role in viral virulence[J]. J Virol, 1988, 62(1):1-7.
Characterization of G gene and titer of the rabies virus CTN-1 strain during adaptation to chicken embryo cells
LI Hui,LIU Yong-di,LUO Shan,WANG Chun-hua,ZHU Shi-mao,ZHANG Pei,DING Yu-jiang,GUO Cai-ping
(ShenzhenWeiguangBiologicalProductsCo.,Ltd,Shenzhen518107, China)
In this study, the characteristics of the rabies virus strain CTN-1 during domestication to chicken embryo cells (CECs) were investigated. The G genes of 19 CTN-1 passages during domestication to CECs were PCR-amplified and completely sequenced. The titers of these 19 CTN-1 passages were determined by the fluorescence focus units’ assay. Results revealed that the G gene accumulated mutations during domestication of CTN-1 to CECs, and maintained stable from passage 30. Sequence comparison showed that amino acid residues at 147, 333, 389, 421, and 485 in the G protein were mutated in CEC-domesticated CTN-1 strain compared to the parent CTN-1 strain. Titration analysis demonstrated that the titers gradually increased during CTN-1 domestication to CECs and plateaued at 10-101 gfluorescence focus unit/mL during passages 33-58. Homology analysis showed that the CEC-domesticated CTN-1 strain was closely related to virus strains that were recently isolated from different regions in China and the full length G amino acid sequence homologies among the CEC-domesticated CTN-1 strain and other virus strains ranged from 89.3% to 99.0%. Taken together, the above results demonstrated that the G gene accumulated stable mutations during domestication of CTN-1 to CEC and the domesticated virus achieved high titers in CEC from passages 33 - 55, thus potentiating its utility in rabies prevention and control in China.
rabies virus; CTN-1; glycoprotein; sequence determination; titer
Guo Cai-ping, Email:gcpzxy0402@aiyun.com
郭采平,Email:gcpzxy0402@aiyun.com
深圳市卫光生物制品股份有限公司,深圳 518107
10.3969/cjz.j.issn.1002-2694.2015.02.011
R373.9
A
1002-2694(2015)02-0143-05
2014-04-30;
2014-11-20

