安徽地区腹泻病人粪便标本中沙门菌分离及其血清型鉴定
2015-03-17方欣,李春
方 欣,李 春
安徽地区腹泻病人粪便标本中沙门菌分离及其血清型鉴定
方 欣1,李 春2
目的 了解安徽地区近期临床分离沙门菌血清型、药物敏感性、毒力基因携带及血清型相同菌株的基因溯源情况。方法 应用血清凝集法检测沙门菌的血清型,微量肉汤稀释法检测药物敏感性,PCR法扩增毒力基因,PFGE法检测基因同源性并进行溯源。结果 43株沙门菌中鼠伤寒沙门菌和肠炎沙门菌分别占(39.5%/29.6%)。43株菌对四环素、甲氧苄啶/磺胺甲噁唑、萘啶酸和氯霉素的耐药率分别为(60.5%/39.5%/37.2%/30.2%),43株菌均携带InvA和InvE毒力基因,鼠伤寒沙门菌基因同源性较低,肠炎沙门菌基因同源性较高。结论 本次安徽地区临床分离的沙门菌以鼠伤寒沙门菌和肠炎沙门菌为主,其他血清型散在分布。对常规抗生素呈较高的耐药性,分离菌株均携带毒力基因对人体具有致病性。本地区流行的鼠伤寒沙门菌大部分来源于不同的基因克隆株,亲缘关系较远。而流行的肠炎沙门菌大部分来源于同一克隆株或亲缘关系较近的克隆群体。
沙门菌;血清型;毒力基因;基因同源性
沙门菌病是一种重要的人兽共患病,其菌属型别繁多,抗原复杂,目前已鉴定的血清型达2 500多种,是引起食源性腹泻的重要病原菌之一。世界卫生组织证实沙门菌病是当前重新出现的重要传染病之一,全球每年约有1 600万沙门菌感染病例[1]。2007年发生的“花生酱事件”和2008年发生的“西红柿”事件,引发这些事件的真正元凶正是这种极为常见的病原菌——沙门菌。在我国,沙门菌也是引起食物中毒最常见的病原菌之一。
本文为调查本地区腹泻病人粪便中分离沙门菌的血清型分布、主要毒力基因携带情况、常用抗生素的敏感性及主要流行株的克隆分布,为疾病的防治提供参考。
1 材料与方法
1.1 菌株 2013年安徽地区从临床腹泻病人粪便中分离出沙门菌43株,其中安徽省儿童医院18株,宁国市人民医院15株,马鞍山市中心医院5株,马鞍山市第二人民医院3株,马鞍山市第四人民医院2株。所有菌株均经VITEK-2 compact鉴定。
1.2 主要试剂和仪器 沙门菌血清诊断试剂盒购自丹麦,PCR反应体系购自美国promega公司,XbaI购自大连宝生物,Sensitire药敏板购自Thermo公司,PCR扩增仪 PTC-200为美国MJ公司产品,CHEF MAPPER、凝胶成像仪Gel-DocXR为Bio-RAD公司产品。
1.3 血清分型试验 采用玻片凝集法分别进行O抗原与H抗原检测,查表获得沙门菌属相应的血清型。
1.4 药物敏感性试验 用生理盐水将待测菌调制成0.5 MCF浊度,取10 μL加入11 mL的肉汤管中混匀,取50 μL混匀后的肉汤菌悬液加入药敏板中,37 ℃培养24 h。
1.5 沙门菌毒力基因检测 PCR检测所用模板采用煮沸法,引物由中国CDC传染病所设计,上海生工合成,IvnA-F: 5′-AACTTTATTGGCGGTATTTC-3′, IvnA-R: 5′-CGTAACAACCAATACAAATG-3′; IvnE-F: 5′-GGCGGAAGTACAGAAATTTG-3′, IvnE-R: 5′-ACGTTGGTAGCCATAACTGG-3′。PCR扩增程序:IvnA 94℃ 5 min,(94 ℃ 45 s,52℃ 45 s,72℃ 60 s)35,72℃ 10 min; IvnE 94 ℃ 5 min,(94 ℃ 45 s,50 ℃ 45 s,72 ℃ 60 s)35,72℃ 10 min。
1.6 沙门菌脉冲场凝胶电泳(PFGE)分型 选择血清学检测结果同型的鼠伤寒沙门菌和肠炎沙门菌进行PFGE分型。实验方法和参数参照TraNet china指导手册和相关文献[2-5]。操作步骤:首先用CSB溶液将试验菌调制成4.0~4.5 OD值的菌悬液制备小胶条;室温冷却15 min后将小胶条放入CLB溶液中裂解1 h;然后用去离子水洗2次,TE洗4次;再用XbaI酶切2 h,弃去酶切液,用0.5×TBE缓冲,逐个取出小胶条用梳齿粘贴上样法制备1%大胶块,接着电泳、染色、拍照和分析结果。电泳参数是:温度14 ℃,电压6.0 V,夹角120°,线性梯度变化2.16 s~63.80 s,电泳时间18 h;Bionumberics 6.6cn分析电泳图谱。
2 结 果
2.1 沙门菌血清型分布 在分离的43株沙门菌中:鼠伤寒沙门菌17株,肠炎沙门菌11株,辛川沙门菌2株,布伦登卢普沙门菌2株,德尔卑沙门菌2株,伤寒沙门菌1株,甲、乙型副伤寒各1株,汤卜逊沙门菌、利物浦沙门菌、达布沙门菌、猪霍乱沙门菌、伊斯特本沙门菌、阿伯丁沙门菌各1株。
2.2 药敏试验 43株沙门菌对大部分抗生素均较敏感,其中对环丙沙星和头孢西丁高度敏感,对四环素、奈丁酸和甲氧苄啶/磺胺甲噁唑耐药率较高,见表1。
2.3 沙门菌毒力基因检测 43株沙门菌PCR检测全部携带InvA和InvE毒力基因。部分菌株电泳图见图1。

表1 43株沙门菌对8种抗生素的敏感性检测结果

图1 部分Inv-A、Inv-E基因电泳图
2.4 17株鼠伤寒沙门菌和11株肠炎沙门菌PFGE分型 血清型相同的17株鼠伤寒沙门菌中基因型100%同源的有2组,共4株菌;同源性96.6%有2组,共4株菌;同源性96%有1组,共3株菌(其中2株100%同源)。其余菌株同源性较低。
血清型相同的11株肠炎沙门菌中基因型100%同源的有3组,共8株菌;同源性96.3%有1组,共5株菌(其中的2株100%同源,另外3株100%同源);同源性96%有1组,共2株菌。其余菌株同源性较低。
PFGE电泳图见图2~3,Bionumberics 6.6cn分析结果见图4~5。
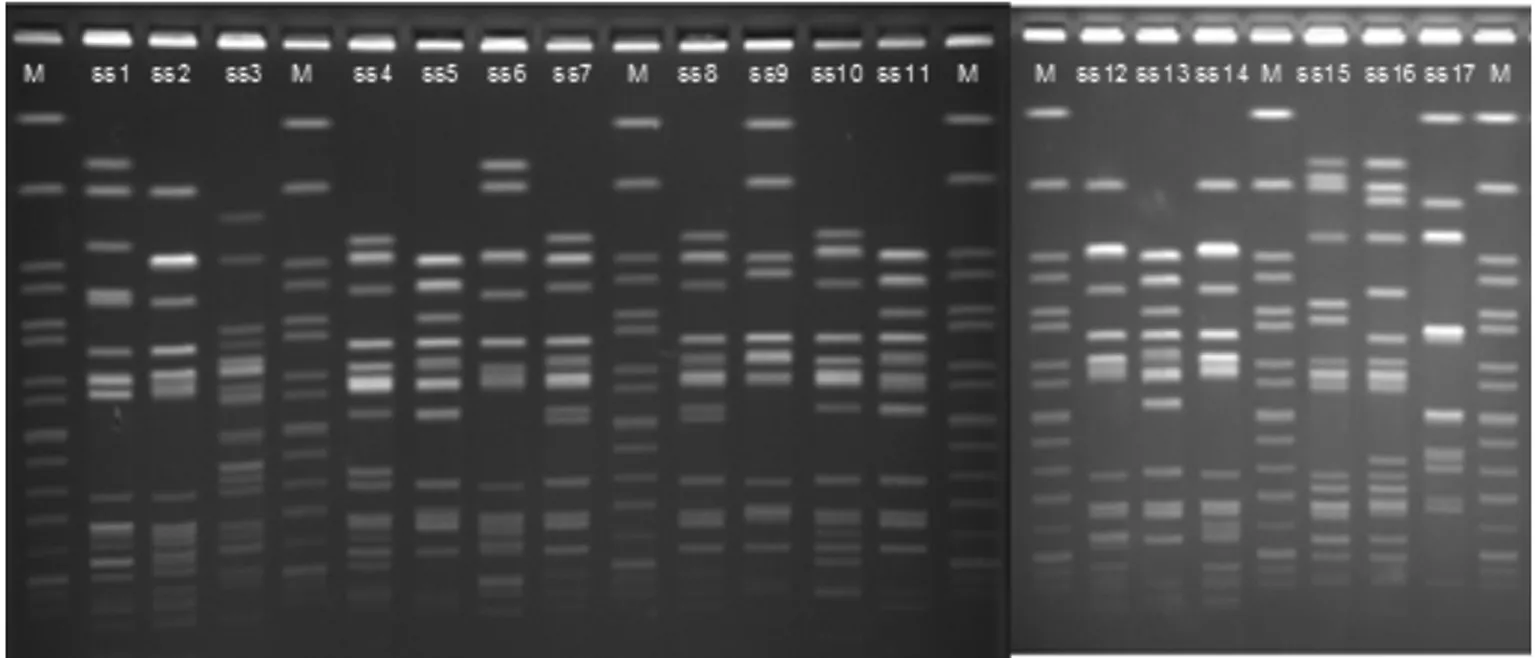
图2 17株鼠伤寒沙门菌PFGE电泳图
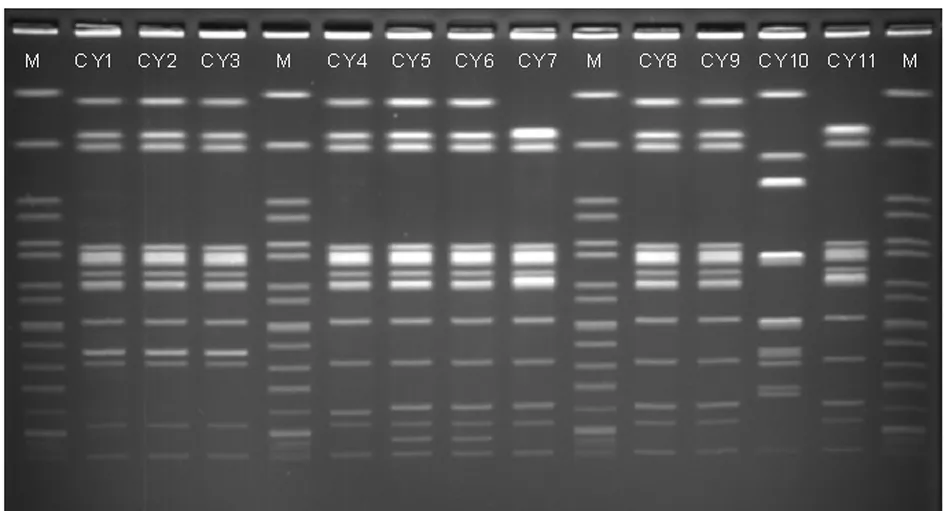
图3 11株肠炎沙门菌PFGE
Fig.3 PFGE electrophoresis of 11 strains ofSalmonellaenteritidis
3 讨 论
本次检测的43株沙门菌来自全省的5家医院,以安徽省儿童医院和宁国市人民医院为主,血清学分型结果显示以鼠伤寒沙门菌和肠炎沙门菌为主,其他血清型散在分布。本次检测结果与国内多个地区报道的流行情况近似[5-8]。药敏结果显示43株沙门菌对庆大霉素、环丙沙星和头孢菌素类较敏感,对四环素、奈丁酸、甲氧苄啶/磺胺甲恶唑和氯霉素呈现较高的耐药性。国内外也报道了沙门菌对上述几种抗生素较高的耐药情况[6,8-11]。毒力基因检测结果显示本次临床分离的43株沙门菌均携带InvA和InvE毒力基因,提示这43株沙门菌对人体均具有较强的致病性,在正常人群中不会携带。

图4 17株鼠伤寒沙门菌聚类图谱
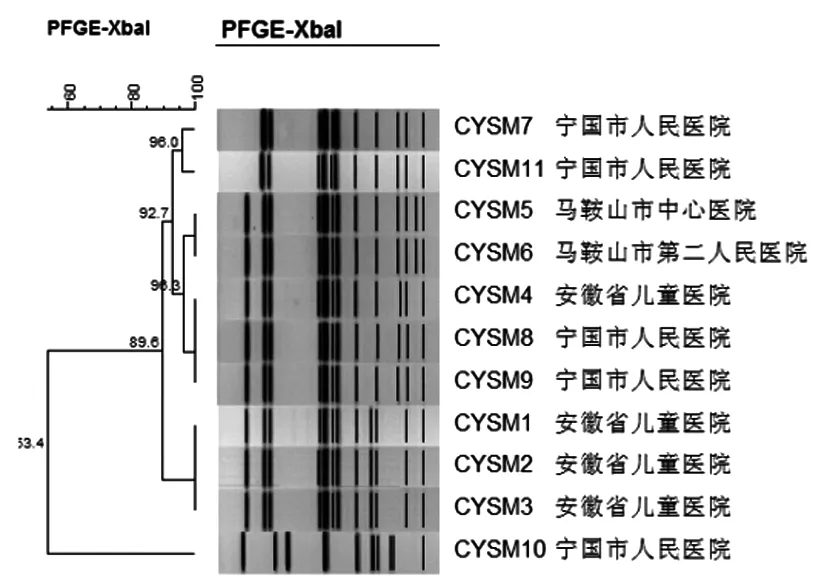
图5 11株肠炎沙门菌聚类图谱
本次PFGE分子分型试验的17株鼠伤寒沙门菌中有8株分离自安徽省儿童医院,6株分离自宁国市人民医院,其余3株分别分离自马鞍山市中心医院、马鞍山市第二人民医院和马鞍山市第四人民医院。分析结果提示:仅有2组100%同源,只有其中1组共2株菌分离自同一家医院,另外1组的2株菌分离自不同地区的两家医院。同源性达96%以上的各组菌株均分离自不同的医院。其余菌株之间同源性较低。以上论述提示2013年在安徽不同地区感染的鼠伤寒沙门菌同源性较低,就是在同一地区同一家医院分离的鼠伤寒沙门菌同源性同样也较低。因此可以推断出:在以上这些地区感染的鼠伤寒沙门菌是来自不同的克隆株,其亲缘关系较远。
本次PFGE分子分型试验的11株肠炎沙门菌中有5株分离自宁国市人民医院,4株分离自安徽省儿童医院,其余2株分别分离自马鞍山市中心医院和马鞍山市第二人民医院。分析结果提示:100%同源的总共有3组,各组中的菌株有分离自同一家医院的,也有同一地区不同医院的。同源性达96%以上的各组中有分离自同一家医院的,也有分离自不同地区医院的。以上论述提示,2013年在安徽省同一地区感染的肠炎沙门菌存在较高的同源性,此外在不同地区间感染的肠炎沙门菌也存在较高的同源性。因此可以推断出:在以上地区感染的肠炎沙门菌大部分来自同一克隆株或是亲缘关系较近的克隆群体。
[1]Gunagydin E, Eyigor A, Carli KT. A capillary polymerase chain reaction for Salmonella detection from poultry meat[J]. Appl Microbiol, 2007, 44: 24-29. DOI: 10.1111 / j. 1472 -765 X.2006.02033.x
[2]Hernandez SM, Keel K, Sanchez S, et al. Epidemiology of a Salmonella enterica subsp. enterica serovar typhimurium strain associated with a songbird outbreak[J]. Appl Environmental Microbiol, 2012, 78(20): 7290-7298.DOI: 10.1128/aem.01408-12
[3]Hendriksen RS, Le Hello S, Bortolaia V, et al. Characterization of isolates of Salmonella enterica serovar stanley, a serovar endemic to Asia and associated with travel[J]. J Clin Microbiol, 2012, 50(3): 709-720. DOI:10.1128/JCM.05943-11
[4]Matthew LR, Chunlei S, Andrea IMS, et al. Comparison of typing methods with a new procedure based on sequence characterization for Salmonella serovar prediction[J]. J Clin Microbiol, 2013, 51(6): 1786-1797.DOI: 10.1128/JCM.03201-12
[5]Liu X, Hao Q, Guo BC, et al. Epidemiological characteristics of salmonella species in Ningxia area during 2007 to 2011[J]. Chin J Zoonoses, 2012, 28(5): 506-508. (in Chinese) 刘翔,郝琼,郭邦成,等. 2007-2011年宁夏地区沙门氏菌分布特征分析[J].中国人兽共患病学报,2012,28(5):506-508.
[6]Cheng CR, Shen YL, Dong K, et al. Serum type and antibiotic resistance ofSalmonellaspp. in infectious diarrhea cases from Zhengzhou City, 2006-2011[J]. Chin J Zoonoses, 2012, 28(10): 1017-1019. (in Chinese) 程春荣,沈艳丽,董柯,等. 郑州市2006-2011年腹泻病人沙门菌血清型和耐药谱分析[J].中国人兽共患病学报,2012,28(10):1017-1019.
[7]Shen FJ, Su F, Wang Y, et al. Analysis on epidemiologic characteristics ofSalmonellainfection and serotype distribution in Huangpu District, Shanghai[J]. Chin J Dis Ctrl Prev, 2012, 16(11): 958-960. (in Chinese) 沈福杰,宿飞,王宇,等. 上海市黄浦区沙门氏菌感染特征及主要血清型分析[J]. 中华疾病控制杂志, 2012, 16(11):958-960.
[8]Long DL, Zhuo F, Li JH, et al. Serotype distribution and antibiotic resistance ofSalmonellain Luohu district of Shenzhen in 2012[J]. Chin J Health Lab Tec, 2014, 24(2): 285-291. (in Chinese) 龙冬玲,卓菲,黎剑华,等. 2012年深圳市罗湖区沙门菌菌型分布及耐药情况分析[J].中国卫生检验杂志,2014,24(2):285-291.
[9]Alessandr A, Lorena S, Eugenio P, et al. Molecular typing ofSalmonellaentericasubspecies enterica serovar Typhimurium isolated in Abruzzo region (Italy) from 2008 to 2010[J]. Veterinaria Italiana, 2014, 50(1): 31-39. DOI:10.12834/VetIt.1304.07
[10]Le Hello S, Bekhit A, Granier SA, et al. The global establishment of ahighly-fluoroquinolone resistantSalmonellaentericaserotype Kentucky ST198 strain[J]. Microbiology, 2013, 4(395): 1-10. DOI:10.3389/fmicb.2013.00395
[11]Camarda A, Pugliese N, Pupiollo A, et al. Resistance genes, phage types and pulsed field gel electrophoresis pulsotypes in Salmonella enterica strains from Laying Hen Farms in Southern Italy[J]. Int J Environ Res Public Health, 2013, 10: 3347-3362. DOI:10.3390/ijerph10083347
Isolation and serotype identification ofSalmonellain feces of diarrhea patients in Anhui Province, China
FANG Xin1,LI Chun2
(1.AnhuiMedicalCollege,Hefei230601,China)2.AnhuiProvincialCenterforDiseaseControlandPrevention,Hefei230601,China)
We investigated the serotype, drug sensitivity, virulence gene and gene traceability ofSalmonellaisolated from the clinical in Anhui Province, which could provide the reference data for epidemiology of diarrhea caused bySalmonella. Serum agglutination was used to detectSalmonellaserotype; drug sensitivity was tested by broth microdilution method; PCR was used for virulence gene and PFGE for gene homology and traceability.SalmonellatyphimuriumandSalmonellaenteritidiswere 39.5% and 29.6% respectively in 43Salmonella, the isolates were resistant to tetracycline, trimethoprim / sulfamethoxazole, chloramphenicol, and nalidixic acid, and the resistance rate were 60.5%, 39.5%, 37.2% and 30.2%, respectively. The isolates were all carrying InvA and InvE virulence genes. The gene homology was low inSalmonellatyphimurium, which was high in Salmonella enteritidis. The major serotypes wereSalmonellatyphimuriumandSalmonellaenteritidisofSalmonellaisolated from clinical in Anhui area. The isolates were resistant to commonly used antibiotics and carried virulence genes. The local prevalence ofSalmonellatyphimuriumwas mostly from different gene clones, which were not closely related. The otherSalmonellaenteritidismostly derived from the same clone or the clone with a closer relationship.
Salmonella; serotype; virulence gene; gene homology
LI Chun,Email:lichun0218@126.com
李春,Email:lichun0218@126.com
1.安徽医学高等专科学校,合肥 230601; 2.安徽省疾病预防控制中心,合肥 230601
10.3969/cjz.j.issn.1002-2694.2015.02.009
R378
A
1002-2694(2015)02-0135-04
2014-08-17;
2014-12-22

