eha基因调控迟缓爱德华菌的毒力
2015-03-17盛安康李玉红祝如愿刁亦非周佳莹高大庆陆承平
盛安康,李玉红,张 坡,祝如愿,刁亦非,周佳莹,高大庆,陆承平
eha基因调控迟缓爱德华菌的毒力
盛安康1,李玉红1,张 坡1,祝如愿1,刁亦非1,周佳莹1,高大庆1,陆承平2
目的eha基因是E.tarda毒力株ET-13一个重要的转录调控基因,本文研究其对该菌株毒力的影响。方法 利用菌落计数法比较野生株和eha缺失株感染小鼠毒力(LD50)的差异,以及比较两菌株在小鼠每个肝脏、脾脏和肾脏中细菌菌落数目的差异;利用组织HE染色观察两菌株对宿主组织损伤的差异;利用RT-PCR,比较两种细菌毒力基因表达的差异。结果eha缺失株相比野生株其毒力下降了2.5倍;eha缺失株在宿主体内的生存能力明显降低。小鼠感染野生株后,出现肝细胞水肿和中性粒细胞浸润,脾小体内细胞坏死,肾小管水肿等病变,以及上述脏器外观出现改变。提示野生株对小鼠的肝脏、脾脏和肾脏有毒性作用,而eha缺失株对上述脏器无明显毒性作用。RT-PCR结果显示,eha基因的缺失使得E.tarda菌的Ⅲ型分泌系统分泌蛋白基因eseC和外膜蛋白基因(pagC)的转录水平下降,菌毛蛋白基因(fimA)的转录水平没有改变。结论eha基因缺失后,E.tarda菌 ET-13株的毒力因子表达降低,使该菌毒力明显减弱,对宿主的致病性和病理损伤减轻。因此,eha基因是一个毒力正调控基因。
eha基因;E.tarda;毒力
迟缓爱德华菌(Edwardsiellatarda,E.tarda)属于肠杆菌科爱德华菌属,分布广泛,可感染鱼类、两栖类、爬行类、鸟类及哺乳类等。E.tarda能够引起多种鱼类感染,是水产养殖业的重要病原体[1]。E.tarda也可感染人,可引起人的胃肠炎、败血症和脑膜炎等多种疾病。高大庆等用鸟枪法在E.tarda中发现的一个溶血活化基因(E.tardahaemolysin activator gene,简称eha),前期的研究表明Eha蛋白是一个重要的转录调控因子,能够调控E.tarda的某些毒力因子,并通过自杀质粒和同源重组原理,获得ET-13毒力株的eha缺失株[2-4]。
本研究首先建立E.tarda菌感染小鼠模型,比较ET-13毒力株野生型和eha缺失型毒力的差异,并比较两者在宿主体内的生存能力的差异和对宿主损伤的差异,进一步比较两种细菌毒力基因表达的差异,明确 Eha蛋白是一个影响E.tarda毒力的正调控因子。
1 材料与方法
1.1 材料
1.1.1 菌株和培养基E.tarda毒力株ET-13由南京农业大学陆承平教授惠赠。ET-13的eha缺失株(Δeha)和Δeha互补株(ehaComp)由本室保存[3]。细菌采用LB(Luria Broth)培养基来培养。
1.1.2 实验动物 BALB/c二级小鼠,6 w龄,雌性,购自扬州大学动物模式中心。
1.2 方法
1.2.1 细菌菌液准备 离心收集对数期细菌,无菌PBS清洗2次细菌沉淀后,细菌重悬至 OD600为0.5(约108cfu/mL), 10倍梯度稀释菌液, 取合适稀释度涂布于LB平板, 进行菌落计数。
1.2.2 细菌小鼠毒力实验(LD50) 采取腹腔注射的方式感染小鼠,接种每只小鼠的细菌剂量依次为106、5×106、107、5×107、108、5×108和109(colony formation unit, cfu),每只小鼠200 μL。112只小鼠分为两大组,分别用野生株和缺失株感染。每大组内按照接种细菌剂量不同,分为7小组,每小组8只。在感染后28 d内观察小鼠死亡情况,并记录数据,采用RM6240生物信号采集处理系统软件,分别计算野生株和缺失株的半数致死量(median lethal dose ,LD50)。
1.2.3 细菌在小鼠体内存活实验 实验动物分为2组:野生株组和eha缺失株组。接种每只小鼠的细菌剂量5×106cfu /mL,每只小鼠200 μL;在感染后不同时间点(1 d、3 d、5 d、7 d、9 d、11 d),每个时间点断脊处死每组5只小鼠,无菌操作迅速取出肝脏、脾脏和肾脏加入1 mL含有0.1%TritonX-100的PBS,用玻璃匀浆器制成匀浆,取组织匀浆进行10倍系列稀释,选取适当稀释度的匀浆液100 μL涂LB平板,计算每个时间点每组细菌菌落数目的平均值。
1.2.4 细菌感染后小鼠脾脏和肝脏病理的改变: 实验动物分为3组(9只/组):野生株组、eha缺失株组和PBS对照组。接种每只小鼠的细菌剂量5×106cfu /mL,每只小鼠200 μL;在感染后1 d、3 d和5 d 断脊处死小鼠,迅速解剖,取出小鼠的肝脏、脾脏和肾脏组织进行观察和称重,计算器官重量;先用PBS洗去血液,再浸于10%中性福尔马林溶液中固定48 h;经冲洗、脱水、常规石蜡包埋,制成4 μm~5 μ m切片后进行苏木素-伊红(HE)染色,Olympus BX50生物显微镜观察。
1.2.5 RT-PCR 按Trizol试剂盒说明书,提取细菌RNA,取2 μg RNA逆转录成cDNA。再以cDNA为模版,用Ⅲ型分泌系统的分泌蛋白基因(secretary protein,eseC)、菌毛蛋白基因(fimbria,fimA)和外膜蛋白基因(pagC)的引物(见表1),分别扩增上述基因,以扩增16S rRNA基因作为内标参照,半定量检测各基因的转录水平。

表1 RT-PCR引物序列和产物
2 结 果
2.1 腹腔注射ET-13毒力株感染小鼠的毒力实验(LD50)结果如表2所示,采用RM6240生物信号采集处理系统软件,计算出野生株对小鼠的LD50(半数致死量)为4.64×107cfu;eha缺失株对小鼠的LD50(半数致死量)为12.7×107cfu,eha缺失株的毒力低于野生株的毒力约2.5倍,因此,eha基因能够增强E.tarda菌ET-13株的毒力。
2.2 比较野生株和缺失株感染小鼠后(腹腔注射),在肝、脾和肾中细菌存活数目的差异。如图1显示, 和野生株比较,缺失株虽然也入侵肝脏(1A)、脾脏(1B)和肾脏(1C),但在这些器官内检出的细菌数量明显低于野生株,而且很快被清除,表明eha缺失株在宿主体内的生存能力明显降低。
2.3 比较野生株和缺失株分别感染小鼠后,其肝脏、脾脏和肾脏外观的差异 在解剖小鼠时发现,感染野生株组小鼠的器官外观均大于缺失株组和对照组。感染3 d后,野生株组小鼠的脾脏外观显著大于缺失株组和对照组;感染5 d后,野生株组小鼠的肝脏和肾脏 外观显著大于缺失株组和对照组;而感染缺失株组后,小鼠的器官外观和对照组对比相差不大。
表2 比较野生株和缺失株对小鼠半数致死量(LD50)的差异
Tab.2 Comparison of difference of LD50of mice infected with the wild and the Δeha

细菌菌落数CFU动物数量AnimalmountThewildMortuus/survival△ehaMortuus/survival1×10988/08/05×10887/16/21×10885/33/55×10783/51/71×10782/60/85×10681/70/81×10680/80/8Total5626/3018/38LD504.64×1071.27×108
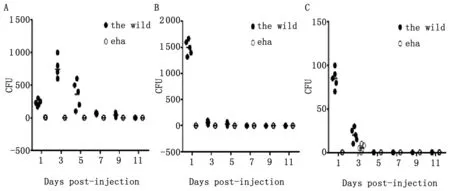
图1 比较E.tarda野生株和缺失株在小鼠肝脾肾中存活数的差异
Fig.1 Comparison of differences between the survival viabilities of the wild ofE.tardain the liver, spleen and kidney of mice and ones of the ΔehaofE.tarda
2.4 比较野生株和缺失株感染小鼠(腹腔注射)后,对小鼠组织的病理损伤的差异。其中细菌感染1 d后,光学显微镜下肝脏、脾脏和肾脏的病理变化最明显(图2):野生株感染肝脏的病理改变,主要是以中性粒细胞浸润为主的炎性反应,出现肝细胞水肿(2B),脾小体内细胞坏死(2E),肾小管水肿(2H)等病变,提示野生株对小鼠的肝脏,脾脏和肾脏有一定的毒性作用。而缺失株对肝脏(2C),脾脏(2F)和肾脏(2I)无明显毒性作用,与空白组肝脏(2A),脾脏(2D)和肾脏(2G)相同。这说明eha基因缺失以后,E.tarda菌的毒力明显减弱,对宿主的病理损伤减轻。
2.5 RT-PCR显示eha基因对毒力基因的调控作用 如图3所示,缺失株Δeha中外膜蛋白基因(pagC)和Ⅲ型分泌系统分泌蛋白基因C (eseC)的转录水平比野生株明显降低,互补株ehaComp中这些基因的转录水平处于野生株和缺失株之间。菌毛蛋白基因(fimA)在3个菌株中转录水平无明显差异(图3),结果提示eha基因对外膜蛋白基因pagC和Ⅲ型分泌系统分泌蛋白eseC有正调控作用。
3 讨 论
细菌的调控系统被认为参与细菌生理和毒力的调控网络中, 它可以调控许多毒力相关基因的表达,进而影响致病菌的毒力。大多数调控系统是二元信号转导系统如E.tarda的双组分系统PhoP-PhoQ和EsrA-EsrB[5],是由一个跨膜感受器蛋白(sensor protein,SP)和应答调节蛋白(response regulator protein, RRP)组成,而有些反应调节因子是一个SP和RRP杂合蛋白,独自响应宿主环境的变化来进行调控,因此称其为“独立”的反应调节因子[6],Eha就是这样一个重要的转录调控因子。
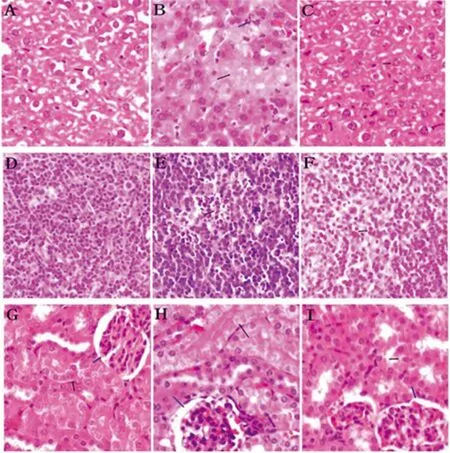
图2 比较野生株和eha缺失株感染小鼠1d后肝脏、脾脏、肾脏的病理损伤
Fig.2 Comparison of difference between pathological damage of the liver, spleen and kidney of mice infected by the wild and ones infected by the Δehaafter 1 day
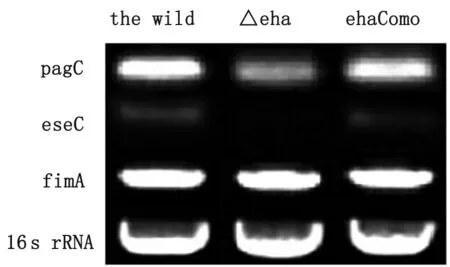
图3 比较野生株和eha缺失株外膜蛋白基因C、菌毛蛋白基因A和Ⅲ型分泌系统分泌蛋白C转录水平的差异
Fig.3 Comparison of difference between the transcriptional levels ofpagC,fimA andeseCof the wild ofE.tardaand ones of the ΔehaofE.tarda
高大庆等[2]用鸟枪法从Et菌的染色体中克隆到一个溶血相关基因,其克隆子在绵羊血平板上有狭窄的β溶血环, 命名为溶血活化基因(GenBank登录号为:29533)。eha基因进行测序,并BLAST比对发现,eha基因和肠杆菌科中MarR/SlyA调控因子家族中的slyA调控基因[7]有68%的同源性。关于slyA已有较多研究,它在S.typhimurium中可以上调Ⅲ型分泌系统(T3SS)[8]、耐酸蛋白和细胞溶素,下调一些生物合成酶,并被证实参与细菌毒力和环境适应方面。病原菌的Ⅲ型分泌系统(T3SS)拥有一个针状的结构,能够将细菌合成的毒力效应蛋白直接输送到宿主细胞基质中,改变宿主细胞的功能。Ⅲ型分泌系统和外膜蛋白PagC都是沙门菌重要的毒力因子,有利于S.typhimurium在鼠腹腔巨噬细胞内生存和繁殖[9-10]。前期的研究表明Eha蛋白是E.tarda菌一个重要的转录调控因子[4]。本实验用E.tarda感染小鼠的毒力实验(LD50)结果表明,eha基因正调控细菌毒力。不仅影响细菌ET-13毒力株在小鼠体内存活能力,而且影响细菌对宿主病理的损伤。进一步采用RT-PCR证明eha基因正调控E.tarda的某些重要的毒力因子,如Ⅲ型分泌系统和外膜蛋白PagC,是一个毒力正调控基因。
[1]Chen AP, Jiang YL, Qian D, et al. Edwardsiellasis[J]. China Fisheries, 2011, 7: 49-50. (in Chinese) 陈爱平,江育林,钱冬等. 迟缓爱德华氏菌病[J].中国水产,2011,7:49-50.
[2]Gao D, Kan B, Lu CP, et al. Primary analysis and sequencing the hemolytic relative gene ofEdwardsiellatarda[J]. J Genetics Genomics, 2001, 25(12): 1162-1167. (in Chinese) 高大庆,阚飙,陆承平,等.迟缓爱德华菌溶血相关基因的测序和初步的功能分析[J].遗传学报,2001.25(12):1162-1167.
[3]Zheng EJ, Gao DQ, Hong J, et al. eha, a regulating virulence gene ofEdwardsiellatarda[J]. Chin J Zoonoses, 2010, 26(11): 999-1003. (in Chinese) 郑恩金,高大庆,洪捷,等.eha,迟缓爱德华菌一个毒力调控基因[J].中国人兽共患病学报, 2010,26(11): 999-1003.
[4]Gao D, Cheng J, Zheng E, et al. Eha, a transcriptional regulator of hemolytic activity ofEdwardsiellatarda[J]. FEMS Microbiol Lett, 2014, 353(2): 132-140. DOI: 10.1111/1574-6968.12420
[5]Lv Y, Xiao J, Liu Q, et al. Systematic mutation analysis of two-component signal transduction systems reveals EsrA-EsrB and PhoP-PhoQ as the major virulence regulators inEdwardsiellatarda[J]. Vet Microbiol, 2012, 157(1/2): 190-199. DOI: 10.1016/j.vetmic.2011.12.018
[6]Kato H, Chibazakura T, Yoshikawa H. NblR is a novel one-component response regulator in the cyanobacteriumSynechococcuselongatusPCC 7942[J]. Biosci Biotechnol Biochem, 2008, 72(4): 1072-1079.
[7]Dolan KT, Duguid EM, He C. Crystal structures of SlyA protein, a master virulence regulator of Salmonella, in free and DNA-bound states[J].J Biol Chem, 2011, 286(25): 22178-22185. DOI: 10.1074/jbc.M111.245258
[8]Linehan SA, Rytkonen A, Yu XJ, et al. SlyA regulates function ofSalmonellapathogenicity island 2 (SPI-2) and expression of SPI-2-associated genes[J]. Infect Immun, 2005, 73(7): 4354-4362.
[9]Nishio M, Okada N, Miki T,et al. Identification of the outer-membrane protein PagC required for the serum resistance phenotype inSalmonellaenteric serovar Choleraesuis[J]. Microbiology, 2005, 151: 863-873.
[10]Figueira R, WatsonKG, Holden DW, et al. Identification of salmonella pathogenicity island type III secretion system effectors involved in intramacrophage replication of S. enterica serovar typhimurium: implications for rational vaccine design[J]. MBio, 2013, 4(2) eooo65. DOI:10.1128/mBio.00065-13
ehagene regulates the virulence ofEdwardsiellatarda
SHENG An-kang1,LI Yu-hong1,ZHANG Po1,ZHU Ru-yuan1,DIAO Yi-fei1,ZHOU Jia-ying1,GAO Da-qing1,LU Cheng-ping2
(1.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China;2.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
Theehagene is an important transcriptive regulating gene inE.tardavirulence strain ET-13. We explored the gene for regulation of the virulence of ET-13. By comparing the differences between LD50of the wild strain and that of the Δehastrain to mice, the LD50of Δehawas 2.5 times more than that of the wild, which indicated that the virulence of the Δehawas decreased. The numbers of the Δehastrains was significantly lower than those of the wild in a liver, a spleen and a kidney of mice post infection, which indicated that the survival viability of Δehastrains in hostinvivodecreased obviously. In order to compare the host pathological damages caused by the two kinds of strains, these tissues changes infected with the wild and the Δehawere microscopically analyzed. Results showed that the liver cells edema and neutrophil infiltration, spleen cells necrosis and edema of the renal tubules lesions occurred after the mice were infected by the wild, which indicated that the wild was toxic effects to the liver, spleen and kidney, while the Δehawasn’t. Results by RT-PCR showed that the transcriptional levels of T3SS secretion protein gene C (eseC) and OMP gene (pagC) in the Δehawere significantly lower than those in the wild. Results showed that as the lower virulence factors were expressed in the Δeha, the bacterial virulence and host pathological changes were decreased significantly. Therefore,ehagene is a positive regulating gene of the virulence ofE.tarda.
ehagene;E.tarda; virulence
Gao Da-qing, Email: dgao2@yahoo.com
高大庆,Email:dgao2@yahoo.com
1.东南大学医学院,南京 210009; 2.南京农业大学动物医学院,南京 210095
10.3969/cjz.j.issn.1002-2694.2015.02.007
R378
A
1002-2694(2015)02-0125-05
2014-06-26;
2014-10-27

Supported by the SRTP Fund Depended on Teacher Research in Southeast University (No. 1124009015)
