PhoPR双组分信号转导系统对结核分枝杆菌持留性的调控机制研究
2015-03-17吴江东曹旭东李瑞山张玉清柳小玲张培培张万江
邬 博,雷 英,吴 芳,章 乐,吴江东,曹旭东,朱 彬,何 丽 ,李瑞山张玉清,王 钊,王 君,柳小玲,张培培,梁 粟,张万江
PhoPR双组分信号转导系统对结核分枝杆菌持留性的调控机制研究
邬 博1,雷 英2,吴 芳1,章 乐1,吴江东1,曹旭东1,朱 彬1,何 丽1,李瑞山1张玉清1,王 钊1,王 君1,柳小玲1,张培培1,梁 粟1,张万江1
目的 本研究通过诱导结核分枝杆菌在低氧环境中进入持留状态,来比较分析不同时间不同低氧环境下结核分枝杆菌中的PhoP基因和PhoR基因的表达水平差异,探讨研究PhoPR双组分信号转导系统对结核分枝杆菌持留性的调控机制。方法 首先对结核分枝杆菌国际标准无毒株(H37Ra)和结核分枝杆菌国际标准强毒株(H37Rv)在不同低氧环境下进行培养,提取每个样本菌株的总RNA,并进行完整性鉴定;运用SYBR Green I实时荧光定量PCR检测每个样本菌株中PhoP基因和PhoR基因的表达水平;比较分析不同时间不同低氧环境下的结核分枝杆菌菌株PhoP基因和PhoR基因的表达水平差异。结果 在不同时间点对低氧环境的结核分枝杆菌PhoP基因和PhoR基因的表达水平进行检测,结果显示:与第10 d相比,培养至第15 d时H37Rv菌株和H37Ra菌株中的PhoP基因和PhoR基因的表达水平均显著上调,差异有统计学意义(P<0.05);并且培养至第25 d时,H37Rv菌株中的PhoP基因和PhoR基因的表达水平比H37Ra菌株表达均上调2.34倍,差异有统计学意义(P<0.05)。结论 在不同时间点相同毒力的结核分枝杆菌的PhoPR双组分信号转导系统中PhoP基因和PhoR基因在不同低氧环境下的表达存在差异,而且在相同时间点不同毒力结核分枝杆菌的PhoPR双组分信号转导系统中PhoP基因和PhoR基因在不同低氧环境下的表达也存在差异,表明PhoPR双组分信号转导系统对结核分枝杆菌的持留性具有调控作用。
结核分枝杆菌;持留性;PhoPR双组分信号转导系统
结核分枝杆菌(Mycobacteriumtuberculosis, MTB)是引发结核病(tuberculosis, TB)的主要病原菌,其潜伏感染是导致活动性结核病的主要原因。因此对结核分枝杆菌潜伏感染的研究有助于降低活动性结核病的发病率和死亡率。有研究发现,结核分枝杆菌感染机体后大部分细菌能被机体清除,仅有少数细菌能够在机体内以一种非增殖的状态持久存在,并且这部分细菌对各种化疗药物不敏感[1-2],使用抗结核药物并不能杀死这部分持留菌。因此认为结核分枝杆菌的持留性能够使细菌在逆境中在组织内保持稳定和对环境的无反应性[3],该特性是导致结核病具有潜伏性的原因。
目前对结核分枝杆菌的持留性研究发现,部分细菌受到某些环境因子刺激后能够诱导表达促使其持留的相关基因[4],并且在恶劣的生存环境中结核分枝杆菌能够通过调控这些持留相关的基因的表达来实现其在宿主体内持留。但是目前对结核分枝杆菌在恶劣环境中是如何调控这些持留相关基因表达的仍然未被阐明。而结核分枝杆菌PhoPR双组分信号转导系统作为一个重要的调节细菌适应环境变化的系统,能够调控细菌自身的相关靶基因的表达,促使其适应宿主体内微环境的变化以达到持久存留在宿主体内的目的[5]。因此本研究通过在低氧环境中诱导结核分枝杆菌进入持留状态,来分析在不同低氧持留状态下结核分枝杆菌PhoPR双组分信号转导系统中PhoP基因和PhoR基因在结核分枝杆菌中的表达水平差异,进而揭示该系统是否对结核分枝杆菌持留性具有调控作用,并且进一步探讨了毒力差异是否对细菌的持留性的调控存在影响。
1 材料与方法
1.1 材料
1.1.1 菌株来源 结核杆菌国际标准强毒株(H37Rv)和结核杆菌国际标准无毒株(H37Ra)均来源于中国食品药品检定研究院,由本实验室保存。
1.1.2 主要仪器与试剂 SYBR Green I实时定量PCR仪(美国 Bio-Rad公司),Gel Doc2000凝胶成像系统(美国Bio-Rad公司),NanoDrop 2000超微量分光光度计(美国MDC公司),细菌RNA提取试剂盒RNeasy Plus Universal Midi Kit(德国QIAGEN公司),逆转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit(加拿大Fermentas公司),荧光定量试剂盒QuantiFast SYBR Green PCR Kit(上海凯杰生物技术有限公司),中性罗氏培养管(珠海贝索生物技术有限公司),Lysozyme、蛋白酶K均购自北京索莱宝科技有限公司,Goldview I核酸染料购自北京中生瑞泰科技有限公司,氯仿、无RNase酶枪头及离心管购自上海生物工程有限公司,无水乙醇购自山东潍坊金凯利华有限公司。
1.2 方法
1.2.1 结核分枝杆菌的培养及体外低氧诱导[6]本实验所使用H37Rv和H37Ra菌株已由实验室前期鉴定完成。将保存的H37Rv和H37Ra菌株分别接种到改良的罗氏固体培养基上,并在37 ℃恒温孵育箱孵育3~4周。挑取生长状态良好、菌落形态完整的菌落制备成菌悬液接种到7H9液体培养基中,并将其置于37 ℃恒温孵育箱培养至对数生长期(OD600~0.4)。然后将培养物稀释为OD600~0.1,并取5 mL稀释的培养物分装在含有15 mL 7H9新鲜培养基的试管中(试管口不密封),然后将试管置于含有5% CO2和5% O2的有氧环境[7]中37 ℃培养。另取5 mL稀释的培养物分装在15 mL 7H9新鲜培养基的试管中,拧紧试管盖并用封口膜密封试管口,然后将试管置于密闭性优良的培养箱中37 ℃培养,并在培养的不同时间点( 5 d、10 d、15 d、20 d、25 d)分别取不同低氧环境中的细菌均匀接种在中性罗氏培养管内并在37 ℃培养并观察有无菌落生长。同时收集不同时间点的各样本菌株抽提细菌总RNA。
1.2.2 结核分枝杆菌计数 将分别培养了5 d、10 d、15 d、20 d、25 d的各样本菌株进行一系列的10倍稀释,各取1 mL稀释菌液均匀接种到中性罗氏培养管内,不同时间点的每个样品菌株的每个浓度各接种3管,在37 ℃培养并进行菌落计数(CFU)。
1.2.3 结核分枝杆菌总RNA提取[8]分别收集不同时间点每个样本结核分枝杆菌(约250 mg)置于2 mL无酶EP管中,并向管内加入200 μL 1ⅹTE缓冲液和80 μL溶菌酶存储液,将其置于37 ℃恒温水浴锅内过夜。次日取出无酶EP管,向每管中分别加入20 μL蛋白酶K存储液,并置于42 ℃恒温水浴锅15 min后将细菌混合液强力混匀2 min。然后按照细菌RNA提取试剂盒的操作步骤抽提细菌总RNA。将获取的总RNA洗脱液分装到3只小型无酶PCR管中,分别用于逆转录成cDNA、检测RNA的完整性和RNA的纯度。
1.2.4 总RNA逆转为cDNA反应 按照逆转录试剂盒上的操作步骤将RNA逆转录为cDNA,并将逆转录的cDNA存储在-80 ℃冰箱备用。
1.2.5 应用实时荧光定量PCR检测目的基因PhoP和PhoR的表达 根据NCBI网站上提供的结核分枝杆菌的PhoP基因和PhoR基因的序列,应用Primer 5和Oligo 6软件设计PhoP、PhoR基因以及内参基因SigA寡核苷酸引物,引物序列见表1。并建立了适宜的的反应体系和条件。然后采用SYBR Green I实时荧光定量PCR仪配套的SDS2.1软件完成数据采集。根据ΔΔCt和2-ΔΔCt法求出各个菌株样本中PhoP基因和PhoR基因的相对表达量。

表1 PhoR基因、PhoP基因及内参基因SigA的引物序列
Note:F-Forward primer; R-Revevse priner.

2 结 果
2.1 MTB总RNA的提取 应用NanoDrop2000超微量分光光度计测量,吸光度比值(A260/A280在1.7~2.0之间,且A260>1, A260/A230>2.0);同时应用1%琼脂糖凝胶电泳对提取的总RNA进行完整性鉴定,23S RNA和16S RNA条带均清晰可见,并且23S条带亮度约是16S条带亮度的两倍,说明总RNA完整。
2.2 PhoP基因的表达量 在低氧持留状态下,H37Rv菌株和H37Ra菌株中在不同时间点的PhoP基因的ΔΔCt检测结果见表2,H37Rv菌株和H37Ra菌株中的PhoP基因相对表达水平见图1。统计结果显示:与第10 d相比,培养至15 d时H37Rv菌株和H37Ra菌株中的PhoP基因的表达水平分别上调了4.24倍和3.20倍,差异有统计学意义(P<0.05);并且在培养至第25 d时,H37Rv菌株中的PhoP基因的表达水平比H37Ra菌株表达上调2.34倍,差异有统计学意义(P<0.05)。
2.3 PhoR基因的表达量 在低氧持留状态下,H37Rv菌株和H37Ra菌株中在不同时间点的PhoR基因的ΔΔCt检测结果见表3,H37Rv菌株和H37Ra菌株中的PhoR基因相对表达水平见图2。统计结果显示:与第10 d相比,培养至第15 d时H37Rv菌株和H37Ra菌株中的PhoR基因的表达水平分别上调了3.45倍和2.71倍,差异有统计学意义(P<0.05);并且在培养第20 d和第25 d时,H37Rv菌株中的PhoR基因的表达水平比H37Ra菌株表达上调1.28倍和2.34倍,差异有统计学意义(P<0.05)。
表2 低氧环境下结核分枝杆菌的PhoP基因在不同时间点的ΔΔCt检测结果(n=5)
Tab.2 ΔΔCt test results of PhoP gene of MTB strains under low-oxygen conditions at various times (n=5)
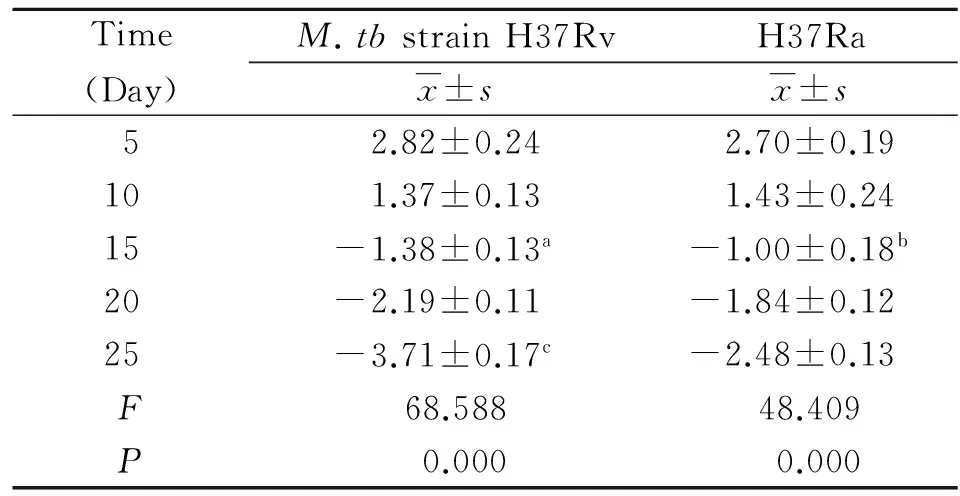
Time(Day)M.tbstrainH37RvH37Rax±sx±s52.82±0.242.70±0.19101.37±0.131.43±0.2415-1.38±0.13a-1.00±0.18b20-2.19±0.11-1.84±0.1225-3.71±0.17c-2.48±0.13F68.58848.409P0.0000.000
Note:aP<0.05, compared with the H37Rv at 10 days;bP<0.05, compared with the H37Ra at 10 days;cP<0.05, compared with the H37Ra at 25 days.

P<0.05, compared with the H37Ra at same time.
图1 低氧环境下结核分枝杆菌菌株在不同时间点的PhoP基因的相对表达水平
Fig.1 Relative expression levels of PhoP of MTB strains detected under low-oxygen conditions at various times
表3 低氧环境下结核分枝杆菌的PhoR基因在不同时间点的ΔΔCt检测结果(n=5)
Tab.3 ΔΔCt test results of PhoR gene of MTB strains under low-oxygen conditions at various times (n=5)

Time(Day)M.tbstrainH37RvH37Rax±sx±s53.36±0.693.64±0.21102.40±0.332.45±0.2115-1.48±0.37a-1.09±0.20b20-2.62±0.35-1.96±0.2625-3.76±0.35c-2.47±0.41F54.94150.140P0.0000.000
Note:aP<0.05, compared with the H37Rv at 10 days;bP<0.05, compared with the H37Ra at 10 days;cP<0.05, compared with the H37Ra at 25 days.

P<0.05, compared with the H37Ra at same time.
图2 低氧环境下结核分枝杆菌菌株在不同时间点的PhoR基因的相对表达水平
Fig.2 Relative expression levels of PhoR of MTB strains detected under low-oxygen conditions at various times
2.4 结核分枝杆菌菌落计数结果 将低氧环境下分别培养了5 d、10 d、15 d、20 d、25 d的各样本菌株进行一系列的10倍稀释,各取1 mL稀释菌液均匀接种到中性罗氏培养管内,不同时间点的各样品菌株的每个浓度接种3管,并在37 ℃培养28 d进行菌落计数(CFU)。结果见图3。
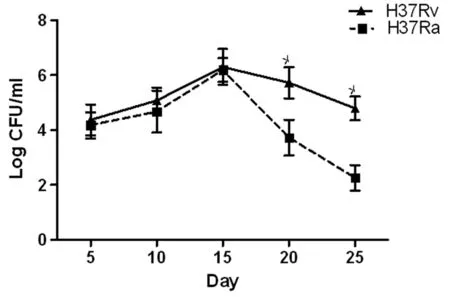
Note:P<0.05, compared with the H37Ra at same time.
图3 不同毒力菌株在不同时间点的菌落计数
Fig.3 Colony counts for MTB strains in different virulence determined in different time points.
3 讨 论
结核分枝杆菌能够在机体内长期处于潜伏状态,这可能与细菌的持留性有着密切关联。当结核分枝杆菌感染宿主后,其可以被宿主的免疫细胞吞噬包裹并形成结核肉芽肿。结核肉芽肿中的结核分枝杆菌将处于营养物质缺乏的环境中,为了适应这些不利环境的影响结核分枝杆菌将会调控自身相关基因表达来应对。但对于结核分枝杆菌在恶劣环境中是如何调控这些基因表达的仍然未被阐明。目前发现结核分枝杆菌具有11个双组分调控系统,其中PhoPR双组分信号转导系统对结核分枝杆菌处于低氧等恶劣生存环境中具有重要的调控作用。因此本研究通过对低氧环境下处于持留状态的结核分枝杆菌中的PhoP基因和PhoR基因的表达水平的研究,来揭示结核分枝杆菌在不同低氧持留状态下结核分枝杆菌PhoPR双组分信号转导系统是否对细菌的持留性具有调控作用。
有研究表明,结核分枝杆菌处于低氧环境下可被诱导进入持留状态[9]。而且本研究发现,H37Rv菌株和H37Ra菌株中的PhoP基因和PhoR基因的表达水平在不同低氧持留状态下的表达存在差异,并且随着氧的消耗和代谢废物的累积细菌的PhoR基因和PhoP基因的表达水平显著上调。同时对低氧环境下不同时间点培养的菌落形态观察发现,随着培养管中氧的消耗,活菌数量随之减少,菌落形态发生了改变,细菌生长速率减慢甚至停滞。这些结果提示结核分枝杆菌对低氧等不利环境的感知并调节代谢相关基因的表达可能受到了结核分枝杆菌PhoPR双组分信号转导系统调控,并且细菌处于低氧持留状态时可能通过下调新陈代谢和生物合成的相关通路基因的表达来应对外界不利环境[10],进而使其处于无反应的持留状态。
为了阐明结核分枝杆菌毒力差异对细菌持留性的影响是否受到PhoPR双组分信号转导系统调控,本实验对H37Rv菌株和H37Ra菌株在低氧持留状态中的PhoR基因和PhoP基因的表达水平进行比较,发现培养至第20 d和第25 d时H37Rv菌株的PhoR基因表达水平较H37Ra菌株分别表达上调,并且培养至第25 d时H37Rv菌株的PhoP基因表达水平较H37Ra菌株表达上调。而且对低氧环境下不同时间点培养的菌落观察发现,培养至第20 d和第25 d时的H37Rv菌株的活菌数比相同时间点的H37Ra菌株的活菌数多。这些结果均提示在低氧持留状态中毒力强的菌株适应环境变化的能力要比毒力弱的菌株强,并且毒力强弱菌株的持留性可能受到PhoPR双组分信号转导系统调控。而且也有研究发现H37Rv菌株在低氧持留状态下能够调节多个持留相关基因的表达来应对不利环境的影响[11]。
结核分枝杆菌的持留性对细菌逃避机体的免疫杀伤具有重要作用,而细菌对巨噬细胞微环境感应并作出应答反应调控的作用可能更有利于细菌的持留性产生和对宿主的免疫逃避[12]。本研究发现,在低氧持留状态中H37Ra菌株和H37Rv菌株的PhoP基因的表达均出现上调。这个结果提示PhoP作为结核分枝杆菌PhoPR双组分信号转导系统中一个重要的反应调节蛋白,它能够与PhoR相互协作来调控细菌相关持留基因的表达来应对外界微环境变化。并且有学者认为结核分枝杆菌PhoPR双组分信号转导系统能够与DosRST双组分系统协同发挥作用,研究发现PhoP基因缺失突变菌株对低氧环境反应迟钝,而且该突变菌株中的DosR基因的表达水平下调,这个结果提示细菌处于低氧持留状态时PhoP蛋白对DosR基因的表达可能存在调控作用[13]。而且DosRST双组分系统对细菌在初期低氧环境下的生存具有重要的作用,研究结果提示DosR基因缺失菌株在低氧环境下的生存能力显著低于野生型亲本菌株,而将野生型亲本菌株中的DosR基因重组到DosR基因缺失菌株中后,可以部分恢复该缺失菌株在低氧环境下的生存能力[14]。这些结果均提示在低氧持留状态下结核分枝杆菌PhoPR双组分信号转导系统与DosRST双组分系统对细菌的持留性可能具有协同的调节作用。
此外本实验研究发现在低氧初期时PhoR基因和PhoP基因的表达水平在第5 d和第10 d并没有统计学差异,这可能与细菌在低氧初期应答主要受到DosRST双组分系统调控有关[15 -16]。但随着氧的消耗和代谢废物的累积MTB为了耐受低氧环境的挑战,将启动PhoPR双组分信号转导系统来调控耐受低氧应答的相关基因表达。因此本实验发现PhoR基因和PhoP基因表达水平随着氧的消耗而表达增高。这表明结核分枝杆菌为了适应不利环境的影响调控了相关适应环境变化的靶基因的表达。而为了适度地调控这些基因表达,细菌中调节这些基因表达的调控基因也随之上调其表达水平。这也进一步提示结核分枝杆菌对外界环境变化的独特适应能力并不仅仅通过单一机制实现的,而是通过一系列复杂的调控应答机制来完成的。
结核分枝杆菌的持留性与细菌处于恶劣的生存环境时改变自身新陈代谢途径有关,而这些代谢途径的改变需要细菌的调控系统对其进行调节。因此本研究通过构建低氧环境来诱导结核杆菌进入持留状态,研究发现结核分枝杆菌PhoPR双组分信号转导系统对细菌持留性可能具有调控作用。这为进一步阐明潜伏感染时细菌持留性的调控作用提供了理论依据,也为研发新型抗潜伏感染的结核分枝杆菌药物提供了药物新靶点。
[1]Mccune RM, Feldmann FM, Lambert HP, et al. Microbial persistence. I. The capacity of tubercle bacilli to survive sterilization in mouse tissues[J]. J Exp Med, 1966, 123(3): 445-468.
[2]Mccune RM, Feldmann FM, Mcdermott W. Microbial persistence. II. characteristics of the sterile state of tubercle bacilli[J]. J Exp Med, 1966, 123(3): 469-486.
[3]Pan YX, Lu Y. Reaction to the bookM.tuberculosispersistence, latency, and dyug tolerance[J]. Chin J Tuberc Respir Dis,2005, 28(2): 141-143.(in Chinese) 潘毓萱, 陆宇. 《结核分枝杆菌持留性、潜伏性和药物耐受性》一文读后感[J]. 中华结核和呼吸杂志, 2005, 28(2): 141-143.
[4]Hampshire T, Soneji S, Bacon J, et al. Stationary phase expression ofMycobacteriumtuberculosisfollowing a progressive nutrient depletion:a model for persistent organisms?[J]. Tuberculosis (Edinb), 2004, 84(3/4): 228-238. DOI: 10.1016/j.tube.2003.12.010
[5]Walters SB, Dubnau E, Kolesnikova I, et al. TheMycobacteriumtuberculosisPhoPR two-component system regulates genes essential for virulence and complex lipid biosynthesis[J]. Mol Microbiol, 2006, 60(2): 312-330. DOI: 10.1111/j.1365-2958.2006.05102.x
[6]Wayne LG, Hayes LG. Aninvitromodel for sequential study of shiftdown ofMycobacteriumtuberculosisthrough two stages of nonreplicating persistence[J]. Infect Immun, 1996, 64(6):2062-2069.
[7]Ghodbane R, Raoult D, Drancourt M. Dramatic reduction of culture time ofMycobacteriumtuberculosis[J]. Sci Rep, 2014, 4: 4236. DOI: 10.1038/srep04236
[8]Michelle MG, Lucia M, Ronald WR, et al. Ald ofMycobacteriumtuberculosisencodes both the alanine dehydrogenase and the putative glycine dehydrogenase[J]. J Bacteriol, 2012, 194(5): 1045-1054. DOI: 10.1128/JB.05914-11
[9]Boon C, Dick T.MycobacteriumbovisBCG response regulator essential for hypoxic dormancy[J]. J Bacteriol, 2002, 184(24): 6760-6767. DOI: 10.1128/JB.184.24
[10]Allenby NEE, Laing E, Bucca G, et al. Diverse control of metabolism and other cellular processes inStreptomycescoelicolorby the PhoP transcription factor: genome-wide identification ofinvivotargets[J]. Nucleic Acids Research, 2012, 40(19): 9543-9556. DOI: 10.1093/nar/gks766
[11]Fang X, Wallqvist A, Reifman J. Modeling phenotypic metabolic adaptations ofMycobacteriumtuberculosisH37Rv under Hypoxia[J]. PLoS Comput Biol, 2012, 8(9): e1002688. DOI: 10.1371/journal.pcbi.1002688
[12]Noton KD, Joel SB. Systems biology-based identification ofMycobacteriumtuberculosispersistence genes in mouse lungs[J]. mBio, 2014, 5(1): e1066-13. DOI: 10.1128/mBio.01066-13
[13]Majumdar SD, Vashist A, Dhingra S, et al. Appropriate DevR(DosR)-Mediated signaling determines transcriptional response, hypoxic viability and virulence ofMycobacteriumtuberculosis[J]. PLoS ONE, 2012, 7(4): e35847. DOI: 10.1371/journal.pone.0035847
[14]Jesus GA, Mostowy S, Huygen K, et al. PhoP: a missing piece in the intricate puzzle ofMycobacteriumtuberculosisvirulece[J]. PLoS ONE, 2008, 3(10): e3496. DOI: 10.1371/journal.pone.0003496
[15]Bartek IL, Rutherford R, Gruppo V, et al. The DosR regulation ofM.tuberculosisand antibacterial tolerance[J]. Tnberculosis (Edinb), 2009, 89(4): 310-316. DOI: 10.1016/j.tube.2009.06.001
[16]Martin G, Stefan HEK.Mycobacteriumtuberculosis: success through dormancy[J]. FEMS Microbiol Rev, 2012, 36(3): 514-532. DOI: 10.1111/j.1574-6976.2012.00331.x
Regulatory mechanisms of PhoPR two-component signal transduction system inMycobacteriumtuberculosispersistence
WU Bo1,LEI Ying2,WU Fang1,ZHANG Le1,WU Jiang-dong1,CAO Xu-dong1,ZHU Bin1,HE Li1,LI Rui-shan1,ZHANG Yu-qing1,WANG Zhao1,WANG Jun1,LIU Xiao-ling1,ZHANG Pei-pei1,LIANG Su1,ZHANG Wan-jiang1
(1.DepartmentofPathogenicBiologyandImmunologyMedicalSchoolofShiheziUniversity/TheKeyLaboratoryofEndemicandEthnicDiseaseas,ShiheziUniversity,Shihezi832000,China;2.Department1ofGeriatrics,ShiheziPeople’sHospital,Shihezi832000,China)
In this study, we explored the regulatory mechanisms of PhoPR two-component signal transduction system inMycobacteriumtuberculosispersistence by analyzing the expression levels difference of PhoP gene and PhoR gene at various time in different oxygen conditions ofMycobacteriumtuberculosiswhich were induced persistent state under low-oxygen conditions. The international standard avirulent strains ofMycobacteriumtuberculosis(H37Ra) and the international standard virulent strains ofMycobacteriumtuberculosis(H37Rv) were cultured under different low-oxygen conditions, then the total RNA extracted from each sample strain and the integrity of the RNA were checked by gel electrophoresis. The expression of PhoP gene and PhoR gene were quantified by using SYBR Green I FQ-PCR. The expression levels difference of these genes were compared in different low-oxygen conditions ofMycobacteriumtuberculosis. The expression levels of PhoP gene and PhoR gene ofMycobacteriumtuberculosisunder low-oxygen conditions were measured at various times. The expression level of PhoP gene and PhoR gene of H37Rv strain and H37Ra strain cultured for 15 days compared with 10 days were significantly up-regulated (P<0.05); and the expression level of PhoP gene and PhoR gene of H37Rv strain cultured for 25 days were up-regulated by 2.34 times compared with H37Ra strain (P<0.05). In this study, there are differences under different low-oxygen conditions in the expression levels of PhoP gene and PhoR gene ofMycobacteriumtuberculosisPhoPR two-component signal transduction system at various time and same virulent strains, and there are differences under the same low-oxygen condition in the expression levels of PhoP gene and PhoR gene ofMycobacteriumtuberculosisPhoPR two-component signal transduction system at the same time and different virulent strains. Therefore, the system plays a regulatory role inMycobacteriumtuberculosispersistence.
Mycobacteriumtuberculosis; persistence; PhoPR two-component signal transduction system
Zhang Wan-jiang, Email:zwj1117@sina.com
国家自然科学基金资助项目(No.81260261, 81160192)
张万江, Email: zwj1117@sina.com
1.石河子大学医学院微生物学与免疫学教研室/石河子大学《新疆地方与民族高发病》教育部重点实验室,石河子 832000; 2.石河子市人民医院老年病一科,石河子 832000
10.3969/cjz.j.issn.1002-2694.2015.02.005
R378
A
1002-2694(2015)02-0116-05
2014-06-17;
2014-11-26

Supported by the National Natural Science Foundation of China (Nos.81260261 and 81160192)
