肠炎沙门菌ΔspiCΔcrp基因工程疫苗候选株的构建
2015-03-17李宝利严素惠潘志明耿士忠焦新安
曾 玲,李宝利,严素惠,潘志明,耿士忠,焦新安
肠炎沙门菌ΔspiCΔcrp基因工程疫苗候选株的构建
曾 玲,李宝利,严素惠,潘志明,耿士忠,焦新安
目的 构建肠炎沙门菌ΔspiCΔcrp双基因缺失株,以探索其作为新型基因工程疫苗的可能性。方法 以等位基因同源重组方法,在构建单基因缺失肠炎沙门菌ΔspiC基础上,运用λRed重组酶系统构建双基因缺失株肠炎沙门菌ΔspiCΔcrp。结果 PCR和抗生素抗性结果表明肠炎沙门菌ΔspiCΔcrp成功构建;生物学鉴定显示,与野生菌相比,其生长速度与生化特性发生了变化,LD50提高约1 000倍,毒力显著降低。结论 双基因缺失株肠炎沙门菌ΔspiCΔcrp被成功构建,为其作为疫苗的免疫学评价奠定基础。
肠炎沙门菌;crp;spiC;基因工程疫苗
肠炎沙门菌是一种重要的食源性人兽共患细菌病的致病菌,是研究较为广泛和深入的细菌之一。该菌易引起人的胃肠炎,但是也可以引起特定个体,如幼儿、老年人等免疫低下个体的侵袭性感染和肠热病[1]。
在家禽养殖业中,肠炎沙门菌可引起禽类的无症状隐性感染,但是在小于两周龄的幼雏,有引起高致死率和全身系统性感染的暴发的可能。世界范围内,由肠炎沙门菌污染的禽肉蛋制品引起人类的沙门菌感染占很大比例。人类通常是由于摄入被污染的蛋类或未完全煮熟的禽肉而感染沙门菌。除了污染禽肉制品,导致水平感染外,肠炎沙门菌也可以经粪便污染蛋壳,或污染卵巢[2-4],导致垂直传播。肠炎沙门菌这种特殊的传播方式使得该菌难以控制。在美国,2010年8月以后,至少上千人感染沙门氏菌致病,调查显示,多数病人都是食用了被沙门氏菌污染的“毒鸡蛋”。美国卫生单位回收大量鸡蛋,数量达到3.8亿枚,导致严重的经济损失。
因此,控制肠炎沙门菌经禽类食品水平传播给人类,需要从养禽业源头做起。使用减毒活疫苗被普遍认为是较为理想的预防措施。在我国,尽管养禽业规模很大,对疫苗的需求很大,但对肠炎沙门菌减毒活疫苗研制仍在进行中。
本文用等位基因同源重组技术,敲除crp和spiC基因,构建肠炎沙门菌C50041ΔspiCΔcrp双基因缺失突变株,为研制肠炎沙门菌减毒活疫苗奠定基础。
1 材料与方法
1.1 菌株与质粒 试验中用到的菌株及质粒见表1。
1.2 引物设计与合成 根据GenBank中沙门菌基因组序列,软件Primer5.0设计用于spiC和crp基因敲除特异性引物,如表2所示。引物由南京金思瑞生物有限公司合成。
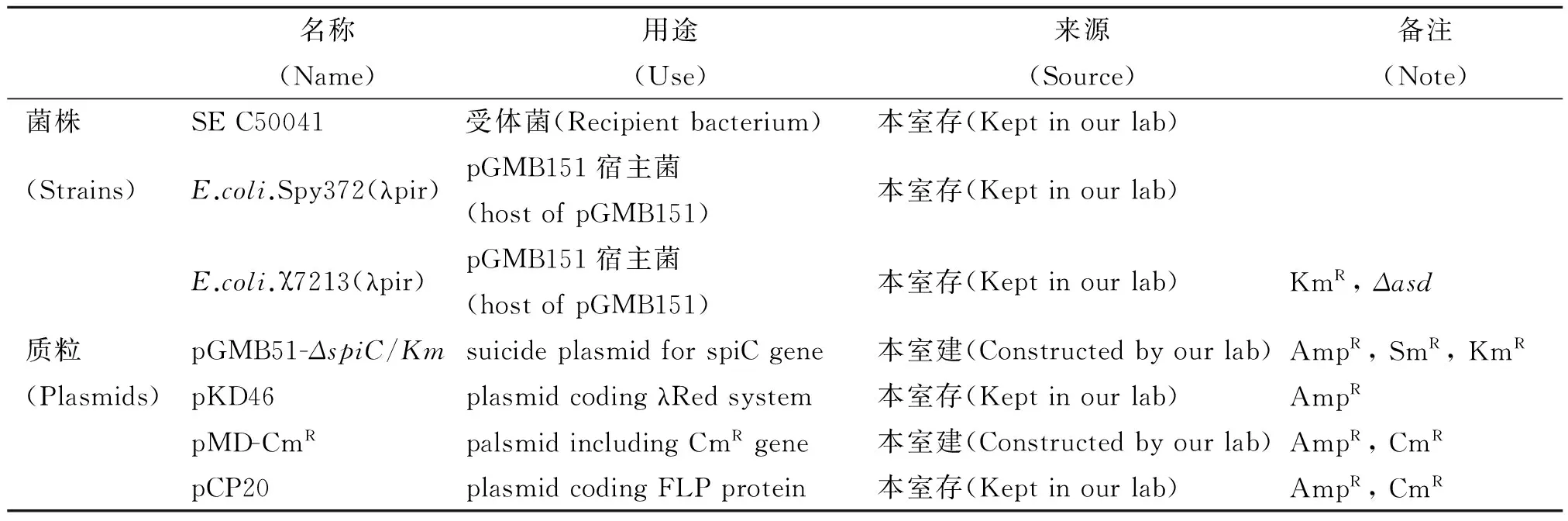
表1 试验用细菌和质粒

表2 引物序列
1.3 肠炎沙门菌C50041基因组的提取 取实验室冻存的肠炎沙门菌C50041,在DHL固体平板三区划线,37 ℃培养24 h后,挑取单菌落,接种于LB液体培养基,200 r/min,37 ℃培养过夜,试剂盒提取肠炎沙门菌C50041基因组。
1.4spiC基因的敲除 参照文献[5-6],构建肠炎沙门菌C50041ΔspiC基因缺失株,运用本实验室已经构建好的自杀质粒pGMB51-ΔspiC/Km进行基因敲除,筛选卡那霉素抗性的重组菌,并命名为肠炎沙门菌C50041ΔspiC/Km。该菌并在温度敏感性质粒pCP20的帮助下,去除卡那霉素抗性基因KmR,并命名为肠炎沙门菌C50041ΔspiC。
1.5crp基因的敲除
1.5.1crp等位基因的构建 参照文献[5-6],以肠炎沙门菌C50041基因组DNA为模板,PCR方法扩增crp基因上下游crp-U、crp-D片段作为等位基因。克隆到pMD-20T载体后,分别命名为pMD-crp-U和pMD-crp-D。将pMD-crp-D的520 bp crp-D片段亚克隆到pMD-crp-U质粒的限制性内切酶XhoI和Hind III位点之间。重组单菌落进行PCR和酶切鉴定,正确的重组质粒命名为pMD-Δcrp。再将pMD-CmR质粒中1.1 kb 氯霉素抗性基因CmR片段亚克隆到重组质粒pMD-Δcrp限制性内切酶XhoI位点间,重组单菌落在含氯霉素(50 μg/mL)的固体LB平板上培养筛选,PCR和酶切鉴定后,正确的重组质粒命名为pMD-Δcrp/Cm。
1.5.2 C50041ΔspiCΔcrp/Cm突变株的筛选与鉴定
1.5.2.1 等位基因DNA片段的准备 以pMD-Δcrp/Cm为模板,用crp-YZ引物PCR扩增,回收纯化1.7 kb的DNA片段,作为等位基因重组DNA片段。
1.5.2.2 制备诱导表达Red重组酶的感受态细菌 参照文献[7],将编码Red重组酶系统的质粒pKD46电转化导入肠炎沙门菌C50041ΔspiC中,L-阿拉伯糖(30 mmol/L)诱导表达λRed重组蛋白Exo、Bet和Gam后,制备感受态细菌。
1.5.2.3 C50041ΔspiCΔcrp/Cm的筛选与鉴定 将100 ng的等位基因重组DNA片段电转化入100 μL感受态细菌中,涂布于含有氯霉素的 LB 平板上 37 ℃过夜培养,筛选氯霉素抗性重组菌,用crp-U、crp-D和crp-YZ引物PCR验证,正确的菌落命名为C50041ΔspiCΔcrp/Cm。
1.6 肠炎沙门菌突变株的生物学特性鉴定
1.6.1 生化特性鉴定 将肠炎沙门菌突变株C50041ΔspiC、C50041ΔspiCΔcrp/Cm及野生株肠炎沙门菌C50041分别划线接种DHL固体平板,然后挑取单菌落转接葡萄糖、鼠李糖、木糖、麦芽糖、棉籽糖、甘露醇、山梨醇、乳糖、蔗糖、赖氨酸、苯丙氨酸、氰化钾、尿素、硫化氢、蛋白胨水、侧金花醇等生化鉴定管,37 ℃培养过夜,进行生化鉴定。
1.6.2 生长特性鉴定 将肠炎沙门菌突变株C50041ΔspiC、C50041ΔspiCΔcrp/Cm及野生株C50041分别接种LB液体培养基中,37 ℃,200 r/min振摇培养过夜,次日调整各菌株培养液浓度一致,转接到LB液体培养基中,调整细菌的起始浓度为1×106CFU/mL,37 ℃,静置培养,每隔2 h取样,连续10倍稀释,选取3个合适的稀释度,每个稀释度取100 μL涂布LB固体平板,各做3个重复,37 ℃培养过夜,平板计数,根据所获得的细菌数计算比较细菌间的生长速度。
1.6.3 LD50测定 将肠炎沙门菌C50041ΔspiC、C50041ΔspiCΔcrp/Cm突变株及野生株C50041在液体LB培养基中,37 ℃,200 r/min培养16 h,无菌PBS洗涤细菌并悬浮,调整细菌浓度,分别以不同的剂量肌注3日龄海兰白蛋鸡,100 μL/只,每组10只,统计2周内鸡的死亡数,比较突变菌株与野生菌C50041毒力的变化。
2 结 果
2.1 C50041ΔspiCΔcrp基因缺失株的PCR鉴定 运用自杀质粒pGMB51-ΔspiC/Km及卡那霉素筛选法构建肠炎沙门菌spiC基因缺失株,PCR及抗生素验证结果表明C50041ΔspiC/km构建成功。在pCP20质粒表达的重组酶FLP作用下去除卡那霉素抗性基因后,继续运用λRed 重组酶系统,在重组蛋白Exo、Bet和Gam的作用及氯霉素筛选作用下,只有基因缺失菌株C50041ΔspiCΔcrp/Cm才能生长。用验证引物crp-YZ-F/R PCR扩增鉴定,以C50041ΔspiCΔcrp/Cm为模板,PCR扩增出约1.7 kb的产物,而野生菌C50041则扩增出去1.2 kb的产物(图1),与预期结果一致。
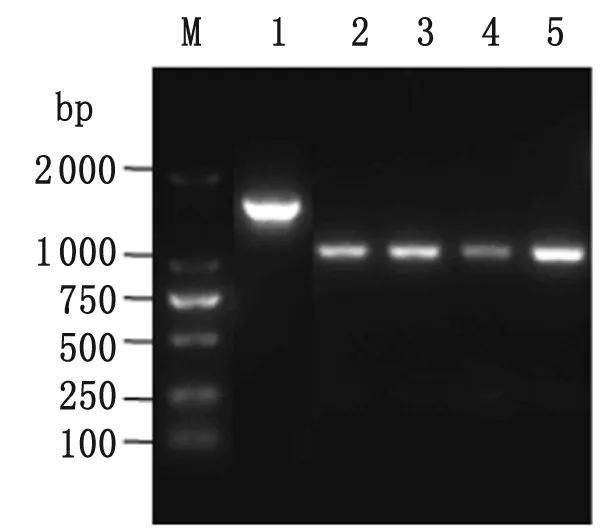
Lane M: DL2000 DNA marker;Lane 1: C50041ΔspiCΔcrp/Cm;Lane 2-5: C50041.
图1 C50041ΔspiCΔcrp/Cm的PCR鉴定
Fig.1 Identification of C50041ΔspiCΔcrp/Cm by PCR
2.2 C50041ΔspiCΔcrp基因缺失株的基本生物学特性鉴定
2.2.1 生化特性鉴定 细菌转接葡萄糖、鼠李糖、木糖、麦芽糖、甘露醇、卫矛醇、山梨醇、乳糖、蔗糖、赖氨酸脱氢酶、氰化钾、尿素、乙酰胺、七叶苷、硫化氢、蛋白胨水、侧金花醇等生化鉴定管,37 ℃过夜,生化鉴定结果(表3)显示ΔspiC突变株与野生株细菌生化特性是一致的。而ΔcrpΔspiC则在硫化氢、山梨醇、麦芽糖、木糖、鼠李糖、甘露糖特性方面发生改变。
2.2.2 生长特性比较 调整C50041ΔspiC、C50041ΔspiCΔcrp/Cm及野生株C50041细菌的起始浓度为1×106CFU/mL,37 ℃培养,每隔2 h取样,涂板计数,绘制生长曲线,比较菌株之间的生长速度。如图2,C50041ΔspiC的生长速度与野生株肠炎沙门菌C50041相比无统计学意义,C50041ΔspiCΔcrp/Cm与野生型肠炎沙门菌C50041相比,生长速度降低。
表3 2株肠炎沙门菌突变株及野生株C50041的生化特性比较
Tab.3 Comparison of the biochemical properties among 2 mutants and wildtype C50041

生化特性Biochemicalcharacteristics菌株(S.enterditisstrains)WildtypeΔspiCΔcrpΔspiC硫化氢(H2S)++-山梨醇(Sorbitol)++-麦芽糖(Maltose)++-木糖(Xylose)++-鼠李糖(Rhamnose)++-甘露糖(Mannose)++-葡萄糖(Glucose)+++赖氨酸脱羧酶(Lysinedecarboxylase)+++鸟氨酸脱羧酶(ornithinedecarboxylase)+++乳糖(Lactose)---蔗糖(Sucrose)---氰化钾(KCN)---尿素(Urea)---七叶苷(Esculin)---棉籽糖(raffinose)---苯丙氨酸(phenylalanine)---枸橼酸盐(citrate)---侧金花醇(Adonitol)---蛋白胨水(Peptonewater)---
注:“+”代表“阳性”,“-”表示“阴性”
Note: “+” means positive, “-” means negative.
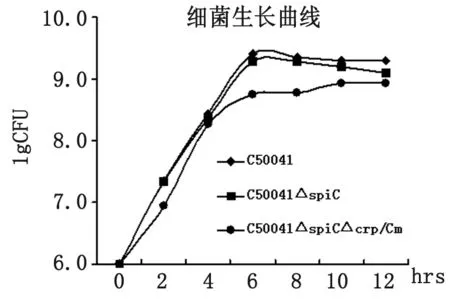
图2 突变菌株与C50041的生长曲线
2.2.3 LD50测定 将肠炎沙门菌C50041ΔspiC、C50041ΔspiCΔcrp/Cm突变株及野生株C50041分别以不同的浓度肌肉注1日龄海兰白雏鸡, 100 μL/只,每组10只,连续观察2周,记录死亡情况,比较突变菌株与野生菌株的毒力差异。结果如表4所示,C50041ΔspiC基因缺失株的LD50约为2.87×106CFU,C50041ΔspiCΔcrp/Cm双基因缺失株的LD50约为5.36×106CFU, 2基因缺失株LD50比C50041野生株LD50(约为3.11×103CFU)升高了约1 000倍,毒力显著降低。

表4 肠炎沙门菌LD50的测定
3 讨 论
利用基因工程构建减毒沙门菌作疫苗的研究备受关注,减毒菌株不仅遗传背景明确,而且不会返毒返祖,减毒活疫苗比灭活疫苗和亚单位疫苗在预防控制沙门菌病方面更有优势。沙门菌活疫苗可在免疫动物体内繁殖,持续刺激机体产生初次免疫应答和再次免疫应答[8],可以通过自然感染途径如口服或鼻内接种,刺激黏膜淋巴细胞分泌SlgA,形成一道保护屏障,有效地阻止沙门菌经黏膜感染,及其在黏膜表面的定居和对宿主细胞的侵袭[9]。
新型沙门菌的减毒活疫苗是通过基因重组工程方法将毒力相关基因敲除而获得的。这些与毒力相关的基因主要有:多效调节基因(crp,phoP),参与细菌结构成分生物合成的基因(如OMP)或参与必要的代谢产物(如:嘌呤类、嘧啶类、组氨酸、甲硫氨酸、cAMP及芳香族氨基酸等)合成的基因,及一些毒力基因(如:沙门菌毒力岛及III型分泌系统相关基因),特别是参与细菌抵抗宿主机制的毒力基因[10]。在本研究中,crp基因的缺失导致沙门菌硫化氢、山梨醇、麦芽糖、木糖、鼠李糖、甘露醇生化特性的转变,表明crp蛋白参与并影响了这些物质的合成。
本研究在沙门菌SPI-2 III型分泌系统的效应蛋白spiC编码基因的缺失的基础上,以多效调节基因crp为突变的目的基因,结合重组自杀质粒介导细菌的同源重组和λRed重组两种方法,制备了减毒肠炎沙门菌C50041ΔspiCΔcrp/Cm突变菌。本文在使用λRed重组系统敲除crp基因的过程中,将两端的同源序列加长到300-400 bp时,远高于该系统同源臂50 bp的要求,使筛选过程中假阳性率有效地降低,实际筛选过程中没有筛选到假阳性。
本研究利用同源重组技术成功构建了肠炎沙门菌C50041的2株突变菌株,spiC基因的缺失对C50041的生化特性与生长特性无显著影响,但crp基因缺失后C50041对多种糖类物质的代谢情况发生改变,而且生长速度显著下降。肌注接种1日龄海兰白雏鸡,spiC缺失株的LD50约为2.87×106CFU,C50041ΔspiCΔcrp/Cm双缺失株的LD50约为5.36×106CFU,二缺失株之间差别不明显,但与C50041野生株LD50(约为3.11×103CFU)相比,LD50升高了约1 000倍,毒力显著降低。沙门菌是胞内寄生菌,其侵入细胞和在胞内的存活是其致病的关键,crp基因和spiC基因的缺失分别影响到了其通过SPI-1介导的侵入细胞的能力,和通过SPI-2介导的在巨噬细胞内存活的能力,从而使其毒力有显著的降低,这为后期研究其作为减毒肠炎沙门菌活疫苗的可能性奠定了重要基础。
[1]Raphael S, Sharon MT, Wang JY, et al.Salmonellaentericaserovar Enteritidis core O polysaccharide conjugated to H:g,m flagellin as a candidate vaccine or protection against invasive infection withS. Enteritidis[J]. Infect Immun, 2011, 79(10): 4240-4249. DOI: 10.1128/IAI.05484-11
[2]Mickael CS, Lam PKS, Berberov EM, et al.Salmonellaentericaserovar EnteritidistatBandtatCmutants are impaired in Caco-2 Cell invasioninvitroand show reduced systemic spread in chickens[J]. Infect Immun, 2010, 78(8): 3493-3505. DOI: 10.1128/IAI.00090-10
[3]Keller LH, Benson CE, Krotec K, et al.SalmonellaEnteritidis colonization of the reproductive tract and forming and freshly laid eggs of chickens[J]. Infect Immun, 1995, 63(7): 2443-2449.
[4]Mead G, Lammerding AM, Cox N, et al. Scientific and technical factors affecting the setting ofSalmonellacriteria for raw poultry: a global perspective[J]. J Food Prot, 2010, 73(8): 1566-1590.
[5]Geng SZ, Liu NN, Jiao XA, et al. Development and identification of S06004ΔspiCmutant ofSalmonellaPullorum[J]. Chin Vet Sci, 2014, 44(4): 379-386. (in Chinese) 耿士忠, 刘男男, 焦新安,等. 鸡白痢沙门菌S06004ΔspiC突变株的构建与鉴定[J]. 中国兽医科学, 2014, 44(04): 379-386.
[6]Geng SZ, Jiao XA, Pan ZM, et al.An improved method to knock out theasdgene ofSalmonellaentericaserovar Pullorum[J]. J Biomed Biotechnol, 2009, 2009: 646380. DOI: 10.1155/2009/646380
[7]Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes inEscherichiacoliK-12 using PCR products[J]. Proc Natl Acad Sci U S A, 2000, 97(12): 6640-6645.
[8]Trach DD, Cam PD, Ke NT, et al. Investigations into the safety and immunogenicity of a killed oral cholera vaccine developed in Vietnam[J]. World Health Orgam, 2002, 80: 2-8.
[9]Gunn BM, Wanda SY, Burshell D, et al. Construction of recombinant attenuatedSalmonellaentericaserovar Typhimurium vaccine vector strains for safety in newborn and infant mice[J]. Clin Vaccine Immunol, 2010, 17(3): 354-362. DOI: 10.1128/CVI.00412-09
[10]Fields PI, Swanson RV, Haidaris CG, et al. Mutants ofSalmonellatyphimuriumthat cannot survive within the macrophage are avirulent[J]. Proc Natl Acad Sci U S A, 1986, 83: 5189-5193.
Construction of genetically engineered attenuated vaccinesSalmonellaenteritidisC50041ΔspiCΔcrp
ZENG Ling,LI Bao-li,YAN Su-hui,PAN Zhi-ming,GENG Shi-zhong,JIAO Xin-an
(KeyLaboratoryofZoonosesofJiangsuProvince,Co-InnovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,YangzhouUniversity,Yangzhou225009,China)
Salmonellaenteritidisis one of the zoonotic foodborne pathogens and could infect humans mainly through contaminated poultry and egg products. To explore the possibility as new genetically engineered vaccines, the double gene-deletion strain ofSalmonellaenteritidisC50041ΔspiCΔcrpwas constructed in this study. Thecrpgene was deleted again by λ Red system on the base ofSalmonellaenteritidisΔspiCto constructSalmonellaenteritidisΔspiCΔcrp. PCR and antibiotic resistance showedSalmonellaenteritidisΔspiCΔcrphad been successfully constructed, and biological identification clarified that its growth and the biochemical properties had changed; LD50was high about 1 000 folds and virulence was significantly attenuated, comparing with wild type strain C50041. It laid an important foundation for further study ofSalmonellaenteritidisas a live attenuated vaccine.
Salmonellaenteritidis;crp;spiC; genetically engineered vaccines
Geng Shi-zhong, Email; gszhong@yzu.edu.cn
耿士忠,Email:gszhong@yzu.edu.cn
扬州大学,江苏省人兽共患病学重点实验室,江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009
10.3969/cjz.j.issn.1002-2694.2015.02.001
R378
A
1002-2694(2015)02-0097-05
2014-04-15;
2014-09-13
863项目(No.2011AA10A212),江苏省博士后基金(No.1302067C),中国博士后基金(No.2014M551670),江苏省高等学校大学生创新创业训练计划项目(201411117058Y)联合资助

Supported by grants from the "863" program (No. 2011AA10A212), the Jiangsu Province Postdoctoral Fund (No. 1302067C), the China Postdoctoral Fund (No. 2014M551670), and the College Students’ Innovation and Entrepreneurship Training Program of Jiangsu Province (No. 201411117058Y)
