一种检测胆螺杆菌套式PCR方法的建立
2015-03-17秦和平叶安丽潘信义
秦和平,孙 勇,叶安丽,潘信义
一种检测胆螺杆菌套式PCR方法的建立
秦和平1,孙 勇2,叶安丽1,潘信义1
目的 建立一种敏感性高、特异性强的检测胆螺杆菌的套式PCR方法。方法 基于17种胆螺杆菌亚种的16S rRNA 基因设计筛选出1套套式引物(2条内引物、2条外引物),优化反应条件后,通过模拟粪便标本、动物模型标本和临床标本的检测对方法的敏感性和特异性进行评估。结果 模拟粪便标本中,该方法检测胆螺杆菌的敏感性达到10 CFU/100 μL。3例感染胆螺杆菌的SPF级BALB/c小鼠模型中,3例小鼠粪便和盲肠中均可检测到胆螺杆菌,1例肝脏标本中检测到了胆螺杆菌。10例胆石病患者中,有2例患者的胆汁、胆囊粘膜和粪便标本中检测到了胆螺杆菌。结论 本研究建立的套式PCR方法,敏感性高、特异性强,可用于检测胆螺杆菌的感染。
胆螺杆菌; 套式PCR; 16S rRNA
1995年Fox等从自交系小鼠的胆汁、肝脏及肠道中分离出一种新的肠肝螺杆菌-胆螺杆菌(helicobacterbilis,H.bilis)[1]。它的感染会影响动物实验的结果。1998年,Fox等在智利的研究发现,慢性胆囊炎患者的胆汁及胆囊粘膜中有H.bilis的DNA存在[2]。另外,一些研究则报道H.bilis的感染可能引起人肠炎[3-4]。因此,检测H.bilis对动物实验的质量控制和人类消化系统疾病的研究意义重大。另外,随着H.bilis亚种的不断增多,有必要根据更新的数据库重新设计引物。目前,核糖体数据库RDP(http://rdp.cme.msu.edu/)提供了17种H.bilis亚种的16S rRNA。本研究基于此建立一种检测H.bilis高敏感性和特异性的套式PCR方法。
1 材料与方法
1.1 材料
1.1.1H.bilis(ATCC43879)来自南方医院消化科。
1.1.2 选取3只SPF级的BLAB/c 小鼠经胃灌入200 μL含有H.bilis的PBS液 (107-9CFU/只),建立感染H.bilis的动物模型后处死(1~6 周),取其肝脏、盲肠及粪便标本。造模前,我们提前收集BLAB/c小鼠粪便标本,用我们的检测方法和文献中的检测方法(C97-C05、C97-C98)明确没有H.bilis的感染[2,5]。整个过程经过了南方医科大学动物管理及使用委员会的同意。
1.1.3 -80 ℃保存1位健康人粪便标本用于模拟粪便标本。健康人指无胆石病、胆囊炎、胆囊癌、肝炎及肝癌,用我们的方法和文献中的方法(C97-C05、C97-C98)检测粪便标本H.bilis阴性。
1.1.4 本研究纳入10位因胆石症拟行胆囊切除术的患者,患者近4周未服用以下药物:H2组胺受体阻断剂、抗生素、质子泵抑制剂、铋剂。术前留取粪便标本,术后留取胆汁、胆囊粘膜标本,均保存于-80 ℃冰箱内。
1.2 方法 用DNAMAN8.0(序列分析比对软件包)分析比对17种H.bilis亚种的16S rRNA,确定保守区和可变区。Primer Primier6.0(引物设计软件)设计引物,OLIGOU7.0(引物设计评估软件)分析、评估,选取最优引物。
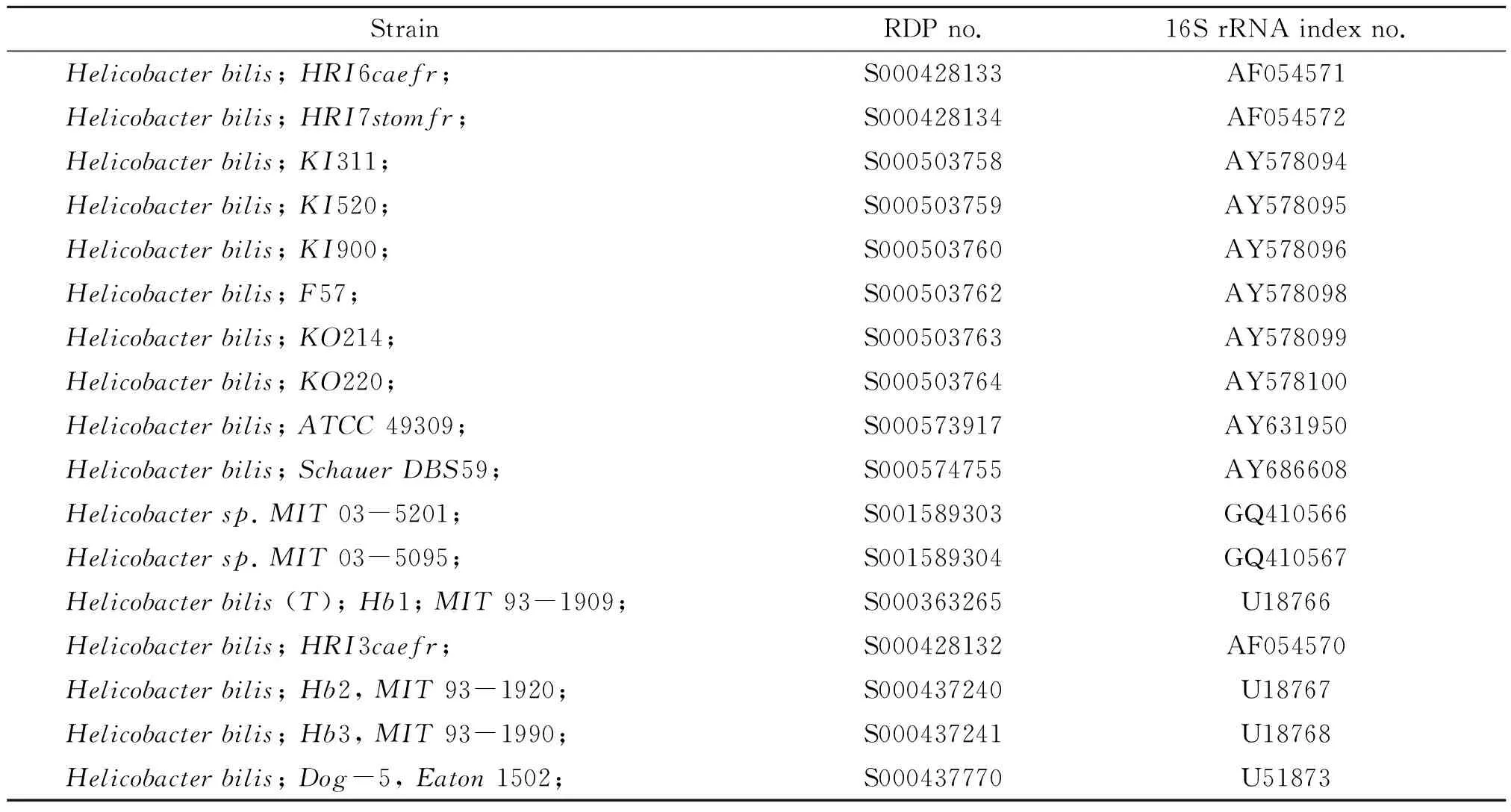
表1 17种胆型螺旋杆菌亚种的16S rRNA
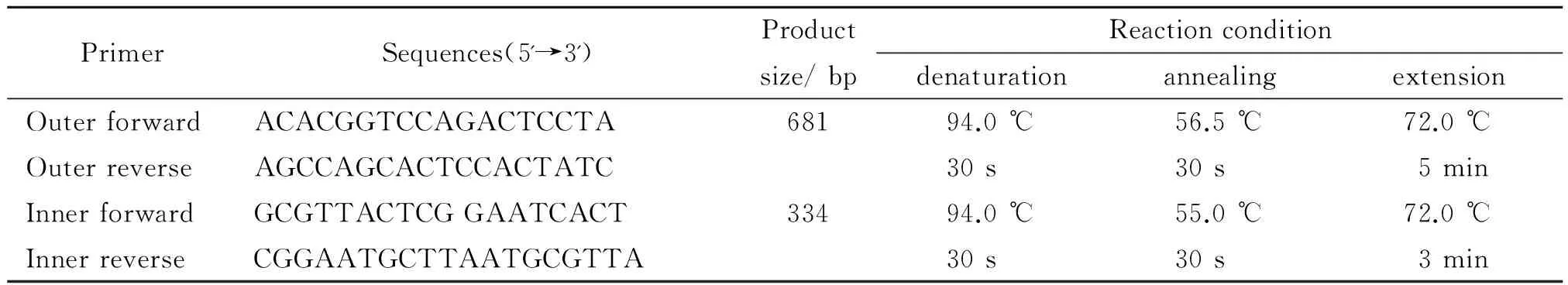
表2 本研究设计的套式引物序列及反应条件
1.2.2H.bilis菌株密集划线接种在空肠弯曲菌选择性琼脂培养基,添加5%~10%冻融脱纤维羊血,微需氧条件下(5% O2,85% N2和10% CO2) 37 ℃培养3~7 d。
1.2.3 细菌基因组DNA的提取使用Qiagen RNA/DNA Mini Kit (Qiagen Inc.德国),粪便、胆汁及组织DNA的提取使用QIAamp DNA Stool Mini Kit (Qiagen Inc.德国)。
1.2.4 PCR扩增体引物(如表2 所示)由华大基因公司合成。两轮反应的预变性条件均为94 ℃ 3 min,终止反应条件均为72 ℃7 min。第一轮反应:PCR 反应体系为50 μL,2×Premix Taq 25 μL,上、下游引物各1 μL (0.2 mmol/L),模板5 μL,无菌去离子水补足至50 μL,30个循环;第二轮反应:PCR 反应体系为50 μL,2×Premix Taq 25 μL,上、下游引物各1 μL (0.2 mmol/L),第一步PCR产物稀释100倍后取1 μL作为模板,无菌去离子水补足至50 μL,30个循环,最后PCR产物琼脂糖凝胶电泳。PCR产物测序由华大基因公司负责(美国ABI公司的3730XL测序分析仪,Bigdye V3.1 Mix kit, POP7测序胶,PCR产物原液经柱纯化后单向测序)。为避免假阳性和假阴性条带,我们从提取DNA到PCR扩增设置阳性对照(H.bilis)和阴性对照(双蒸水)。
1.2.5 模拟粪便标本的敏感性检测使用比浊仪调整菌液至0.5麦氏单位, 约相当于1.5×107CFU/100 μL,用无菌磷酸盐缓冲液(PBS)进行稀释,称取健康人粪便0.2 g/管,加入0.7 mL PBS,加入各稀释度的菌液0.1 mL混匀,制备成一定的菌悬液模拟标本,最终菌液浓度分别为106、105、104、103、102、10、1 CFU/100 μL, 阴性对照加入0.8 mL 的PBS,上述的各稀释度与粪便标本混匀,1 000 r/min 离心10 min,把上清转入另一个离心管中,12 000 r/min离心10 min,离心后弃上清,用试剂盒提取DNA,用建立好的PCR方法检测各稀释度的标本。
2 结 果
我们设计的套式PCR法检测模拟粪便标本的最低浓度达到了10 CFU/100μL。它不仅能检测出小鼠粪便标本、肝脏和盲肠标本的H.bilis,而且在2例胆石病患者的胆囊胆汁、胆囊粘膜及粪便标本中也检测出了H.bilis。这种对H.bilis特异的套式PCR法于动物实验的质量控制和人感染H.bilis的研究意义重大。
2.1 模拟粪便标本的敏感性检测 以10倍梯度稀释制备的粪便模拟标本,提取DNA后进行PCR扩增, 可以检测的最低菌液浓度为10CFU/100 μL(图1)。
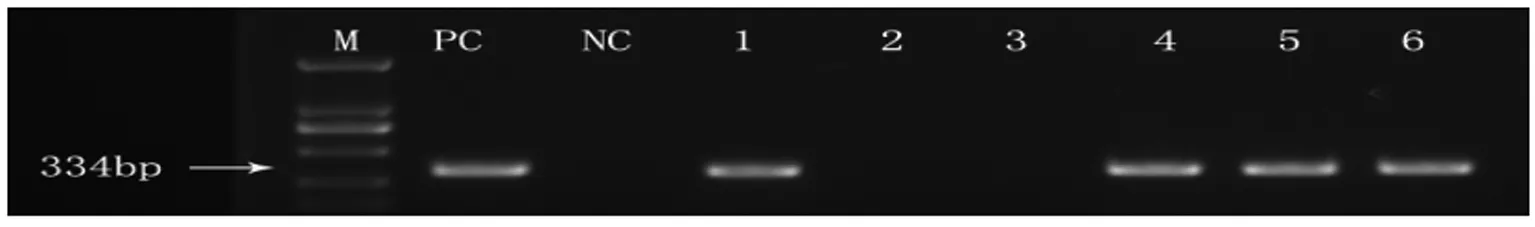
2.2 3只SPF级BALB/c小鼠造模前后粪便标本的检测。造模后3例粪便标本中检测到了334 bp的特异条带,测序后比对为H.bilis的16S rDNA部分片段(图2)。
2.3 3只SPF级BALB/c小鼠造模后,1例肝脏标本和3例盲肠标本均检测到了334 bp的特异条带,测序后比对为H.bilis的16S rDNA部分片段(图3)。
2.4 10例胆石病患者中,2例患者的胆汁(图4-A)、胆囊粘膜(图4-B)及粪便(图4-C)标本中均检测到了334 bp的特异条带,测序后比对为H.bilis的16S rDNA部分片段。
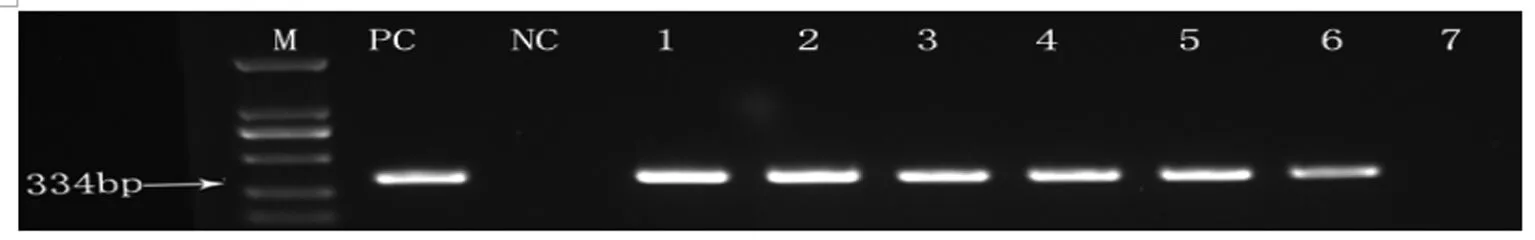
Tenfold dilutions of pure bacterial culture were spiked into healthy human stool, and nested PCR was performed by using the extracted DNA from contaminate stool.
M:markers (Omega Marker DL-2000); PC:positive control; NC:negative control; 1:106CFU/100 μL; Lane 2:105CFU/100 μL; 3:104CFU/100 μL; 4:103CFU/100 μL; 5:102CFU/100 μL; 6:10CFU/100 μL; 7:1 CFU/100 μL.
图1 基于H.bilis16s rDNA的特异性套式PCR法敏感性检测
Fig.1 Sensitivity of detection ofH.bilis-specific 16s rDNA gene by the nested PCR

M:markers (Omega Marker DL-2000); PC:positive control; NC:negative control; 1 to 3:mice uninfected withH.bilis; 4 to 6:mice infected withH.bilis.
图2 套式PCR法检测造模前后小鼠的粪便标本
Fig.2 Nested PCR amplification of DNA extracted from feces samples from uninfected control and infected mice
3 讨 论
H.bilis是一种重要的肠肝螺杆菌,小鼠是其自然宿主。它主要定植于小鼠的肝胆系统,也可下行至小鼠的结肠,可导致小鼠慢性肝炎、胆囊炎及慢性肠炎,影响动物实验的结果[1]。Maurer等的研究发现H.bilis感染与小鼠胆石症的发生相关[6],为我们研究人类胆石病提供了一种很好的模型。两份来自亚洲的研究发现,亚洲人群中胆管癌和胆囊癌的粘膜标本中H.bilis的阳性率非常高[7-8]。Okoli等的研究也提示人类原发性肝癌的发生中H.bilis和HCV病毒有协同作用[9]。因此,研究H.bilis的意义重大。
M:markers (Omega Marker DL-2000); PC:positive control; NC:negative control; 1 to 3:liver samples; 4 to 6:ceacum samples.
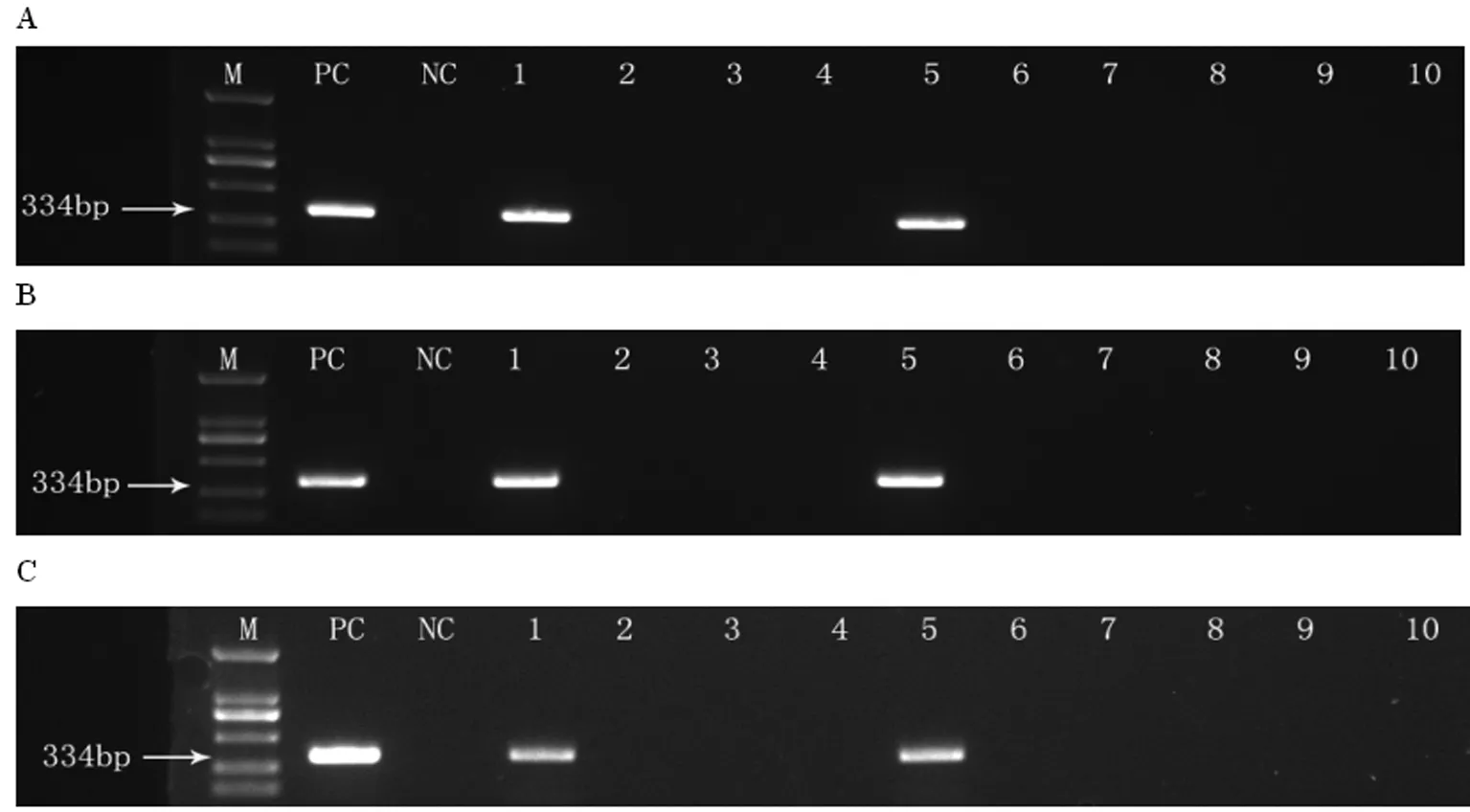
M:markers (Omega Marker DL-2000); PC:positive control; NC:negative control; 1 to 10:ten patients with cholelithiasis.
Fig.4 Nested PCR amplification of DNA extracted from biles (A), cholecyst mucous membranes (B) and feces (C) samples from patients with cholelithiasis
但H.bilis是苛养菌,培养条件和设备要求高,培养法敏感性差。血清学检查要在培养法基础上取得抗原,而且多是基于多克隆抗体,假阳性率高。因此,PCR及测序是检测H.bilis的金标准[1]。16S rDNA 因其序列高度保守,长度适宜,被大多数研究人员作为首选靶序列。但临床标本PCR检测的敏感性和特异性受到体内细菌的和人体组织DNA的影响,容易出现错配,常出现假阴性的结果[10]。套式PCR有内外两对引物,通过2轮特异性扩增,可以很大程度上减少错配的出现,提高检测H.bilis的敏感性和特异性。
本研究根据最新的RDP数据库,设计并建立了一种套式PCR方法。模拟粪便标本的环境富含肠道细菌和少量人体的DNA。这种环境下,该检测方法的敏感性可达到10 CFU/100 μL。感染H.bilis的3只BALB/c小鼠模型中,虽然只有1例小鼠肝脏标本中检测到了H.bilis,但3例小鼠的盲肠及粪便标本中都检测到了H.bilis,原因可能是H.bilis逆行感染肝胆需要的时间更长。另外,我们还用这种方法检测了10例胆石病患者的胆汁、胆囊粘膜及粪便标标本。术前提前冻存的粪便标本有2例检测到了H.bilis;术后也是这2例患者的胆汁和胆囊粘膜标本中检测到H.bilis。综上所述,该方法检测H.bilis敏感性高,特异性强,对动物实验的质量控制和研究H.bilis感染对人疾病的影响意义重大。
[1]Fox JG, Yan LL, Dewhirst FE, et al.Helicobacterbilissp. nov., a novel Helicobacter species isolated from bile, livers, and intestines of aged, inbred mice[J]. J Clin Microbiol, 1995, 33(2):445-454.
[2]Fox JG, Dewhirst FE, Shen Z, et al. HepaticHelicobacterspecies identified in bile and gallbladder tissue from Chileans with chronic cholecystitis[J]. Gastroenterology, 1998, 114(4):755-763.
[3]Javed S, Mejias-Luque R, Kalali B, et al.Helicobacterbilisgamma-glutamyltranspeptidase enhances inflammatory stress response via oxidative stress in colon epithelial cells[J]. PLoS One, 2013, 8(8):e73160. DOI:10.1371/journal.pone.0073160
[4]Liu Z, Ramer-Tait AE, Henderson AL, et al.Helicobacterbiliscolonization enhances susceptibility to Typhlocolitis following an inflammatory trigger[J]. Dig Dis Sci, 2011, 56(10):2838-2848. DOI:10.1007/s10620-011-1701-3
[5]Rocha M, Avenaud P, Menard A, et al. Association ofHelicobacterspecieswith hepatitis C cirrhosis with or without hepatocellular carcinoma[J]. Gut, 2005, 54(3):396-401. DOI:10.1136/gut.2004.042168
[6]Maurer KJ, Ihrig MM, Rogers AB, et al. Identification of cholelithogenic enterohepatic helicobacter species and their role in murine cholesterol gallstone formation[J].Gastroenterology, 2005, 128(4):1023-1033.
[7]Murata H, Tsuji S, Tsujii M, et al.Helicobacterbilisinfection in biliary tract cancer[J]. Aliment Pharmacol Ther, 2004, 20(Suppl 1):90-94. DOI:10.1111/j.1365-2036.2004.01972.x
[8]Matsukura N, Yokomuro S, Yamada S, et al. Association betweenHelicobacterbilisin bile and biliary tract malignancies:H. bilis in bile from Japanese and Thai patients with benign and malignant diseases in the biliary tract[J]. Jpn J Cancer Res, 2002, 93(7):842-847.
[9]Okoli AS, Raftery MJ, Mendz GL. Comparison ofHelicobacterbilis-associated protein expression in Huh7 cells harbouring HCV replicon and in replicon-cured cells[J]. Int J Hepatol, 2012, 2012:501671. DOI:10.1155/2012/501671
[10]Bohr UR, Primus A, Zagoura A, et al. A group-specific PCR assay for the detection ofHelicobacteraceaein human gut[J]. Helicobacter, 2002, 7(6):378-383.
Development of a nested PCR assay for detection ofHelicobacterbilis
QIN He-ping1,SUN Yong2,YE An-li1,PAN Xin-yi1
(1.LiuzhouPeople’sHospital,Liuzhou545006,China;2.NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
In this study, the objective is to establish a nested-PCR assay for the detection ofH.biliswith high sensitivity and specificity. The nested primers were designed based on sequences of 16S rRNA gene of seventeen subtypes ofH.bilis. After optimizing reaction condition, the sensitivity and specificity of the assay were examined via the detection of feces simulated samples, mice infection model samples and clinic patients’ samples. The detection sensitivity ofH.bilisstrain for feces simulated samples was 10 CFU/100 μL.H.biliswas successfully detected in the liver, caecum and feces of experimentally infected mice. Moreover,H.biliswas successfully detected in the bile, cholecyst mucous membrane and feces samples from two of ten patients with cholelithiasis. Due to the PCR assay’s high sensitivity and specificity, the method may be used to detect the infection ofH.bilis.
H.bilis; nested PCR assay; 16S rRNA
Pan Xin-yi, Email:panxinyilz@126.com
广西省卫生厅基金项目(No.Z2013651);柳州市人民医院“硕博医学基础研究启动基金”项目(No.lryjj201408)
潘信义,Email:panxinyilz@126.com
1.柳州市人民医院医疗保健部一病区,柳州 545006; 2.南方医院消化内科,广州 510515
10.3969/j.issn.1002-2694.2015.10.010
R378.99
A
1002-2694(2015)10-0943-04
2015-01-30;
2015-07-31

Funded by the Health Department Fund Project of Guangxi Province (No. Z2013651) and the Foundation Medicine Research Fund for Graduate in Liuzhou People’s Hosptial (No. lryjj201408)
