无偿献血者乙肝表面抗原弱阳性标本不同检测方法结果比较
2015-03-16田耘博重庆市血液中心检验科40005重庆市中山医院检验科40004
程 颖,李 维,田耘博,程 燃(.重庆市血液中心检验科 40005;2.重庆市中山医院 检验科 40004)
·临床探讨·
无偿献血者乙肝表面抗原弱阳性标本不同检测方法结果比较
程 颖1,李 维1,田耘博1,程 燃2△(1.重庆市血液中心检验科 400015;2.重庆市中山医院 检验科 400014)
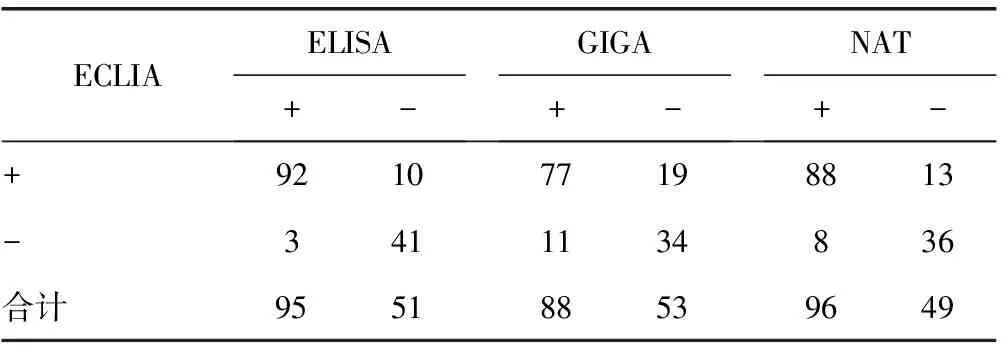
目的 比较酶联免疫吸附试验(ELISA)、胶体金免疫层析技术(GICA)、电化学发光免疫分析(ECLIA)、核酸检测(NAT)共4种方法检测乙肝表面抗原(HBsAg)弱阳性标本的结果符合率,分析探讨4种方法的特异性与灵敏度。方法 采用高灵敏度进口和国产ELISA试剂对重庆地区2013年1~12月无偿献血标本共116 351份进行HBsAg血液定性筛查,选取0.8≤S/CO 乙型肝炎病毒表面抗原; 酶联免疫吸附试验; 胶体金免疫层析技术; 电化学发光免疫分析; 核酸检测 流行病学调查显示,乙肝病毒感染广泛分布于世界各地。在某些成人感染者中,病毒具有自限性,但有5%~10%的感染者表现为慢性肝炎症状,导致肝脏严重损伤,最终导致肝纤维化、肝硬化甚至肝癌[1]。因此,准确判断是否感染乙型肝炎显得尤为重要。乙肝表面抗原(HBsAg)是各采供血机构筛检献血者的必检项目。我国现行的献血法明确规定:为保证医疗临床用血需要和安全,保障用血者身体健康,阳性标本必须报废,不得用于临床。目前检测HBsAg的主要方法酶联免疫吸附试验(ELISA)简便、快速、特异、成本低、且灵敏度较高,特别适用于大批量献血者筛查及健康体检[2]。由于人感染病毒后,在血液检测时存在检测的窗口期,使得病毒阳性的献血者存在一定的漏检概率,因此将试剂盒阳性判定值(cut off)下一段区域20%设定为弱阳性。“弱阳性”指在定性ELISA测定中处于cut off值附近临床意义可疑的一部分结果,对弱阳性标本进行初复检双孔重新测定,其初复检标本OD值仍为弱阳性的都视为阳性报废,这样也会造成很多“假阳性”的血液被报废,使本身就缺血的重庆地区血液供应更加紧张[3]。为了既保证不浪费紧张的血液资源,又最大限度保障用血安全,作者选择国内常用的4种检测方法对收集的HBsAg 弱阳性标本进行测定.并对结果进行分析比较,现将研究结果报道如下。 1.1 一般资料 选取重庆市血液中心2013年无偿献血标本116 351份中抽取出的弱阳性标本150份,每位献血者留取5 mL和8 mL乙二胺四乙酸二钾抗凝血各1管,无分离胶的用于ELISA检测,有分离胶的用于核酸检测(NAT),各样品管的离心和保存均按相应的检测试剂说明书要求进行操作。 1.2 仪器与试剂 1.2.1 仪器 深圳爱康Xantus全自动加样仪;瑞士FAME24/20和FAME24/30全自动酶免分析仪;PROCI EIX TIGRIS核酸检测系统(美国诺华);RT-2100C酶标仪及罗氏(Cobas)全自动电化学发光免疫分析仪;穿越信息管理系统软件。 1.2.2 试剂 酶联免疫试剂:ELISA试剂盒(生物梅里埃和北京万泰);胶体金试剂:胶体金免疫层析技术(GICA)试纸条(艾康生物);电化学发光定量检测试剂:电化学发光免疫分析(ECLIA)仪及其配套试剂(上海罗氏);核酸试剂:乙型肝炎病毒核酸检测(NAT)试剂盒(美国诺华)、HBsAg鉴别探针试剂。 1.3 检测方法 将所有保存的弱阳性标本复融后,分别以ELISA试剂盒、GICA试纸条、ECLIA、NAT平行检测HBsAg。 1.3.1 ELISA法 献血者标本分别采用两台深圳爱康Xantus全自动加样仪、两种试剂同时进行加样,采用瑞士FAME24/20和FAME24/30全自动酶免分析仪进行后处理检测;采用海参威实验室信息管理系统软件接受处理检测结果,本实验室将弱阳性下限值设置为S/CO值=0.8,其中0.8≤S/CO<1.0设置为弱阳性,任意一种试剂S/CO≥0.8,均须用该试剂作双孔复试,双试剂S/CO≥0.8或单试剂双孔复试至少一孔S/CO≥0.8即判为初筛呈反应性,该标本对应的血液报废。 1.3.2 GICA法 GICA在15 min和30 min各观测1次结果,以后者为报告结果,测定结果应在15 min内读取,30 min后判定无效。 1.3.3 ECLIA法 将待测标本与生物素标记的单克隆抗体、三氯联吡啶钌[Ru(bpy)3]标记单克隆抗体、链酶亲和素标记磁性微粒加入到反应杯中共同温育,形成磁性微珠包被抗体-抗原-发光剂标记抗体复合物。将上述复合物吸人流动室,同时用电子供体三丙胺(TPA)缓冲液冲洗。当磁性微粒流经电极表面时,被安装在电极下的磁铁吸引住,而游离的发光剂标记抗体被冲走。同时在电极加电压,启动电化学发光反应,使发光试剂标记物Ru(bpy)3和TPA在电极表面进行电子转移,产生电化学发光,光的强度与待测的乙肝表面抗原的浓度呈正比。 1.3.4 NAT法 NAT检测与结果判断采用转录介导扩增(TMA)检测技术进行NAT检测。标本于生物安全柜内开盖,置于样品架,按照全自动血液病毒核酸检测仪(Procleix UI TRIO Systern)的操作程序上样,进行单人份NAT检测。先用UI TRIO试剂在TIGRIS上做HIV RNA、HCV RNA、HBV DNA三联检测分析,对于UI TRIO有活性的标本,判为NAT联检阳性;再分别进行Procleix HIV、HCV 和HBV鉴别试验(dHIV-1、dHCV 和dHBV)。 2.1 4种方法测定血清HBsAg弱阳性标本的结果比较 见表1。 表1 4种方法测定血清HBsAg弱阳性标本的结果比较(n) 2.2 以ECLIA为标准3种方法测定血清HBsAg的各诊断指标比较 见表2。 表2 3种方法各诊断指标比较(%) HBsAg是一种22 nm的小球形颗粒,小球形颗粒是由100个HBsAg单体组成,乙肝患者血清中首先出现的病毒标志物就是表面抗原HBsAg,所以HBsAg对于乙型肝炎疾病的早期诊断和普查具有很高价值[4]。由于ELISA的影响因素较多,常规检测中存在着一些介于阴性和阳性之间的弱阳性结果,且弱阳性标本日益增多,但对其没有统一的判断标准,从而造成血液制品的浪费。HBsAg弱阳性出现的原因比较复杂,目前研究发现可能存在以下几个方面原因[5-8]:(1)HBVS基因的变异导致HBsAg结构及抗原性变异,使传统检测试剂灵敏度下降,出现假阴性或者弱阳性,而体内HBsAg实际上仍处于相当高的水平。(2)个体的免疫状况存在差异,部分人群对HBV耐受,免疫应答水平低,因此使得S基因表达较低,但是疾病的预后和转归却并不理想,甚至个别患者会出现持续性的肝损伤,更应引起临床的重视。(3)不同的检测方法、不同厂家的检测试剂及检测仪器和检测环境的差异,对实验结果产生严重的影响。所以,弱阳性标本检测的准确性,对于采供血部门的质量管理来说是一个非常重要的控制点。 GICA是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术,多用于无偿献血现场的首选筛查方法。目前,国产的乙肝表面抗原胶体金试纸条检测灵敏度已达到1 ng/mL,但是胶体金试纸条在前端采血中还是很多的缺点:(1)多数的快速诊断试剂是定性的,只能用于检测标本中是否含有超过检测浓度的特定生物成分存在,故它的灵敏度会受到一定限制和影响,在HBsAg检测标本浓度较低时易出现假阴性导致漏检。(2)由于检测结果是肉眼进行判读,较容易引起人为主观判断因素造成的差异。本实验结果表明,GICA的灵敏性较ECLIA、ELISA、NAT低,是4种方法中灵敏度最低的,GICA适用于献血前初筛检测使用[9]。 ELISA是在免疫酶技术的基础上发展起来的一种新型的免疫测定技术,是目前国内检测HBsAg的常规方法,其优点在于快速、操作简单、实验设备要求简单、应用范围广泛、敏感性高、特异性强、无放射性污染、能定性及半微量、微量、超微量定量分析等,是目前发展比较快的酶免疫学技术方法。但ELISA检测HBV血清标志物的影响因素也非常多,受加样、反应温度、反应时间、洗涤彻底性等诸多因素的影响[10]。国产试剂之间、国产试剂及进口试剂与进口试剂间在检测质量及结果判断标准上均存在一定的差异,这主要是抗原抗体反应难于溯源及普遍存在的基质效应所造成,而且操作步骤繁琐,整个实验过程至少需要2 h左右,因此不适用于急诊及无偿献血现场筛查。本研究结果显示,ELISA法的灵敏度和特异性分别为90.2%和93.2%,比ECLIA略低,证明其还是存在漏检风险。研究分析ELISA漏检的原因,主要集中在窗口期、灵敏度、罕见的亚型、变异及免疫静默感染几个方面,其中窗口期漏检是影响血液安全性的主要问题[11-13]。 免疫测定技术发展一日千里,化学发光技术、时间分辨荧光技术和电化学发光技术在体外诊断技术中逐渐占据主流地位。ECLIA应用较晚,但其发展却很快[14]。ECLIA检测HBsAg是目前世界上乙肝标志物检测方法的金标准,该方法兼具免疫学反应和电化学发光的高特异性、灵敏性、精密度和准确度等优点,其测定结果较其他方法更稳定,线性范围宽,抗干扰能力强,重复性好,并可单份检测,检测时间短,体现了ECLIA在方法学上的优势及在临床诊断上的重要价值[15]。本文的实验结果证实ECLIA法检测HBsAg弱阳性标本的灵敏性优于ELISA法、GICA法、NAT试验,是4种方法中灵敏性最高的。但因为仪器昂贵、试剂成本较高等因素,仅用于针对弱阳性标本的检测。 据资料文献显示,我国HBV感染者中,存在一部分血清HBsAg呈低水平状态的个体,NAT能够降低输血残余风险,保证输血安全[16]。国内也有不少血液中心开始使用NAT技术应用于献血者血液筛查。NAT包含多种直接检测病原体核酸的方法,其中我国各血液中心最常用血液筛查NAT方法是聚合酶链反应(PCR)和TMA[17-18]。NAT灵敏度与特异性高,在病毒感染数天后即能检出,可明显缩短病毒感染的“窗口期”,可有效弥补其他检测方法中存在的“窗口期”较长,病毒滴度、病毒变异、免疫沉默性感染和人为因素等原因而造成的漏检[19]。NAT检测与其他血清学方法相比较要求更严格:(1)试剂应具有较高的灵敏性、重复性、特异性;(2)实验室环境、设备要求更高。(3)标本留样和处理要求更高,因此NAT检测得成本也较高。初步研究表明,ELISA检测HBV“窗口期”约为45~55 d,采用混合标本NAT检测,“窗口期”将缩短9 d。采用单人份NAT检测,“窗口期”将缩短30 d[20]。NAT检测最大的优势在于可以缩减献血者“窗口期”,减少受血者通过输血途径感染病毒的风险,但也不可避免有漏检标本出现。NAT与ELISA所应用的检测原理和检测方法存在一定差异,NAT检测的对象是病毒核酸,而ELISA检测的对象是抗原或抗体,2种方法在检测血液标本过程中存在一定的互补性,ELISA由于试剂、环境、设备等因素存在假阳性的可能;当献血者血液中病毒载量低于NAT的检出水平或病毒处在静默期时,导致NAT出现假阴性。病毒由于长期存在于机体中,将会感染导致血液中抗体或抗原滴度相当高,虽然不会影响到ELISA的检测,但血液中存在的HBsAg是由病毒DNA整合到人染色体与宿主基因共同表达所致,因此无法检测到血清中病毒HBV DNA,造成NAT漏检。现阶段,国内大多数血站针对血液筛查呈阳性或弱阳性的标本,几乎都未开展确证试验,假阳性率过高不仅导致血液制品的浪费,同时也对献血者的心理造成一定压力,采供血机构在履行告知义务时感到十分尴尬,献血者对血站检测质量甚至对血站整体能力产生怀疑,给献血者招募带来负面影响,直接导致固定低危献血者的流失,给无偿献血事业的可持续发展带来严重影响。 综上所述,以上4种检测方法各有优缺点,又具有一定互补性。GICA初筛测定弱阳性的标本需用ELISA进行双孔复检,同时也可以用ECLIA复查;目前检测HBsAg应用最为广泛的方法是ELISA,因为其灵敏度、特异性较高且成本低廉,适合大批量标本检测,但ELISA得影响因素诸多,检测假阳性较高已无法适应现代医学高速发展的步伐。现阶段随着免疫学技术飞速发展,速度更快、成本更低的新一代检测方法不断推出,使HBsAg滴度表达很低的标本得以检出,最大限度地满足定量检测的要求。NAT与ELISA血液筛查检测互补作用主要体现在3个方面:(1)窗口期漏检是目前ELISA漏检的最大因素。(2)以抗原抗体免疫反应技术基础的ELISA方法对免疫静默感染、病毒变异、病毒亚型检测性能低。(3)ELISA检测“弱阳性”的设置在理论上可以改善试剂检测灵敏度低所造成的漏检现象,却依然无法改变因病毒变异、病毒亚型或“窗口期”而造成的漏检。因此,采供血机构应合理开展多种方法联合检测,建立更科学的血液病原学筛查模式,最大限度降低血液制品不合理淘汰和资源浪费,降低输血传播疾病的风险。 [1]Barazani Y,Hiatt JR,Tong MJ,et al.Chronic viral hepatitis and hepatocellular carcinoma[J].World J Surg,2007,31(6):1245-1250. [2]Dreier J,Kroger M,Diekmann J,et al.Low-level viraemia of hepatitis B virus in an antiHBc antiHBs positiveblood donor[J].Transfus Med,2004,14(2):97-103. [3]李金明.血液感染性疾病标志物筛检中应重视的若干问题[J].中华检验医学杂志,2005,28(6):569-571. [4]Hsu HY,Chang MH,Ni YH,et al.Survey of hepatitis B surface variant infection in children 15 years after a nationwide vaccination programme in Taiwan[J].GUT,2004,53(10):1499-1503. [5]王蕾,刘华,王雯静,等.低水平乙型肝炎表面抗原的检测及其临床价值评估[J].微生物与感染,2009,4(1):9-12. [6]Tong MJ,Blatt LM,Kao JH,et al.Basal core promoter T1762/A1764 and precore A1896 gene mutations in hepatitis B surface antigen-positive hepatocellular carcinoma:a comparison with chronic carriers[J].Liver Int,2007,27(10):1356-1363. [7]Worthley DL,Harvey NT,Hill NL,et al.Urinary transferrin and albumin concentrations in patients with type 1 diabetes and normal controls:the search for the first protein lost[J].Clin Bio chem,2001,34(1):83-85. [8]Comper WD,Jerums G,Osicka TM.Differences in urinary albumin detected by four immunoassays and high-performance liquid chromatography[J].Clin Biochem,2004,37(2):105-111. [9]周玲,吕定.金标法检测乙肝表面抗原漏检原因分析[J].检验医学与临床,2014,11(9):2402-2403. [10]Allain JP.Genomic screening for blood borne viruses intransfusion settings[J].Clin Lab Haematol,2008,22(1):1-10. [11]吴玉清,杨忠思,赵林,等.青岛地区无偿献血者血液病毒核酸检测的研究[J].中国输血杂志,2008,21(11):834-835. [12]Mendy ME,Fortuin M,Jack AD,et al.Hepatitis B virus DNA in relation to duration of hepatitis B surface antigen carriage[J].Br J Biomed Sci,1999,56(1):34. [13]Contois JH,Hartigan C,Rao LV,et al.Analytical validation of an HPLC assay for urinary albumin[J].Clin Chim Acta,2006,367(1/2):150-155. [14]Busch MP,Kleinman SH,Jackson B,et al.Nucleic acid ampliflcation testing of blood donors for transfusion transmitted infectious disesses[J].Transfusion,2000,40(2):143-159. [15]龙晖.电化学发光免疫在分析检测乙肝标志物的应用研究[J].中国伤残医学,2014,22(18):135-136. [16]段友红,程卫芳,孟海萍,等.合肥地区无偿献血者核酸检测的应用研究[J].国际检验医学杂志,2014,35(7):1742-1744. [17]任芙蓉.核酸检测技术在国内外血液筛检中的应用[J].北京医学,2008,30(8):561-564. [18]Busch MP.Should HBV DNA NAT replace HBsAg and/or antiHBc screening of blood donors[J].Transfus Clin Biol,2004,11(1):26-32. [19]Gallarda JI,Dragon E.Blood screening by nucleic acid amplification technology:current issues,future challenges[J].Mol Diag,2000,5(1):11-12. [20]Mccullough J,Bianco C,Bracey A,et al.Nucleic acid amplification testing of blood donors fortransfusion-transmitted infectious diseases[J].Transfusion,2000,40(2):143-159. 10.3969/j.issn.1672-9455.2015.16.060 A 1672-9455(2015)16-2444-03 2015-02-28 2015-04-10) △通讯作者,E-mail:31536985@qq.com。1 资料与方法
2 结 果

3 讨 论
