黄连解毒汤对APP/ PS1双转基因阿尔茨海默病模型小鼠脑内β-淀粉样前体蛋白基因表达影响研究
2015-03-16冯佩
冯 佩
(湖北省第三人民医院,湖北 武汉 430032)
黄连解毒汤对APP/ PS1双转基因阿尔茨海默病模型小鼠脑内β-淀粉样前体蛋白基因表达影响研究
目的:探讨黄连解毒汤对APP/PS1双转基因阿尔茨海黙病模型小鼠脑内β-淀粉样前体蛋白(β-APP)基因表达的影响。方法:选用3月龄APP/PS1双转基因阿尔茨海默病模型小鼠,随机分为空白对照组(CMC组)、西药安理申对照组(阳性对照组)、黄连解毒汤大剂量组(大HLJDT组)、黄连解毒汤中剂量组(中HLJDT组)、黄连解毒汤小剂量组(小HLJDT组),连续灌胃给药6个月后,通过反转录聚合酶链反应(RT-PCR)观察各组APP/PS1双转基因阿尔茨海默病模型小鼠脑内β-APP基因表达情况。结果:CMC组小鼠β-APPmRNA表达量较西药安理申组明显升高,差异具有统计学意义(P<0.05),黄连解毒汤各剂量组小鼠β-APPmRNA表达量较CMC组明显降低(P<0.05),其中中剂量组小鼠β-APPmRNA表达量与西药安理申组比较差异具有统计学意义(P<0.01)。结论:各剂量黄连解毒汤均能降低APP/PS1双转基因阿尔茨海默病模型小鼠脑内β-淀粉样前体蛋白(β-APP)基因表达,其中中剂量组降低效果明显优于西药安理申。
黄连解毒汤;APP/PS1双转基因阿尔茨海默病小鼠模型;β-淀粉样前体蛋白;基因表达
随着人类寿命的延长,阿尔茨海默病(Alzheimer's d isease,AD)的发病率急剧上升,已成为威胁人类健康和社会人口素质的重大疾病[1]。据2001年Delphi调查结果[2]显示,全球AD患者人数为2 430万人,并以每年460万人发病的速度递增(平均每7s新增1例患者),我国的AD发病率已经达到4.8%[3]。很多国内外学者都致力于AD发病机制及治疗方法的研究。现代研究发现,β-淀粉样前体蛋白(APP)与AD的发生有密切关系。APP是一种由定位于21号染色体长臂上基因编码的含有695~770个氨基酸残基的跨膜蛋白。人APP基因含有19个外显子(exons1-13,13a,14-18),AD患者脑内老年斑的主要成分为由APP基因的第16~17个外显子编码的APP水解片段Aβ肽[4]。因此,如果β-APP基因表达受到抑制,便能有效防止AD发生。本研究探讨黄连解毒汤对APP/PS1双转基因阿尔茨海默病模型小鼠脑内β-淀粉样前体蛋白(β-APP)基因表达的影响,现报道如下。
1 材料与动物
1.1 试验动物
3月龄SPF级APP/PS1双转基因AD小鼠50只[5],体重(30±5)g,由南京大学动物模式所提供(合格证号:2005674),饲养于SPF屏障实验饲养室。
1.2 药物
黄连解毒汤(HLJDT)由黄连、黄芩、黄柏和栀子组成,由湖北省第三人民医院中药房提供。盐酸多奈哌齐(商品名:安理申)由湖北省第三人民医院提供,卫材中国药业有限公司生产,5mg/片,批号:H20050978。HLJDT与安理申使用前均用0.5%羧甲基纤维素钠(CMC)混悬。
1.3 材料
灭菌枪头、匀浆器、EP管、去离子水、Trizol Reagent、三氯甲烷、异丙醇、无水乙醇、逆转录试剂盒(TOYOBO,日本)、Mr23i台式低温高速离心机(德国HERAUS)、Real-time PCR Detection System(SLAN,HONGSHI)。
2 方法
2.1 样品溶液制备
按处方配伍的生药粉碎后用水进行提取,过滤提取液,滤液静置,高速离心得到沉淀(Ⅰ);滤液上大孔吸附树脂,稀醇洗脱部分真空浓缩干燥,得到固体(Ⅱ)。将Ⅰ与Ⅱ均匀混合,得到有效部位,总得率为7.6%。所得有效部位化学成分主要为生物碱、黄酮、环稀醚萜。采用分光光度法分别测定生物碱类、黄酮类、环稀醚萜类成分含量,采用HPLC法测定指标性成分小檗碱、黄芩苷、栀子苷的含量。有效部位(群)总含量高于55%,指标性成分(群)总含量高于25%。
2.2 动物分组及给药方法
3月龄SPF级APP/PS1双转基因AD小鼠60只,体重(30±5)g,随机分为空白对照组(CMC组)、西药安理申对照组(阳性对照组)、黄连解毒汤大剂量组(大HLJDT组)、黄连解毒汤中剂量组(中HLJDT组)、黄连解毒汤小剂量组(小HLJDT组)5组,每组12只。具体处理如下:①CMC组:正常饲喂1周后,采用0.5%CMC灌胃;②安理申组:正常饲喂1周后,采用安理申混悬液灌胃(3mg/kg·d);③大HLJDT组:正常饲喂1周后,每只小鼠给予HLJDT 865mg/kg·d;④中HLJDT组:正常饲喂1周后,每只小鼠给予HLJDT 433mg/kg·d;⑤小HLJDT组:正常饲喂1周后,每只小鼠给予HLJDT 216mg/kg·d。每组小鼠均连续灌胃给药6个月。
2.3 AD小鼠脑组织RNA提取
末次灌胃1h后断颈处死小鼠,快速取出脑组织,约50mg,放入研磨器,参照Trizol试剂(货号:15596-026)说明书方法研磨20~30min,直至看不到大块组织。将液体倒入灭菌后的EP管内,加三氯甲烷250μL,充分混匀,静置5min,4℃,13 000×g离心10min;取上清液置于另一灭菌EP管内,加入等量异丙醇,混匀后放入4℃冰箱,15min后取出,4℃,13 000×g离心10min。倒出上层液体,留在管底的白色沉淀即为RNA。加入75%乙醇1mL,4℃,7 500×g离心5min,倒出上层液体,剩余白色沉淀,再瞬时离心,尽量吸干管内液体,晾干,再加入适量去离子水溶解即得。
2.4 引物
内标基因上游引物:M-actin-S5’-CCGTGAAAAGATGACCCAG-3’;下游引物:M-actin-A5’-TAGCCACGCTCGGTCAGG-3’;目的基因上游引物:M-App-S5’-TGGCGGTGAAGACAAAGTAGTAG-3’;下游引物:M-APP-A5’-CTCAGTGGTGGTTGTGGTGG-3’。
2.5 RT-PCR
采用SYBR Green mix(TOYOBO公司,日本)试剂盒。RNA经过提取、变性后,配制逆转录反应液:RNA 1μL,5×RT Buffer 4μL,dNTP 2μL,Oliga(dT)20 1μL,RNase free H2O 10μL,Rnase inhibitor 1μL,ReverTra Ace 1μL;42℃下反应20min,95℃下反应5min,4℃下反应5min。按照下列组成配制PCR反应液:SYBR Green mix 12.5μL,引物(5pmol/μL)2μL,ddH2O 8μL,cDNA(10倍稀释)2.5μL;按以下条件完成PCR反应,50℃、95℃下分别反应2min后,95℃下变性15s,退火15s,72℃延伸45s,完成40个循环后,72℃下放置10min。在循环过程中,通过Real-time PCR Detection System(SLAN,HONGSHI)分析同时进行荧光检测,以β-actin为内参照,按公式β-APP/β-actin计算β-APPmRNA水平。
2.6 统计学方法

3 结果
CMC组小鼠β-APPmRNA表达量较西药安理申组明显升高,差异具有统计学意义(P<0.05),黄连解毒汤各剂量组小鼠β-APPmRNA表达量较CMC对照组明显降低(P<0.05),其中中剂量组小鼠β-APPmRNA表达量与西药安理申组比较差异具有统计学意义(P<0.01)。见表1。
表1 黄连解毒汤对痴呆小鼠β-APP基因转录的影响

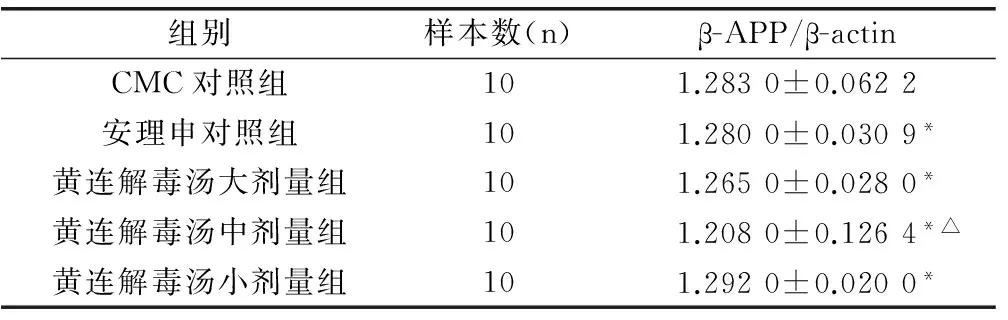
组别样本数(n)β-APP/β-actinCMC对照组101.2830±0.0622安理申对照组101.2800±0.0309*黄连解毒汤大剂量组101.2650±0.0280*黄连解毒汤中剂量组101.2080±0.1264*△黄连解毒汤小剂量组101.2920±0.0200*
注:与CMC对照组比较,*P<0.05,△P<0.01。
4 讨论
AD是一种起病隐袭、呈进行性发展的痴呆性疾病,是老年人最常见的神经退行性疾病,其脑部主要病理学特征为老年斑(senile plaque,SP)、神经纤维缠结(neurofibral,NFT)、神经元丢失等[6-7]。目前研究普遍认为β-淀粉样蛋白(Aβ)是SP的主要成分,其具有神经毒性作用,大量Aβ聚集或沉积可形成老年斑[8]。而β-淀粉样前体蛋白(β-APP)基因已被证实为AD的遗传易感基因[9]。将APP突变基因转移到动物体内,可使转基因动物大脑出现类似AD患者的病理学改变,但目前国内APP突变转基因模型产生老年斑的时间较晚[10],或者不出现明显的病理学及行为学改变[11],影响了实验研究的可行性。70%~80%早发家族性AD是由PS1基因突变所致[12-13],故此次实验选取APPswe转基因小鼠与PS转基因小鼠杂交,建立APPswe/PS1双转基因小鼠模型。有数据显示此模型最早可在小鼠4、5月龄时出现老年斑[5],笔者在小鼠6月龄时每组随机抽取两只进行检测,未发现明显老年斑。
黄连解毒汤出自唐代王焘的《外台秘要》,其由黄连、黄芩、黄柏、栀子四味苦寒药物组成,是清热解毒的经典方剂。有研究表明AD患者脑内Aβ沉积、老年斑形成及其周围局灶性炎症反应使得Aβ和炎性细胞因子形成毒性环路,不断损伤神经细胞,最终导致神经退行性病变[14-15]。该病理过程中产生的Aβ具有神经毒性作用,属于中医“毒”的范畴,其中医病理机制为“毒损脑络”,而Aβ即是“毒损脑络”机制中的启动环节。
本研究结果表明,黄连解毒汤各剂量组小鼠β-APPmRNA表达量较CMC对照组明显降低(P<0.05),其中中剂量组小鼠β-APPmRNA表达量与西药安理申组比较差异具有统计学意义(P<0.01)。提示黄连解毒汤能有效干预β-APP基因表达,阻止Aβ沉积形成老年斑,减轻神经毒性作用,疗效优于西药安理申,对阿尔茨海默病具有较好的预防及治疗作用。
[1] 岳启安,赵淑梅,王红艳,等.中药呆聪液对痴呆大鼠模型脑内β-淀粉样前体蛋白(β-APP)基因表达的影响[J].潍坊医学院学报,2007,29(5):389-391.
[2] FERRI CP,PRINCE M,SCAZUFCA M,et al.Global prevalence of dementia:a Delphi consensus study[J].Lancet,2005,366(9503):2112-2117.
[3] ZHANG ZX,ZAHNER GE,ROMAN GC,et al.Demential subtypes in China:prevalence in Beijing,Xi’an,Shanghai,and Chengdu[J].Arch Neurol,2005,62(3):447-453.
[4] 张婧.早发性痴呆相关基因的研究[J].实用医学杂志,2008,24(21):3781-3783.
[5] 宗园媛,王晓英,王海林,等.APP/PS双转基因阿尔茨海默病小鼠模型的老年斑及行为学动态分析[J].中国比较医学杂志,2008,18(9):8-12.
[6] 夏春梅,李娜,章海燕,等.不同基因型阿尔茨海默病模型小鼠的脑组织免疫组化研究[J].上海交通大学学报:农业科学版,2008,26(2):104-108.
[7] 赵婷婷.阿尔茨海默病的免疫学机制及其治疗进展[J].免疫学杂志,2003,19(3):133-137.
[8] 江三多,汤国梅,张明园,等.阿尔茨海默病中β-淀粉样前体蛋白基因外显子9、10的mRNA表达及突变研究[J].遗传,2003,25(5):538-542.
[9] 黑爱莲,蔡剑平.阿尔茨海默病动物模型的概述[J].中国神经免疫学和神经病理学杂志,2005,12(4):223-225.
[10] BLOOM FE,REILLY JF,REDWINE JW,et al.Mouse models of human neurodegenerative disorders:requirements for medication development[J].Arch Neurol,2005,62(2):185-187.
[11] MUCKE L,MASLIAH E,YU GQ.High-level neuronal expression of abeta1-42 in wild-type human amyloid protein precursor transgenic mice:synaptotoxicity without plaque formation[J].J Neurosci,2000,20(11):4050-4058.
[12] TANZI RE,BERTRAM L.Twenty years of the Alzheimer’s disease amyloid hypothesis:a genetic perspective[J].Cell,2005,120(4):545-555.
[13] STROOPER BD,ANAERT W.Presenilins and the intramembrane protolysis of proteins:facts and fiction[J].Nature,2006,440(7082):352-357.
[14] COOPER NR,BRADT BM,O’BARR-S.Focal inflammation in the brain:role in Alzheimer’Disease[J].Immnnol Res,2000,21(2-3):159.
[15] 韩杰,李明,郑莉沙.阿尔茨海默病患者血清与脑脊液中多种细胞因子的研究[J].中华老年心脑血管病杂志,2005,7(2):112-114.
(责任编辑:尹晨茹)
Experimental Study of the Effect of Huanglianjiedutang on Gene Expression of β-Amyloid Precuser Protein for APP/PS1 double transgenic mice Alzheimer’s disease mouse model
Feng Pei
(The 3th People’s Hospital of Hubei,Wuhan 430032,China)
Objective:To explore the effect of Huanglianjiedutang(HLJDT) on gene expression of β-APP for APP/PS1 double transgenic mice Alzheimer’s disease(AD) mouse model.Methods:3 months’old APP/PS1 double transgenic mice were used as AD models and were randomly divided into model control group(CMC group),western medicine Aricept control group (positive control group),HLJDT large dose group (large HLJDT group),HLJDT middle dose group (middle HLJDT group),HLJDT small dose group (small HLJDT group).The effect of HLJDT onβ-APP gene expression for AD mice model by reverse transcription-polymerase chain reaction(RT-PCR).Results:Gene expression of β-APP increased in the CMC group. HLJDT of the three different dose groups compared with the AD model group,the difference was significant (P<0.05),that all can reduce the content of β-APP mRNA.Meanwhile,middle HLJDT group was the most significant.Conclusion:HLJDT can reduce the expression of β-amyloid precursor protein gene,and the effect of middle dose was better than aricept.
Huanglianjiedutang;APP/PS1 Double Transgenic Mouse Model of Alzheimer's Disease;β-amyloid Precursor Protein Gene;Gene Expression
2015-07-14
冯佩(1985-),女,湖北省第三人民医院住院医师,研究方向为中西医结合。
冯 佩
(湖北省第三人民医院,湖北 武汉 430032)
R285.5
A
1673-2197(2015)24-0014-03
10.11954/ytctyy.201524006
