小麦根际土壤中禾谷多黏菌实时荧光定量PCR检测体系的建立及应用
2015-03-15王燕霞吴季荣俞明正赵晶晶邢宇俊徐剑宏史建荣
王燕霞, 吴季荣, 俞明正, 赵晶晶, 邢宇俊, 徐剑宏, 史建荣
(1.南京师范大学生命科学学院,江苏 南京 210046;2.江苏省农业科学院食品质量与安全检测研究所,江苏 南京 210014;3.江苏转基因安全评价公共技术服务中心,江苏 南京 210014)
自1983年第一例转基因烟草诞生以来[1],转基因作物便得到了迅猛的发展,商业化种植面积也从1996年的 1.70×106hm2增长到了 2014年的1.815 ×108hm2[2]。转基因作物给人类社会带来巨大经济效益的同时,其对生态环境存在的潜在威胁也成为人们越来越关注的话题。目前,国内外对转基因作物的研究主要集中在转Bt基因的水稻、棉花、玉米和马铃薯上[2-6]。其研究内容也多以转基因作物对其根际土壤中微生物的群落结构及主要酶活性的影响为主[7-9],而对转基因抗病小麦根际土壤中微生物数量的研究则比较少。
禾谷多黏菌(Polymyxa graminis)是一种专性寄生于植物根部的根肿菌目真核生物,最初在小麦中发现,而后又相继在其他谷类作物中发现。禾谷多黏菌本身无害,但其可通过孢子传播大麦黄花叶病毒(Barley yellow mosaic virus,BaYMV)、大麦和性花叶病毒(Barley mild mosaic virus,BaYMMV)、小麦梭条花叶病毒(Wheat spindle streak mosaic virus,WSSMV)以及小麦黄花叶病毒(Wheat yellow mosaic virus,WYMV),进而使寄主染病[10-11]。因此,禾谷多黏菌数量的变化可以作为评价土壤环境的一项指标。
转基因小麦N12-1转入了小麦黄花叶病毒的复制酶基因WYMV-Nib8,对小麦黄花叶病具有显著的抗性[12-13]。本研究拟建立基于实时荧光定量PCR(Quantitative real-time PCR)方法检测禾谷多黏菌数量的体系,并将该体系应用于转基因小麦N12-1及其受体小麦扬麦158不同生长期根际土壤中禾谷多黏菌数量的检测,以期为研究转基因作物对土壤微生物生态系统的影响提供一定的技术参考。
1 材料和方法
1.1 供试材料
转WYMV-Nib8基因小麦N12-1及其受体小麦扬麦158,其中N12-1由中国农业科学院提供。
1.2 方法
1.2.1 田间设计 大田试验于2013年10月—2014年6月在江苏省农业科学院转基因作物实验基地(六合)进行。每个品种种植4个小区,随机区组。每个小区长10 m,宽6 m。小麦按行播种,行长6 m,行距30 cm,株距3 cm。
1.2.2 土壤样品的采集 分别在小麦生长的播种期、苗期、返青期、抽穗期、灌浆期以及成熟期采集根际土壤样品。每个小区采取“W”型五点取样法,采集小麦根际土壤样品。采样点经GPS定位后,设为固定采样点。将从5个点采集的土样混合成一个重复,新鲜土样经20目筛后,用小自封袋收集,4℃保存,备用。
1.2.3 土壤总DNA的提取 称取0.500 g土壤样品,利用Ultra CleanTMsoil DNA isolation kit(MoBio,USA)试剂盒,根据操作步骤进行土壤总DNA的提取。最后将其溶于50μl ddH2O中,-20℃保存,备用。
1.2.4 禾谷多黏菌标准质粒的制备 在NCBI中筛选出多个禾谷多黏菌核糖体DNA(rDNA)序列,通过序列分析,在其相对于其他菌的rDNA保守区域设计1对特异性引物Pg-F(5'-CTGCGGAAGGATCATTAGCGTTG-3')和 Pg-R(5'-CCGATACTCAGAGAGGCATGCT-3')。利用上述引物对土壤总DNA中的目的片段进行PCR扩增。PCR反应体系为25.0 μl,其中包括 rTaq酶 0.125 μl,10 ×PCR buffer 2.5 μl,dNTP 2.0 μl,MgCl21.5 μl,上下游引物各1.0μl,模板1.0μl。反应条件为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测,将特异条带切胶回收。回收产物连接到载体pMD19-T(TaKaRa公司产品)上,并通过热激法转化到大肠杆菌感受态细胞DH5α。将其涂布在氨苄抗性平板上,37℃过夜筛选。PCR鉴定呈阳性的克隆送至上海生工生物工程有限公司进行测序。将测序结果呈阳性的克隆进行扩大培养,并提取质粒。经微量紫外分光光度计测定浓度后,计算拷贝数。质粒拷贝数=质粒浓度×6.023×1023/MW,式中MW=(克隆载体长度+目的片段长度)×324×2,质粒浓度的单位为 g/μl,MW 单位为g/mol,克隆载体长度和目的片段长度的单位为bp。
1.2.5 实时荧光定量 PCR体系的建立 使用QuantiFastTMSYBR green PCR kit(Qiagen,Germany)试剂盒,建立20.0μl的反应体系,其中2×Master mix 10.0μl,去离子水8.0μl,上下游引物各 0.5 μl,模板1.0μl。反应在 Rotor Gene 6000荧光定量PCR仪(Rcorbett,Australia)上进行,PCR反应条件为:95℃预变性10 min;95℃变性10 s,55℃退火20 s,72℃延伸20 s,40个循环。每组试验设置1个阴性对照。将标准质粒用ddH2O进行1∶10的稀释,选5个稀释梯度与样品一起进行扩增。
1.2.6 数据分析 用SPSS16.0软件统计分析实时荧光定量PCR数据,采用邓肯氏新复极差法检验小麦不同生长期根际土壤中禾谷多黏菌数量的差异性。
2 结果与分析
2.1 禾谷多黏菌标准质粒实时荧光定量PCR检测体系的建立
通过微量紫外分光光度计测得标准质粒的DNA浓度,计算得到禾谷多黏菌标准质粒的浓度为1μl 5.34×1010拷贝。将起始标准质粒按10倍梯度稀释,并根据敏感度分析选取10-2~10-6倍稀释质粒为模板进行荧光定量扩增。得到标准质粒扩增的扩增曲线和熔解曲线(图1)。图1显示,标准质粒熔解曲线峰值单一,扩增曲线较光滑,呈现典型的“S”型,且间隔均匀,说明标准质粒荧光定量扩增的特异性很高。
由标准质粒扩增结果构建标准曲线(图2),标准曲线的相关系数(r)为0.999,扩增效率为95%,斜率为-3.444。说明该标准曲线的相关系数误差较小,得到的数据合理有效。
根据标准质粒与土壤样品扩增结果绘制熔解曲线(图3),熔解曲线的峰值为 (85.5±0.3)℃。峰值单一,没有明显的杂峰,且阴性对照没有峰。说明该扩增产物特异性较高,且不受引物二聚体的影响。
综合以上结果,可以确定该扩增体系具有较高的特异性、合理的扩增效率,扩增结果可靠。因此,该体系可用于对小麦根际土壤中禾谷多黏菌的定量检测与分析。

图1 实时荧光定量PCR对标准质粒的特异性检测Fig.1 Specificity test of quantitative real-time PCR reaction to standard plasmid

图2 实时荧光定量PCR标准曲线Fig.2 Standard curve of quantitative real-time PCR
2.2 小麦根际土壤中禾谷多黏菌数量的检测

图3 实时荧光定量PCR的熔解曲线Fig.3 Melting curve of quantitative real-time PCR
利用本研究建立的实时荧光定量PCR检测体系,对转基因小麦N12-1及其受体扬麦158根际土壤中禾谷多黏菌的数量进行检测。检测结果(图4)显示,禾谷多黏菌的拷贝数在小麦的不同生长期不同,呈现先上升后逐渐下降的趋势。从小麦播种期的1 g土壤 5.98 ×104拷贝(N12-1)和 4.86 ×104拷贝(扬麦158)开始逐渐升高,在返青期达到最大值,分别为 1 g土壤 6.59×105拷贝(N12-1)和 8.37×105拷贝(扬麦158),而在抽穗期、灌浆期和成熟期又逐渐下降。方差分析结果显示,转基因小麦N12-1与其受体扬麦158根际土壤中禾谷多黏菌的拷贝数无显著差异(P=0.983),但生育期之间表现出极显著差异(P<0.001)。
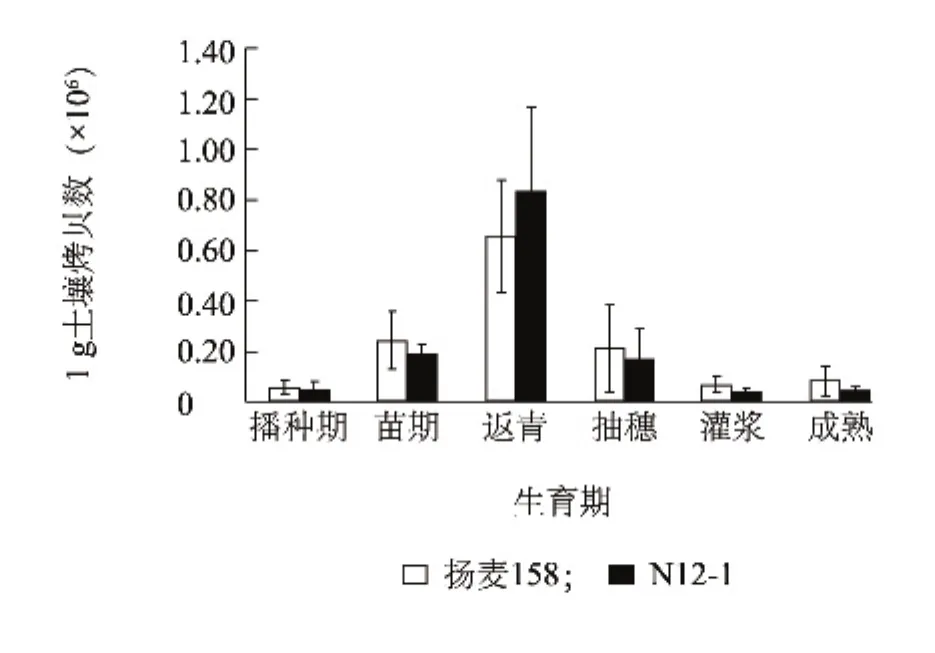
图4 转WYMV-Nib8基因小麦N12-1及其受体扬麦158不同生育期根际土壤中禾谷多黏菌的拷贝数Fig.4 The quantity of P.graminis in transgenic wheat N12-1 and its recipient Yangmai158 during growth
3 讨论
随着转基因作物种植面积的不断扩大,转基因作物的安全性评价也不再仅仅局限于对外源基因及外源基因编码蛋白质的直接检测上[14]。在整个农业生产过程中,土壤微生物扮演着重要的角色。土壤微生物是土壤有机质和土壤养分转化和循环的动力,而其群落结构和数量又受到植物根系分泌物的影响[15]。据报道,土壤中微生物的变化也能反映整个土壤环境的变化,例如土壤中真菌与细菌的比率就能反映土壤中的C∶N。因此,评价转基因植物对土壤微生物的影响具有重要的生态学意义[16]。而在农业生产中,与土壤环境对土壤微生物群落组成的影响相比,土壤微生物数量对土壤环境的变化要更为敏感[17]。。
实时荧光定量PCR技术是一种灵敏度高、重复性好、方便快捷的定量方法[18-19]。本试验利用实时荧光定量PCR技术,通过土壤微生物总DNA和特异性的引物对目的基因在土壤样品中的分子数目进行绝对定量。结果表明,基于实时荧光定量PCR技术建立的检测体系可实现对土壤中禾谷多黏菌拷贝数的实时监测。通过转基因小麦N12-1与其受体扬麦158根际土壤中禾谷多黏菌数量的比较,发现两个品种之间不存在显著差异。由此推断,转基因小麦N12-1对其根际土壤中禾谷多黏菌的数量没有显著影响。而禾谷多黏菌拷贝数在小麦生育期之间的极显著差异可能是受到小麦根系分泌物的影响。在返青期达到最大值也与小麦黄花叶病通常发病于小麦返青期相一致[20]。Wu等研究发现,转基因小麦N12-1对其根际土壤中微生物群落结构及土壤酶活性没有显著影响[21]。而早在 2008 年,Liu 等[22]就通过PCR-DGGE和T-RFLP分析,证明了转Bt基因水稻对其根系土壤中微生物群落结构没有影响。更有学者证明转Bt基因水稻秸秆还田后对土壤微生物功能及多样性都没有明显的影响[23]。因此,本研究结果也在一定程度上有效地说明了转基因小麦N12-1种植的安全性。
由于作物种植环境的复杂性和时效性,我们还需进行进一步的跟踪监测,建立深入全面的检测体系,以获得长期有效的数据,进而阐明转基因小麦N12-1对其根际土壤微生物生态系统的影响。
[1] 徐文涛,何晓云,黄昆仑,等.转基因植物的食品安全性问题及评价策略[J].生命科学,2011,23:179-185.
[2] JAMESC.2014年全球生物技术/转基因作物商品化发展态势[J].中国生物工程杂志,2015,35(1):1-14.
[3] 姜永厚,傅 强,程家安,等.转Bt基因水稻表达的毒蛋白Cry1Ab在害虫及其捕食者体内的积累动态[J].昆虫学报,2004,47(4):454-460.
[4] HEAD G,AUBER J B,WATSON J A,et al.No detection of Cry1Ac protein in soil after multiple years of transgenic Bt cotton(Bollgard)use [J].Environmental Entomology,2006,31:30-36.
[5] JIANG W Y,GENG L L,DAI P L,et al.The influence of Bttransgenic maize pollen on the bacterial diversity in the midgut of Chinese honeybees,Apiscerana cerana [J].Journal of Integrative Agriculture,2013,12(3):474-482.
[6] REED G L,JENSEN A S,RIEBE J,et al.Transgenic Bt potato and conventional insecticides for Colorado potato beetle management:comparative efficacy and non-target impacts[J].Entomologia Experimentalis et Applicata,2001,100:89-100.
[7] LAHL K,UNGER C,EMMERLING C,et al.Response of soil microorganisms and enzyme activities on the decomposition of transgenic cyanophycin-producing potatoes during overwintering in soil[J].European Journal of Soil Biology,2012,53:1-10.
[8] 李永山,范巧兰,陈 耕,等.转Bt基因棉花对土壤微生物的影响[J].农业环境科学学报,2007,26(10):533-536.
[9] 杜 娟,吴季荣,俞明正,等.转基因小麦根际土壤中荧光假单胞菌数量的变化[J].麦类作物学报,2014,34(3):345-350.
[10]陈 平.中国禾谷多黏菌传麦类病毒研究现状与展望[J].自然科学进展,2005(15):524-533.
[11] KUTLUK Y N D,LYONSR L,SMITH M J,et al.Investigation of soilborne mosaic virus diseases transmitted by Polymyxa graminis in cereal production areas of the Anatolian part of Turkey[J].European Journal of Plant Pathology,2010,130(1):59-72.
[12]徐惠君,庞俊兰,叶兴国,等.基因枪介导法向小麦导入黄花叶病毒复制酶基因的研究[J].作物学报,2001,27(6):688-693.
[13]吴宏亚,张伯桥,高德荣,等.转WYMV-Nib8基因抗黄花叶病小麦的鉴定及优良株系的选育[J].麦类作物学报,2006,26(6):11-14.
[14]张洪瑞,朱其松,宋克勤,等.转基因食品的安全性评估与检测技术[J].河北农业科学,2008(12):101-103.
[15] BABEKOVA R,FUNK T,PECORAROS,et al.Development of an event-specific real-time PCRdetection method for the transgenic Bt rice line KMD1[J].European Food Research and Technology,2009,228:707-716.
[16]曹 阳,丁 伟,李新海,等.转DREB3基因抗旱大豆对土壤微生物群落及有益微生物的影响[J].东北农业大学学报,2011,42(1):17-20.
[17] FIERER N,STRICKLAND M S,LIPTZIN D,et al.Global patterns in belowground communities[J].Ecology Letters,2009,12(11):1238-1249.
[18] BURGER M,JACKSON L E.Plant and microbial nitrogen use and turnover:rapid conversion of nitrate to ammonium in soil with roots[J].Plant and Soil,2005,266(1-2):289-301.
[19]王秀宇,林凡云,吴季荣,等.转基因小麦根际土壤镰刀菌Realtime QPCR方法的建立及应用[J].江苏农业学报,2012,28(5):1163-1167.
[20] HAN C,LI D,XING Y,et al.Wheat yellow mosaic virus widely occurring in wheat(Triticum aestivum)in China[J].Plant Disease,2000,84(6):627-630.
[21] WU JR,YUM Z,XU JH,et al.Impact of transgenic wheat with wheat yellow mosaic virus resistance on microbial community diversity and enzyme activity in rhizosphere soil[J].PLoSOne,2014,9(6):e98394.
[22] LIU W,LUH H,WUWX,et al.Transgenic Bt rice does not affect enzyme activities and microbial composition in the rhizosphere during crop development[J].Soil Biology and Biochemistry,2008,40(2):475-486.
[23] FANG H,DONG B,YAN H,et al.Effect of vegetation of transgenic Bt rice lines and their straw amendment on soil enzymes,respiration,functional diversity and community structure of soil microorganisms under field conditions[J].Journal of Environmental Sciences,2012,24(7):1259-1270.
