猪RELMβ基因启动子区克隆及序列分析
2015-03-15雷明明于建宁王公金施振旦
陈 哲, 雷明明, 于建宁, 王公金, 施振旦
(江苏省农业科学院畜牧研究所,动物品种改良与繁育重点实验室,江苏 南京 210014)
抵抗素样 β(Resistin-like molecule β,RELMβ)是抵抗素样家族(Resistin-like molecules,RELMs)一员,RELMs共有 4个成员,分别是 RELMα、RELMβ、resistin和RELMγ,该家族成员在C端信号区内含有独特的10到11个半保守的半胱氨酸残基,可通过二硫键形成低聚分子[1]。RELMs在糖尿病、炎症反应、免疫反应和细胞增殖方面都有相关作用[2]。RELMβ又称发现于炎症带2(Found in inflammatory zone 2,FIZZ2),最初是在啮齿类和人类的胃肠道发现,在近端和远端结肠表达量最为丰富[3]。
研究发现,RELMβ可由肠道杯状细胞产生,并作为Th2细胞因子诱导的免疫效应因子,参与胃肠道感染的耐受[4]。RELMβ可以通过依赖 IL-4(Interleukin 4)和IL-13的调控途径产生抗寄生虫作用[5],同时还可直接与寄生虫的化学感受部位结合,干扰寄生虫营养供给,起到蠕虫抑制剂的作用[6]。此外,RELMβ还可以通过上调肠道先天免疫因子MUC2的转录水平和蛋白表达水平,保护肠道粘膜屏障的完整性[7]。RELMβ作为一个免疫相关的重要候选基因,对畜禽健康具有重要意义。
目前对RELMβ的功能有了较为广泛的研究,但其表达调控机制尚不十分清晰。本研究利用荧光素酶报告基因系统,对猪RELMβ基因启动子进行结构和活性分析,找到RELMβ基因启动子的核心调控区域,为进一步研究猪RELMβ基因表达调控机制奠定基础。
1 材料与方法
1.1 材料和试剂
Premix Taq 酶、T4 DNA 连接酶、DNA marker、内切酶、琼脂糖回收纯化试剂盒、小提质粒提取试剂盒、中提质粒提取试剂盒购自宝生物(大连)有限公司,克隆所用菌株DH5α为本实验室保存,pGL3-basic、pGL3-Enhancer、pRL-Tk 载体和双荧光素酶检测试剂盒购自Promega公司,人胚肾细胞株293T、人结肠腺癌细胞株HT29购自凯基生物(南京),Lipo LTX、Opti-MEM、DMEM培养基、胎牛血清购自Invitrogen公司,引物合成及DNA测序由英潍捷基(上海)贸易有限公司完成。
1.2 试验方法
1.2.1 生物信息学分析 使用 GPMiner(http://www.fruitfly.org/seq_tools/promoter.html)预 测RELMβ基因 5'端转录起始位点 TSS;使用 TFSEARCH 在线软件(http://mbs.cbrc.jp/research/db/TFSEARCH.html)和 Genomatix MatInspector(http://www.genomatrix.de/cqi-bin)对潜在转录因子结合位点进行预测;使用NCBI网站Blast(http://blast.ncbi.nlm.nih.gov/)序列分析软件对猪、人(NCBI登录号:NT_005612)和小鼠(NCBI登录号:NT_039624)启动子序列进行多重比对,比较同源性;使用Primer6.0软件里的Motif模块进行TATA-box(识别序列TATAWAW,W代表A或T)、CAAT-box(识别序列 CCAAT)和 GC-box(识别序列GGGCGG)位点预测。
1.2.2 引物设计和PCR 根据GenBank获得的人RELMβ基因(登录号:NT_005612)序列以及猪RELMβ基因mRNA序列(登录号:NM_001103210),结合引物设计原则,采用Primer 6.0软件自行设计6对PCR引物序列(表1),并在上下游引物引入NheⅠ和XhoⅠ酶切位点。在0.2 ml PCR反应管中加入 Premix Taq 12.5 μl,DNA 模板1 μl,上下游引物各1μl,无菌去离子水9.5μl。PCR反应条件:98℃预变性3 min;98℃变性30 s,退火30 s,72℃延伸1 min,循环36次,最后产物在72℃延伸10 min。

表1 扩增RELMβ基因启动子片段引物Table 1 Primers designed for amplifying promoter segments of porcine RELMβgene
1.2.3 报告基因载体构建 将PCR反应获得的不同长度启动子片段纯化,经NheⅠ和XhoⅠ双酶切、凝胶回收、T4 DNA连接酶连接后,定向克隆到报告基因载体pGL3-Enhancer中,利用NheⅠ和XhoⅠ双酶切和测序方法,筛选构建正确的重组猪RELMβ基因启动子荧光素酶报告质粒。
1.2.4 细胞培养和瞬时转染试验 用含有10%胎牛血清、青霉素(100 U/ml)和链霉素(100 U/ml)的DMEM培养基,37℃、5%CO2、饱和湿度的培养箱内培养胚肾293T细胞、人结肠腺癌细胞 HT29,0.25%胰酶消化液消化传代,每2 d传代1次。
接种293T、HT29细胞于96孔板,当细胞生长至汇合率 70%~80%时,将构建的pGLRELMβ-Enhancer系列缺失片段荧光素酶报告载体采用脂质体Lipo LTX转染到以上细胞内,作为试验组,同时转染 pGL3-basic为阴性对照组,pRL-TK为内参质粒,试验重复3次,每组3个平行试验。基因瞬时转染参照Lipofectamine LTX试剂盒说明书进行。
1.2.5 双荧光素酶活性分析 转染24 h后,收集细胞,加入30μl细胞裂解缓冲液,室温摇晃15 min后,吹打细胞,收集裂解液至96孔白板,加入100μl荧光素酶分析剂(LARⅡ),放置发光检测仪Glomax(Promega)中,测定Firefly荧光素酶活性(M1),然后再加入100μl Stop&Glo reagent,测定内参质粒中Renilla荧光素酶活性(M2),计算荧光素酶相对活性(M1/M2)。
1.2.6 数据统计分析 不同缺失片段启动子活性值之间的比较在Excel中进行,统计方法使用t检验。
2 结果
2.1 猪RELMβ基因启动子系列缺失片段的扩增
通过PCR分别得到1 057 bp(-842~+215)、1 008 bp(-793~ +215)、789 bp(-574~ +215)、397 bp(-182~ +215)、362 bp(-147~ +215)和301 bp(-86~+215)的启动子片段。PCR产物经凝胶电泳检测显示扩增长度符合预期,重组报告载体经过NheⅠ和XhoⅠ双酶切和DNA测序验证,不同长度RELMβ启动子报告基因载体构建成功(图1)。
2.2 猪RELMβ基因启动子序列生物信息学分析

图1 重组RELMβ基因报告载体双酶切鉴定Fig.1 Identification of recombinant RELMβ gene report plasmid by double enzyme digestion
对猪RELMβ基因5'端序列进行在线生物信息学分析发现,猪RELMβ基因启动子区存在1处TATA box,1 处 CAAT box,无 GC box。GPMiner在线分析预测猪和人RELMβ基因转录起始位点在-556 bp和-487 bp处。截取猪、人(NCBI登录号:NT_005612)、小鼠(NCBI登录号:NT_039624)的RELMβ基因起始密码子前842 bp启动子序列进行多重比对发现,猪和人的同源性是34.9%,猪和小鼠的同源性是82.4%。
尽管猪和人之间RELMβ基因启动子序列保守性较低,结合TFSEARCH和Genomatix MatInspector预测猪RELMβ基因启动子转录因子结合位点,比较发现,猪和人RELMβ基因启动子区还是存在许多保守的潜在转录因子结合位点,包括 Cdx2,SRY,NFKB,NKX-2,c-Myb,GATA-1,GATA-3,C/EBP,MZF等(图2)。
2.3 猪RELMβ基因启动子活性分析
将构建的 pGL-RELMβ(-842~ +215)、pGLRELMβ(-793~ +215)、pGL-RELMβ (-574~+215)、pGL-RELMβ(-182~ +215)、pGL-RELMβ(-147~+215)和 pGL-RELMβ(-86~ +215)启动子报告载体分别转染至HT29和293T细胞,双荧光素酶报告基因检测结果表明:不同长度RELMβ启动子在HT29和293T细胞均具有活性,且在2个细胞系中,pGL-RELMβ(-574~+215)活性均为最强,显著高于其他报告质粒的活性(P<0.01)。从pGL-RELMβ (-574~ +215)到 pGL-RELMβ(-182~+215)的相对荧光值下降幅度最大,推测在-574~-182位点存在RELMβ基因启动子的关键顺式调控元件(图3)。

图2 猪和人RELMβ基因启动子序列比较分析Fig.2 Alignment of RELMβ gene promoter sequence of swine and human
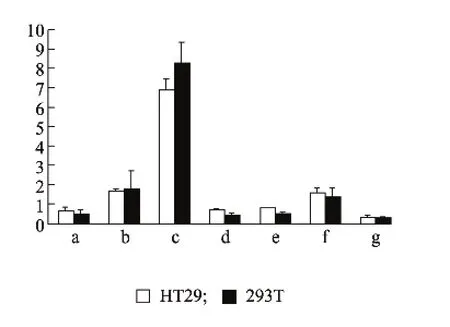
图3 RELMβ基因启动子不同片段在细胞系内的相对荧光素酶活性Fig.3 Activities of different segments of RELMβ promoter in HT29 and 293T cells
3 讨论
肠道是能量摄取和营养吸收器官,也是重要的内分泌器官,RELMβ参与肠道内葡萄糖转运、胰岛素抵抗等生理功能。RELMβ通过GLUT2表达量和活性的增强提高空肠内葡萄糖的吸收[8];小鼠试验发现RELMβ基因可能是营养因素诱导的胰岛素抵抗行为的重要调节因子[9],进一步的研究结果表明,RELMβ可能通过P38/MAPK途径参与胰岛素信号通路[10]。目前RELMβ已成为研究肠道疾患和评估肥胖型胰岛素抵抗的新靶标[10-11]。
为探讨RELMβ基因转录调控机制,本研究通过PCR方法从猪DNA获得RELMβ基因上游-842~+215 bp的启动子序列,进而构建了不同长度的RELMβ启动子重组报告质粒,发现-574~+215 bp活性最强,在-574~-182 bp区域存在RELMβ基因启动子的关键顺式调控元件,TFSEARCH和Genomatix Mat Inspector软件分析这一区域(匹配率参数分别设为90和0.9),发现 SRY、Cdx2、GATA-1 和 MZF1 匹配率较高。性别决定转录因子(SRY)是一类含有HMG-box DNA结合区的转录因子,在睾丸特异性表达,在肠道组织的表达还未发现,因此本研究得到的SRY结合位点可能是同样含有HMG-box DNA结合区的类SRY基因,又称SOX基因,Rath等研究SMP30基因(在肝细胞和肾小管上皮细胞特异性表达)启动子区活性也发现相似的现象[12]。SOX基因是一类与发育相关的基因,部分SOX基因(如SOX17)可以通过Wnt信号通路抑制与结肠癌细胞的生长与分裂有关的靶基因表达[13]。尾型同源盒转录因子2(Cdx2)仅在成体肠道中表达,是肠特异性转录因子,在肠上皮发育以及肠表型分化和维持中起到重要作用[14],研究还发现,Cdx2可以特异性结合于黏液蛋白因子MUC2的启动子,提高MUC2的表达水平[15]。郑丽端等在人RELMβ基因启动子区发现核心调控元件Cdx2能显著增强启动子活性[11],进一步证明Cdx2在调控哺乳动物RELMβ基因启动子活性中起到重要作用。髓样锌指蛋白1(MZF-1)通过调节蛋白激酶C-alpha的转录活性参与细胞的增殖、分化、转化和凋亡[16],Chelbi等研究发现MZF-1是SERPINA3基因启动子转录激活过程不可缺少的转录因子,MZF-1结合在SERPINA3基因启动子区结合位点可以激活其抗菌防御作用[17]。GATA家族是一类含锌指结构的转录调节因子,在胚胎发育时期能促进胃肠道的正常发育,并有助于在成年肠上皮细胞的不断更新中调节组织分化,在体内,GATA-1和c-Myb的相互作用会抑制GATA-1与DNA的结合,转录因子GATA-1和c-Myb相互抑制各自的转录活性[18],本研究中猪RELMβ基因启动子区包含GATA-1和c-Myb结合位点,说明GATA-1和c-Myb很有可能参与了RELMβ基因的转录调控。
猪和人RELMβ基因启动子区都存在CdxA,SRY,NFKB,NKX-2,c-Myb,GATA-1,GATA-3,C/EBP,MZF1等转录因子结合位点,说明抵抗素样家族的转录调控模式在进化上有保守性。下一步工作将通过定点突变和缺失等方法进一步探究RELMβ基因的核心启动子及其转录活性受哪些转录因子影响。
[1] BANERJEE R R,LAZAR M A.Resistin:molecular history and prognosis[J].J Mol Med,2003,81(4):218-226.
[2] 蔡嘉斌,郑丽端,童强松.RELMS家族及其生物学功能研究进展[J].中国病理生理杂志,2008(10):2068-2071.
[3] STEPPAN C M,BAILEY ST,BHAT S,et al.The hormone resistin links obesity and diabetes[J].Nature,2001,409(6818):307-312.
[4] ARTISD,WANG M L,KEILBAUGH SA,et al.RELMbeta/FIZZ2 is a goblet cell-specific immune-effector molecule in the gastrointestinal tract[J].PNAS,2004,101(37):13596-13600.
[5] HEBERT D R,YANG JQ,HOGAN SP,et al.Intestinal epithelial cell secretion of RELM-beta protects against gastrointestinal worm infection[J].J Exp Med,2009,206(13):2947-2957.
[6] DANN SM,ECKMANNL.Innate immunedefenses in the intestinal tract[J].Curr Opin Gastroenterol,2007,23(2):115-120.
[7] KRIMI R B,KOTELEVETSL,DUBUQUOY L,et al.Resistinlikeβmolecule regulates intestinal mucous secretion and curtails TNBS-induced colitis in mice[J].Inflamm Bowel Dis,2008,14(7):931-941.
[8] KRIMI R B,LETTERON P,CHEDID P,et al.Resistin-like molecule-βinhibits SGLT-1 activity and enhances GLUT2-dependent jejunal glucose transport[J].Diabetes,2009,58(9):2032-2038.
[9] FUJIO J,KUSHIYAMA A,SAKODA H,et al.Regulation of gutderived resistin-like moleculeβ expression by nutrients[J].Diabetes Res Clin Pr,2008,79:2-10.
[10] KUSHIYAMA A,SHOJIMA N,OGIHARA T,et al.Resistin-like moleculeβ activates MAPKs,suppresses insulin signalingin hepatocytes,and induces diabetes,hyperlipidemia,and fatty liver in transgenic mice on a high fat diet[J].J Biol Chem,2005,280(51):42016-25.
[11]郑丽端,童强松,杨渝珍,等.人类RELM-beta基因启动子的结构与功能分析[J].中国生物化学与分子生物学报,2007,23(7):548-553.
[12] RATH B,PANDEY R S,DEBATA P,et al.Molecular characterization of senescence marker protein-30 gene promoter:Identification of repressor elements and functional nuclear factor binding sites[J].BMC Mol Biol,2008,9:43.
[13] KATOH M.Expression of human SOX7 in normal tissues and tumors[J].Int JMol Med,2002,9:363-368.
[14] COLLEYPRIEST B J,FARRANT J M,SLACK J M,et al.The role of Cdx2 in barrett’s metaplasia [J].Biochem Soc Trans,2010,38:364-369.
[15] YAMAMOTO H,BAI Y Q,YUASA Y.Homeodomain protein CDX2 regulates goblet-specific MUC2 gene expression[J].Biochem Biophys Res Commun,2003,300(4):813-818.
[16] HSIEH Y H,LIU JY.Supression of tumorigenicity of human hepatocellular carcinoma cells by antisense oligonucleotide MZF-1[J].Chin J Physiol,2007,50(1):217-225.
[17] CHELBI ST,WILSON M,VEILLARD A C,et al.Genetic and epigenetic mechanisms collaborate to control SERPINA3 expression and its association with placental diseases[J].Hum Mol Genet,2012,21(9):1968-1978.
[18] ANDERSON M K.At the crossroads:diverse roles of early thymocyte transcriptional regulators[J].Immunol Rev,2006,209(1):191-211.
