3种实验技术在多发性骨髓瘤检测中的应用
2015-03-15王志银新乡医学院河南新乡453000新乡医学院第一附属医院河南新乡45300
芦 晗,王志银,李 强△(.新乡医学院,河南新乡 453000;.新乡医学院第一附属医院,河南新乡 45300)
3种实验技术在多发性骨髓瘤检测中的应用
芦 晗1,王志银2,李 强2△(1.新乡医学院,河南新乡 453000;2.新乡医学院第一附属医院,河南新乡 453100)
目的 评估形态学、免疫组化和流式细胞检测技术在多发性骨髓瘤(MM)检测中的应用价值。方法收集新乡医学院第一附属医院2013年9月至2014年5月MM患者30例,采用免疫组化和流式细胞术分析骨髓瘤细胞免疫表型,探讨其表达率与骨髓瘤细胞形态特征及相关检测指标的关系。3种检测方法组间差异采用配对样本t检验,率的比较用χ2检验。结果 形态学检测瘤细胞比例在6.00%~95.00%,免疫组化检测瘤细胞比例在9.00%~88.00%,流式细胞检测瘤细胞比例在4.07%~87.42%。形态学与免疫组化、形态学与流式细胞之间差异有统计学意义(P<0.05),免疫组化与流式细胞之间差异无统计学意义(P>0.05)。结论 流式细胞术、免疫组化与形态学3种技术相结合,更有助于MM的诊断及预后判断。
多发性骨髓瘤; 流式细胞术; 免疫组化; 形态; 免疫表型
多发性骨髓瘤(MM)是以B细胞起源,骨髓中恶性浆细胞(瘤细胞)异常增生和聚集为特征的一种衰竭性、难以治愈的恶性肿瘤,并伴有单克隆免疫球蛋白或其成分(M蛋白)增多。MM好发于40岁以上中老年人群,近年来,随着我国人口老龄化加剧,MM发病率逐年上升。由于在疾病早期其临床表现无特异性,极易出现误诊和漏诊[1-2]。本文通过免疫组化、流式细胞术对传统骨髓细胞形态学诊断的30例MM进行细胞免疫表型分析,并比较3种检测方法之间的差异,以期为MM的早期诊断及疗效判断提供更可靠的检测方法。
1 资料与方法
1.1 一般资料 收集新乡医学院第一附属医院2013年9月至2014年5月MM患者30例,初诊26例,复查4例;其中男17例,女13例,男∶女=1.31∶1;年龄43~78岁,中位年龄64岁。均符合《血液病诊断及疗效标准》的诊断标准[1]。初诊患者均进行骨髓穿刺、血清免疫固定电泳、流式细胞术及影像学等相关检查。
1.2 仪器与试剂 流式细胞仪为BD FACSCalibur,鼠抗人CD38、CD45、CD138、CD19、CD56、胞浆lambda(clambda)、胞浆kappa(ckappa),破膜剂、溶血素,以上试剂均购自美国BD公司。免疫组化一抗用鼠抗人CD138、Kappa轻链、lambda轻链单克隆抗体,抗体购自河南赛诺特生物公司,二抗用Haopoly-HRP鼠/兔通用二抗试剂盒购自上海杰浩生物技术有限公司。细胞形态学检测用瑞氏染液、免疫组化复染用苏木素染液,均由本室配制。
1.3 方法
1.3.1 标本留取 按常规方法行骨髓穿刺,取骨髓液0.2 mL涂片做形态学和免疫组化检测;另抽取2 mL置于肝素抗凝管做流式细胞学检测,调整细胞浓度至1×106/L备用,48 h内完成检验。
1.3.2 骨髓细胞形态学检查 挑选涂片良好的骨髓片行瑞氏染色,显微镜下观察并分类计数200个有核细胞,以浆细胞大于或等于20%并伴形态异常为MM的诊断标准[1]。
1.3.3 免疫组化染色 (1)染色步骤:取新鲜干燥的骨髓涂片,血膜周围用免疫组化笔画圈以避免抗体流失,磷酸盐缓冲液(PBS)浸泡5 min,滴加封闭血清置室温孵育10 min,甩干,分别滴加适量一抗(CD138、Kappa、lambda),37 ℃孵育1 h;PBS冲洗3次,每次5 min;滴加适量二抗,37 ℃孵育30 min;PBS冲洗3次,每次5 min;DAB显色3~10 min,镜下观察,见有明显棕色沉淀为宜,自来水冲洗,苏木素复染,中性树胶封片、镜检。每次试验均进行阴性对照。(2)阳性结果判断:在低倍镜下找寻涂片均匀、薄厚适中、抗原表达明显的部位,高倍镜下细胞膜、胞浆或胞核显示棕黄色均匀细颗粒为阳性表达,CD138、lambda阳性位于胞膜或胞浆,Kappa阳性位于胞浆,阴性为不显色或显色浅淡。油镜下计数200个有核细胞,分别计算各抗体阳性细胞所占比例,以10%以上者为阳性。
1.3.4 流式细胞仪分析 按说明书提供的细胞表面抗原和胞内抗原方法标记,经荧光微球校准仪器及补偿后,用Cell Quest分析软件获取20 000个细胞,对数取样,通过CD45和CD38/SSC设门设定待检细胞群,分析各群细胞抗原表达情况。以目的细胞群抗原表达大于10%为阳性。
1.4 观察指标 所有病例确诊时的年龄、性别、临床表现、血红蛋白(Hb)、清蛋白(ALB)、肌酐(Cr)、血尿素氮(BUN)、血清钙浓度(Ca)、β2微球蛋白(β2-MG)、红细胞沉降率(ESR)、血清及尿液免疫固定电泳、尿本周蛋白(BJP)等各项检查结果逐一记录并进行回顾性分析。
1.5 统计学处理 采用SPSS20.0软件处理,率的比较用χ2检验,均数组间差异用配对样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 形态学检查 26例初诊患者均有不同程度的正色素性贫血及免疫球蛋白增多,其中IgG型19例,IgA型7例。骨髓细胞形态学结果主要为异常浆细胞增生,并伴有质的改变。另外4例复查患者形态学检查均未达到完全缓解。
2.2 免疫组化结果 30例MM患者CD138阳性表达率达到100.0%,22例Kappa阳性,8例lambda阳性(表1)。
2.3 流式细胞检查结果 对目的细胞群抗原CD38、CD138、CD19、CD45、Kappa、lambda进行研究,结果发现,30例MM中CD19阴性表达率100.0%;CD45表达异常(阴性、部分阳性);CD38、CD138阳性表达率均达到100.0%(表1)。
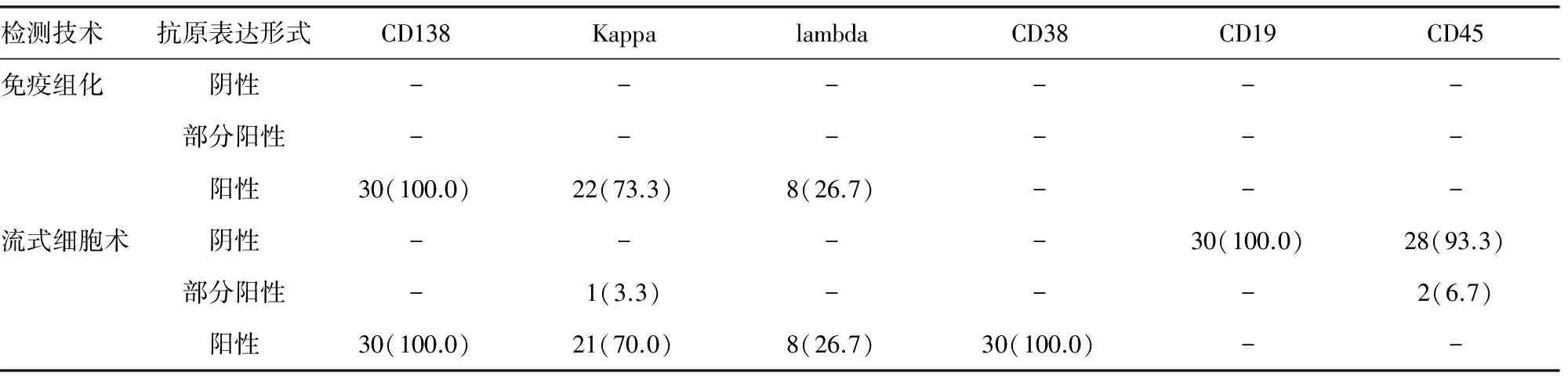
表1 免疫组化和流式细胞术在30例MM异常浆细胞抗原表达形式比较[n(%)]
注:-表示无数据。
2.4 3种检测方法比较 30例MM患者形态学检查骨髓瘤细胞中位数比例为58.00%(6.00%~95.00%),免疫组化检测比例为34.55%(9.00%~88.00%),流式细胞检测比例为35.74%(4.07%~87.42%)。对3种方法检测到的异常细胞群所占比例进行分析,形态学与免疫组化和流式细胞分析测定的异常细胞群比例细胞检查之间差异有统计学意义(P<0.05),免疫组化与流式细胞检查之间差异无统计学意义(P>0.05)。另外形态学与流式细胞术之间有更好的相关性(r=0.957)。
2.5 免疫组化与流式细胞检查诊断敏感性比较 30例MM患者免疫组化结果阳性28例,阳性率为93.3%(28/30),流式细胞检查结果阳性27例,阳性率为90.0%(27/30),两种方法差异无统计学意义(χ2=0.215,P>0.05)。
2.6 轻链限制性检测 30例MM进行流式检测Kappa限制性表达22例,lambda限制性表达8例。
2.7 CD138抗原与实验室检测指标的关系 30例MM患者中CD138的表达与临床实验室检测指标(C反应蛋白、BUN、Ca、ALB、β2-MG,ESR)的改变之间差异无统计学意义(P>0.05)。
3 讨 论
MM在我国发病率约为1/10万,在血液系统肿瘤发病率仅次于恶性淋巴瘤[3]。在实验室检测中,骨髓形态学检测是MM诊断最基础、最普遍的检测手段,在一定程度上可以反映治疗效果。但骨髓瘤细胞常呈灶状分布,临床上为了提高诊断阳性率需要进行多次骨髓穿刺,并且当骨髓稀释时也影响诊断敏感性[4];在鉴别诊断时主观性强,灵敏度低。然而在多数医院对于MM诊断仍以形态学为主,使疾病确诊及疗效判断都受到不同程度的限制。因此,本试验采用免疫组化和流式细胞检查两种免疫检测方法弥补形态学诊断的不足。
免疫组化根据抗原抗体特异性结合的原理可以提高诊断的准确性,鉴别良、恶性疾病,以及判断疾病恶性程度,这点优于传统形态学检测。据报道,CD19在所有B细胞和大多数正常浆细胞均有表达,而在MM中不表达[5-6];CD138在骨髓造血前体细胞和淋巴细胞中无表达,但在MM浆细胞中为阳性,具有相对特异性,便于识别;而CD38在髓系或B淋巴系统前体细胞及成熟淋巴细胞、单核、粒细胞均有不同程度的表达,目前认为CD138是浆细胞最特异的指标[7]。所以本试验免疫组化选择CD138联合Kappa轻链、lambda轻链单克隆抗体作为识别异常浆细胞的标志物。在30例MM患者中,CD138阳性表达率达100.0%,Kappa阳性率为73.3%,lambda阳性率为26.7%,与血清免疫固定电泳结果一致。
近年来,流式细胞检测技术日渐成熟,当骨髓稀释时,流式细胞检查可以等比降低骨髓浆细胞比例,优于形态学检测[8]。在正常骨髓中,现代多参数流式细胞仪可以足够敏感地检测出至少0.01%的非典型浆细胞,也能对单个细胞进行多个抗原检测,同时对细胞表面和胞内抗原进行分析,并且对检测细胞的表达水平可以定量,因此流式细胞检查可以很好地识别并呈现异常浆细胞各种特征[9-10]。通过检测细胞表面抗原表达强弱、胞内免疫球蛋白是否有轻链限制性及异常抗原的出现,可以把正常和异常浆细胞区分开来。正常浆细胞强表达CD38、CD138,表达CD45,大部分细胞表达CD19,不表达B淋巴系抗原CD20、CD22,无轻链限制性。典型MM细胞的免疫表型特点为:异常表达CD56,CD38表达强度稍弱,部分表达CD117、CD33、CD20,不表达CD19,CD45表达弱阳性或阴性,有轻链限制性[11]。本试验中CD138和CD38阳性表达率均为100.0%。CD19均为阴性表达,CD45阴性表达率为93.3%,轻链限制性表达,与上述结论基本一致,但其中有2例骨髓涂片和免疫组化均超过10%。而流式细胞检查未能检出骨髓瘤细胞,对流式细胞检查标本涂片镜检未见瘤细胞,这可能是由于瘤细胞灶性分布,流式细胞检查标本不一定采集到骨髓瘤细胞而漏检;也有可能在采集流式细胞检查标本时由于技术问题混入较多血液所致。
免疫组化和流式细胞检查联合检测的优势在于通过lambda/Kappa轻链限制性表达确定浆细胞是否为单克隆性,从而与反应性浆细胞增多鉴别,这在区分浆细胞良、恶性方面有重要作用,二者敏感性远远高于形态学检测[12]。对于30例MM患者同时进行形态学、免疫组化和流式细胞检查检测得到以下结果:骨髓涂片浆细胞比例与免疫组化、流式细胞检查分析测定的异常细胞群比例差异有统计学意义(P<0.05),且形态学与流式细胞检查之间有更好的相关性(r=0.957),免疫组化与流式细胞术差异无统计学意义。另外对免疫组化和流式细胞检查比较分析,两种方法检测阳性率均较高(分别为93.3%和90.0%),差异无统计学意义(P>0.05),由此说明免疫组化与流式细胞检查对MM确诊都有检测意义,且均有明显的lambda/Kappa轻链限制性表达,阳性表达率一致,有助于鉴别诊断。
流式细胞检查和免疫组化在诊断MM方面就灵敏度而言高于传统的形态学检测,但不能评判骨髓增生程度及肿瘤浸润程度,而且国内外少见这两种方法对MM的诊断标准,导致各实验室检测结果存在差异。可根据患者具体情况,采用三者联合以提高阳性诊断率及疗效监测。期待在不久的将来流式细胞检查技术和免疫组化可以纳入MM常规诊断和评估中。
[1]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:232-235.
[2]杨璐,徐俊荣,顾兵.免疫固定电泳技术对多发性骨髓瘤的分型诊断及预后判断价值[J].检验医学与临床,2011,8(16):1975-1976.
[3]田永芳,贾海英,田洪燕.47例多发性骨髓瘤综合分析[J].临床血液学杂志:输血与检验版,2010,23(4):473-474.
[4]徐晓月.两种不同的骨髓检验方法在多发性骨髓瘤诊疗中的价值[J].检验医学与临床,2013,10(22):2998-2999.
[5]Cho YU,Park CJ,Park SJ,et al.Immunophenotypic characterization and quantification of neoplastic bone marrow plasma cells by multiparametric flow cytometry and its clinical significance in korean myeloma patients[J].J Korean Med Sci,2013,28(4):542-549.
[6]姜永芳,戴海滨,董家蔷,等.多发性骨髓瘤中骨髓瘤细胞免疫表型检测及其意义[J].哈尔滨医科大学学报,2011,45(5):448-450.
[7]郜晓.多发性骨髓瘤免疫表型流式细胞术研究新进展[J].中国实验血液学杂志,2011,19(4):1083-1086.
[8]邢娟娟.30例多发性骨髓瘤的流式细胞分析[J].实用临床医学,2013,14(5):26-27.
[9]de Tute RM,Jack AS,Child JA,et al.A single-tube six-colour flow cytometry screening assay for the detection of minimal residual disease in myeloma[J].Leukemia,2007,21(9):2046-2049.
[10]Rawstron AC,Davies FE,DasGupta R,et al.Flow cytometric disease monitoring in multiple myeloma:the relationship between normal and neoplastic plasma cells predicts outcome after transplantation[J].Blood,2002,100(9):3095-3100.
[11]刘艳荣.实用流式细胞术——血液病篇[M].北京:北京大学医学出版社,2010:189-190.
[12]曹方方,陈芳,胡延平,等.多参数流式细胞术测定多发性骨髓瘤细胞免疫标记的研究[J].中国实验血液学杂志,2012,20(3):620-623.
Application of 3 kinds of experimental techniques in detection of multiple myeloma
LUHan1,WANGZhi-yin2,LIQiang2△
(1.XinxiangMedicalUniversity,Xinxiang,Henan453000,China;2.FirstAffiliatedHospitalofXinxiangMedicalCollege,Xinxiang,Henan453100,China.)
Objective To assess the clinical value of morphology,immunohistochemistry and flow cytometry detection techniques in the diagnosis of multiple myeloma(MM).Methods 30 cases of MM in the First Affiliated Hospital of Xinxiang Medical College from September 2013 to May 2014 were collected for this study.The immunohistochemistry and flow cytometry were adopted to analyze the immunophenotyping of MM cells for investigating the relationship between the expression rates and MM cells morphological characteristics with the related detection indicators.Results In the morphology examination,the proportion of myeloma cells was 6.00%-95.00%,which by using immunohistochemistry was 9.00%-88.00% and which by using flow cytometry was 4.07%-87.42%.There were statistical differences between the morphology and immunohistochemistry and between the morphology and flow cytometry(P<0.05),but there was no statistical difference between immunohistochemistry and flow cytometry(P>0.05).Conclusion The combination of flow cytometry,immunohistochemistry and morphology even more conduces to the diagnosis and prognosis judgment of MM.
multiple myeloma; flow cytometry; immunohistochemistry; morphology; immunophenotype
芦晗,女,在读硕士,主要从事实验血液学研究。△
,E-mail:lq19600@sina.com。
10.3969/j.issn.1672-9455.2015.09.039
A
1672-9455(2015)09-1278-03
2014-11-13
2015-01-17)
