15例儿童炎症性肌纤维母细胞性肿瘤的临床及病理分析
2015-03-15吕孟兴
吕孟兴,高 燕,周 军
(昆明市儿童医院 650028)
·临床研究·
15例儿童炎症性肌纤维母细胞性肿瘤的临床及病理分析
吕孟兴,高 燕,周 军
(昆明市儿童医院 650028)
目的 探讨儿童炎症性肌纤维母细胞性肿瘤(IMT)的临床特点、病理组织学特征及鉴别诊断。方法 回顾性分析2006~2014年15例儿童IMT的临床资料,进行组织形态学分析及免疫表型检测。结果 15例IMT术后随访时间为3~60个月,其中10例无瘤生存,3例术后半年到1年内复发,1例发生恶变。1例失访。免疫组化结果:梭形细胞胞质内波形蛋白、平滑肌肌动蛋白、肌特异性肌动蛋白、结蛋白阳性率分别为100%(15/15)、87%(13/15)、80%(12/15)、47%(7/15);间变型淋巴瘤激酶阳性率为40%(6/15);Ki-67阳性超过15%1例,Ki-67阳性10%2例,Ki-67阳性小于5%12例。CD117、S-100、CD34(内皮细胞标记)、肌调节蛋白、肌浆蛋白、肌红蛋白均为阴性。结论 儿童IMT是具有恶变倾向的间叶性肿瘤,具有一定的复发率。手术彻底切除仍为目前首选的治疗方法,放疗和化疗的作用有待进一步探讨。
炎症性肌纤维母细胞性肿瘤; 儿童; 免疫组织化学; 鉴别诊断
炎症性肌纤维母细胞性肿瘤(IMT)是一种中间性软组织肿瘤,由肌纤维母细胞性梭形细胞和浆细胞、淋巴细胞、嗜酸性粒细胞等炎症细胞构成。同义词有浆细胞肉芽肿、浆细胞假瘤、炎症性肌纤维母细胞性增生、网膜肠系膜性黏液样错构瘤、炎性假瘤。其局部复发、浸润性生长方式及染色体异常的特点,支持这一病变为真性肿瘤。
1 资料与方法
1.1 一般资料 收集昆明市儿童医院2006~2014年明确诊断为IMT的病例15例,其中男8例,女7例。年龄13 d至12岁,平均8岁,中位年龄5岁。发病部位为肺部3例,肠系膜3例,回盲部2例,结肠2例,盆腔2例,肾脏1例,腹膜后1例,头皮1例。
1.2 仪器与试剂 免疫组织化学染色试剂一抗、二抗、DAB显色系统均购自Dako公司。
1.3 方法 标本均经10%中性甲醛固定,石蜡包埋,3 μm厚切片,常规制片。免疫组织化学采用EnVision两步法。
2 结 果
2.1 肿瘤大体情况 15例送检标本最大者为8.5 cm×5.8 cm×4.0 cm,最小者为3.0 cm×2.0 cm×1.2 cm,界限清楚或多结节状,质韧,切面灰白色或灰黄色,呈旋涡状、编织状或黏液样。少数有局灶出血、坏死或钙化。
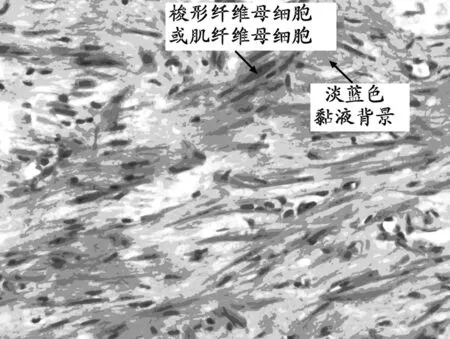
注:瘤细胞梭形或短梭形,稀疏排列,混有炎细胞,背景水肿
性黏液样。
图1 肿瘤细胞HE染色(×400)
2.2 镜下观察 肿瘤细胞均为梭形或短梭形,稀疏或紧密排列,核分裂少见;混有炎症细胞,背景为水肿性黏液样(图1)。部分病例中可见神经节样肌纤维母细胞核大泡状,核仁嗜酸性,细胞质丰富(图2)。部分病例肿瘤胶原化明显,细胞成分少,炎细胞少,可有钙化和骨化,似瘢痕或硬化型纤维瘤病。
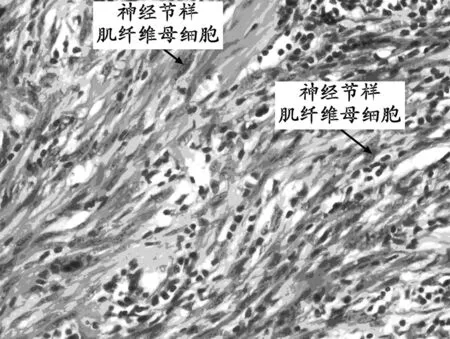
注:神经节样肌纤维母细胞核大泡状,核仁嗜酸性,胞质丰富。
图2 神经节样肌纤维母细胞HE染色(×400)
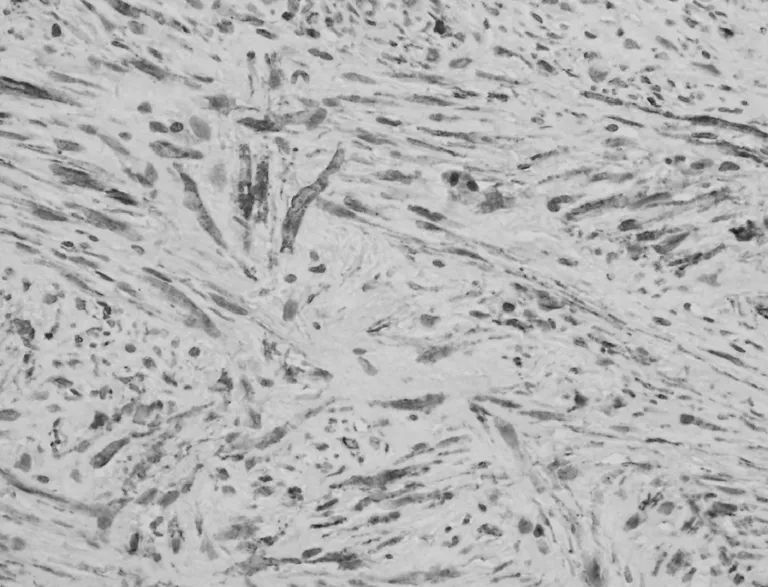
图3 梭形细胞MSA染色呈块状或弥漫的阳性(EnVision两步法,×400)
2.3 免疫表型 梭形细胞胞质内波形蛋白(vimentin)、平滑肌肌动蛋白(SMA)、肌特异性肌动蛋白(MSA)、结蛋白(Desmin)阳性率分别为100%(15/15)、87%(13/15)、80%(12/15)、47%(7/15);间变型淋巴瘤激酶(ALK)阳性率为40%(6/15);Ki-67阳性超过15%1例,Ki-67阳性10% 2例,Ki-67阳性小于5%12例。CD117、S-100、CD34(内皮细胞标记)、MyoD1(肌调节蛋白)、肌浆蛋白(myogenin)、肌红蛋白(myoglobin)均为阴性。
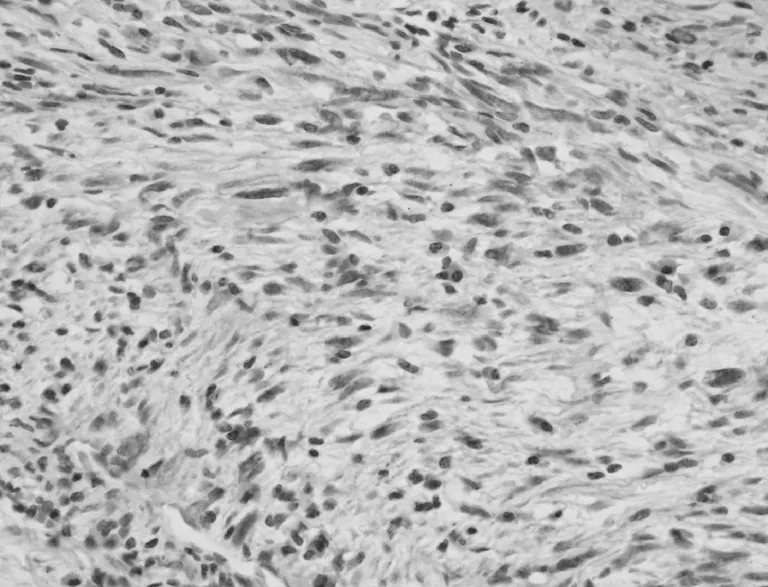
图4 梭形细胞ALK染色阳性表达(EnVision两步法,×400)
2.3 免疫表型 梭形细胞胞质内波形蛋白(vimentin)、平滑肌肌动蛋白(SMA)、肌特异性肌动蛋白(MSA)、结蛋白(Desmin)阳性率分别为100%(15/15)、87%(13/15)、80%(12/15)、47%(7/15);间变型淋巴瘤激酶(ALK)阳性率为40%(6/15);Ki-67阳性超过15%1例,Ki-67阳性10%2例,Ki-67阳性小于5%12例。CD117、S-100、CD34(内皮细胞标记)、MyoD1(肌调节蛋白)、肌浆蛋白(myogenin)、肌红蛋白(myoglobin)均为阴性。
2.4 随访 14例获得随访资料,随访时间3~60个月。其中10例恢复良好,无复发转移,肿瘤位于肺、肾、结肠及肠系膜。3例术后半年到1年内复发,肿瘤位于回盲部、腹膜后。1例发生恶变,肿瘤位于盆腔。1例失访。
3 讨 论
IMT最早由Brunn等于1939年报道了2例肺梭形细胞良性肿瘤,认为是一种炎症性瘤样病变。Umiker等在1954年提出肺内的这种梭形细胞增生是炎症后肿瘤(post inflammatory tumors)的观点。不久炎症后肿瘤这一名称逐渐过渡成为易于理解和广泛应用的名称“炎性假瘤”。最近,WHO软组织肿瘤分类中将其归为纤维母细胞/肌纤维母细胞肿瘤、中间性、偶有转移型。将IMT定义为由分化的肌纤维母细胞性梭形细胞组成的,常伴大量浆细胞和(或)淋巴细胞的一种肿瘤。IMT是一种少见的间叶性肿瘤,其病因与发病机制目前尚不清楚,部分病例发生在手术、创伤或炎性反应以后,提示IMT可能是人体对损伤的一种异常或过度的反应。有文献报道1例病例起病前曾行患侧附耳切除手术,术后反复感染经久不愈,推测创伤等原因引起的炎症反应刺激与IMT发生关系密切[1]。IMT多发生于儿童及年轻人,平均年龄10岁,中位数为9岁。最常发生的部位是肺部[2],肺外的部位包括肠系膜、大网膜、腹膜后、膀胱、中枢神经系统、软组织、胃肠道、肝、肾、脾、胰等[3-5]。发生部位广泛,在不同的部位表现多样,肺部IMT以反复呼吸道感染、咳嗽、发热,常以支气管肺炎入院,腹腔内IMT可出现腹痛、腹胀,腹部包块等。膀胱内IMT多以血尿为主要症状。发生于回肠的IMT可引起回结型肠套。
3.1 诊断与鉴别诊断 IMT临床及影像学缺乏特异性表现,确诊依赖病理学。IMT光镜下主要由增生的肌纤维母细胞、纤维母细胞、胶原纤维和炎性细胞组成。纤维母细胞/肌纤维母细胞大部分呈梭形或短梭形,胞质嗜酸性,核卵圆形,居中,可见核仁,轻度异型性,核分裂象少。Coffin等[6]提出3种组织学类型:(1)黏液样/血管型。以黏液、血管、炎症细胞为主,可类似结节性筋膜炎和横纹肌肉瘤。(2)梭形细胞密集型。以梭形细胞为主,间杂炎细胞,类似纤维组织细胞瘤。(3)纤维型。以胶原纤维为主类似瘢痕或硬化性纤维瘤少部分出现点状或大片状的钙化和化生骨。本组病例中以梭形细胞密集型多见,为12例,黏液血管型2例,纤维型1例。IMT在病理形态上应与一些良、恶性的梭形细胞肿瘤病变进行鉴别,常见的鉴别诊断如下:
3.1.1 结节性筋膜炎 多发生于皮下或浅筋膜的结节状肌纤维母细胞性增生,细胞为梭形,呈不规则的短束状或交织状排列,间质疏松,黏液样,可见外渗的红细胞和散在的淋巴细胞,部分病例可见微囊性腔隙,通常不见浆细胞。ALK阴性。
3.1.2 炎症性恶性纤维组织细胞瘤 多发生于成年人,肿瘤细胞呈多形性,异型性明显,有多量的黄色瘤细胞核炎症细胞,核分裂活跃,可见病理性核分裂象。免疫组织化学不表达肌源性标记。
3.1.3 平滑肌肉瘤 多发生于中老年患者,绝大多数病例发生于盆腔腹膜后或腹腔,肿瘤细胞主要由平行束状或交织束状排列的嗜伊红色梭形细胞组成。核两端平钝或呈雪茄样,部分瘤细胞核的一端见空泡,常形成凹陷性压迹。病理性核分裂像多见,一般无炎性细胞弥漫浸润。70%~80%病例表达结蛋白。
3.1.4 纤维瘤病 多发生于新生儿和婴幼儿,有明显的区带现象,由淡染的周边区和深染的中心区组成,瘤细胞为结节状或短束状排列的胖梭形纤维母细胞组成,其间有数量不等的胶原纤维。少见炎细胞浸润。
3.1.5 胃肠道、网膜及腹膜后间质瘤 好发于40~70岁,较少发生于儿童和青少年。肿瘤细胞呈梭形或短梭形,多呈交织的短条束状或漩涡状排列,部分病例核端可见空泡或呈两端平钝的雪茄样。一般无炎细胞弥漫浸润。CD117和CD34阳性。
3.2 治疗与预后 目前治疗IMT的方法有根治性切除、激素治疗、放疗和化疗。大部分病例预后较好,部分IMT有复发和远处转移,少数还可发生恶变。肺外IMT复发率约为20%~25%,转移率小于5%[7]。最常见转移部位是肺和脑,其次是肝和骨。转移最常发生于诊断后1年内,偶有发生于手术切除后9年的报道,术后长期随访很重要[8]。有文献报道对于IMT放化疗效果不明确,但对于侵袭性强的IMT推荐辅助放化疗[9]。目前,酪氨酸酶抑制剂(erizotinib)用于ALK阳性的IMT患者有个别报道,并取得了一定的效果。ALK成为潜在的分子治疗靶点,受体酪氨酸激酶抑制剂靶向治疗对多次复发或因发生部位无法完全手术切除的患者提供了新的选择[10]。Ong等[11]提出Ki-67和ALK阳性表达、肿瘤切缘阳性及肿瘤大小与预后和局部复发关系密切,尤其是Ki-67和ALK阳性同时存在时,术后应给予化疗或局部放疗。鉴于IMT有复发、转移甚至恶变的可能,有必要进行长期追踪随访。
[1]刘艳丽,刘良发.头颈部炎性肌纤维母细胞瘤临床分析[J].中华耳鼻咽喉头颈外科杂志,2014,49(1):35-38.
[2]Guan Y,Chen G,Zhang W,et al.Com-puted tomography appear ance of inflammatory myofibroblastic tumor in the mediastinum[J].J Comput Assist Tomogr,2012,36 (6):654-658.
[3]Whitehead MT,Grimm J,Nelson MD.Case 185:inflammatory myofibroblastic tumor[J].Radiology,2012,264(3):912-916.
[4]Jeon YK,Chang KH,Suh YL,et al.Inflammatory myofibroblastic tumor of the central nervous system:clinicopathologic analysis of 10cases[J].J Neuropathol Exp Neurol,2005,64(3):254-259.
[5]Meng X,Wang R.Inflammatory myofibroblastic tumor oreurs in the mediastinum[J].J Cancer Res Ther,2013,9(4):721-723.
[6]Coffin CM,Watterson J,Priest JR,et al.Extrapulmonary inflame matory myofibroblastic tumor inflammatory pseudotumor.A clinicopathologic and immunohistochemical study of 84 cases[J].Am J Surg Pathol,1995,19(8):859-872.
[7]Stelow EB,Shami VM,Moskaluk CA,et al.Esophageal inflammarory myofibroblastic tumor sampled by EUS-FNA[J].Gastrointestinal Endoscopy,2010,72(1):209-210.
[8]Yeh YS,Ma CJ,Yang SF,et al.Inflammatory myofibroblastic tumor of the lleum causing an unusual Ileocecal intussusception[J].Fooyin J Health Sci,2010,2(1):36-39.
[9]Coffin CM,Hornick JL,Fletcher CD.Inflammarory myofibroblastin tumor:comparison of clinicopatholgic,histologic,and immohistochemical features including ALK expression in atypical and aggressive cases[J].Am J Surg Pathol,2007,31(4):509-520.
[10]Butrynski JE,D′Adamo DR,Hornick JL,et al.Crizotinib in ALK-rearranged inflammatory myofibroblastic tumor[J].N Engl J Med,2010,363(18):1727-1733.
[11]Ong HS,Ji T,Zhang CP,et al.Head and neck inflammatory myofibroblastic tumor(IMT):evaluation of clinicopathologic and prognostic features[J].Oral Oncotogy,2012,48(2):141-148.
10.3969/j.issn.1672-9455.2015.02.036
A
1672-9455(2015)02-0223-02
2014-06-09
2014-11-09)
