习惯性流产患者绒毛和蜕膜中Treg/Th17免疫失衡的检测及其临床意义*
2015-03-15杨小猛杜丽伟唐琼玲蒋淑萍陈书恩姜艳华深圳市罗湖区妇幼保健院检验科5809深圳市罗湖区慢性病防治院检验科580深圳市罗湖区妇幼保健院妇产科5809
杨小猛,赵 丹,杜丽伟,唐琼玲,蒋淑萍,陈 相,陈书恩,姜艳华(.深圳市罗湖区妇幼 保健院检验科 5809;.深圳市罗湖区慢性病防治院检验科 580;.深圳市罗湖区妇幼保健院妇产科 5809)
·论 著·
习惯性流产患者绒毛和蜕膜中Treg/Th17免疫失衡的检测及其临床意义*
杨小猛1,赵 丹2,杜丽伟1,唐琼玲1,蒋淑萍1,陈 相1,陈书恩1,姜艳华3(1.深圳市罗湖区妇幼 保健院检验科 518019;2.深圳市罗湖区慢性病防治院检验科 518023;3.深圳市罗湖区妇幼保健院妇产科 518019)
目的 探讨绒毛和蜕膜中调节性T细胞(Treg)/Th17免疫失衡在习惯性流产(RSA)患者免疫发病机制中的作用。方法 收集RSA患者和自愿终止妊娠的早孕妇女(正常对照组)的绒毛和蜕膜,采用流式细胞术检测其中Treg和Th17细胞数量,采用RT-PCR检测其中叉头翼状螺旋转录因子(Foxp3)和维甲酸相关核孤儿受体γt(RORγt)的mRNA水平;收集RSA患者和正常对照组的外周血,采用酶联免疫吸附试验(ELISA)检测其中转化生长因子-β(TGF-β)、白细胞介素(IL)-10、IL-17A和IL-17F的水平;统计分析Treg细胞和其相关细胞因子、Th17细胞和其相关细胞因子之间的相关性。结果 和正常对照组比较,RSA患者绒毛和蜕膜中Th17细胞明显增多(均P<0.01),Treg细胞明显减少(均P<0.01),RORγt的mRNA水平明显升高(均P<0.01),Foxp3的mRNA水平明显降低(均P<0.01);RSA患者外周血中IL-17A和IL-17F水平明显升高(均P<0.01),TGF-β和IL-10水平明显降低(均P<0.01);RSA患者和正常对照组Treg细胞数量和TGF-β及IL-10水平、Th17细胞数量和IL-17A及IL-17F水平均呈正相关(均P<0.01)。结论 绒毛和蜕膜中Treg/Th17免疫失衡可能与RSA的免疫发病机制有关。
习惯性流产; Treg/Th17平衡; 转化生长因子-β; 白细胞介素-10; 白细胞介素-17A; 白细胞介素-17F
习惯性流产(RSA)是一种由母胎免疫耐受失衡引起的疾病,育龄妇女中发病率约为1%~5%。RSA的病因十分复杂,一般认为与遗传、解剖结构、内分泌、免疫、感染和环境因素等有关;除此之外尚有50%~60%的患者病因不明[1]。近年来研究发现,CD4+CD25+调节性T细胞(Treg)和Th17细胞是不同于Th1和Th2的CD4+T细胞亚群。Treg细胞表达叉头翼状螺旋转录因子(Foxp3),是一种下调免疫应答的细胞,可通过接触抑制或分泌白细胞介素(IL)-10和转化生长因子-β(TGF-β)发挥维持自身免疫耐受和抗炎的功能;Th17细胞表达维甲酸相关核孤儿受体γt(RORγt),主要分泌IL-17A和IL-17F,可能在自身免疫性疾病、炎症和肿瘤等多种免疫性疾病中起重要作用[2]。Treg/Th17平衡失调与多种疾病有关[3],而其与RSA的关系尚不明了[4]。因此,本研究将检测RSA患者绒毛和蜕膜中Treg和Th17细胞数量、Foxp3和RORγt的mRNA水平,以及RSA患者外周血中TGF-β、IL-10、IL-17A和IL-17F等细胞因子水平,探讨绒毛和蜕膜中Treg/Th17数量和功能平衡与RSA的关系。
1 资料与方法
1.1 一般资料 RSA患者(孕周为8~10周)30例,年龄为22~38岁,平均32岁,其诊断标准参照文献[5]。30例自愿终止妊娠的早孕妇女(孕周为8~10周)为正常对照组,年龄为23~38岁,平均31岁。两组患者均为2013年9月至2014年5月在深圳市罗湖区妇幼保健院妇产科门诊就诊患者。正常对照组妇女无不良妊娠史,无遗传、解剖结构和内分泌异常,无自身免疫性疾病史。两组研究对象年龄和孕周差异无统计学意义(P>0.05),具有可比性,所有入选对象均签订知情同意书。
1.2 仪器与试剂 RPMI-1640培养液为美国Gibco公司产品,TRIzol试剂盒、随机引物和RNaseH反转录试剂盒为美国Invitrogen公司产品,佛波脂和离子霉素为美国Sigma公司产品,固定破膜液为美国BD公司产品,细胞因子ELISA试剂盒、PE标记的抗IL-17A单抗、PE-Cy5标记的抗Foxp3单抗、PE标记的小鼠IgG1和PE-Cy5标记的小鼠IgG1均为美国eBioscience公司产品,SYBR Premix Taq试剂盒购自大连TaKaRa公司,淋巴细胞分离液购自深圳达科为公司。Coulter EPICS-XL型流式细胞仪为美国贝克曼库尔特公司产品,ABI7300型荧光定量PCR仪为美国ABI公司产品,MK3型酶标仪为美国赛默飞世尔产品。
1.3 方法
1.3.1 绒毛和蜕膜单个核细胞制备 收集所有入选对象的绒毛和蜕膜,用磷酸缓冲盐溶液(PBS)冲洗去除黏液和血液。无菌条件下剪碎组织,加入0.25%的胰酶-EDTA(pH8.0)于37 ℃消化1 h,获得细胞悬液。细胞悬液中加入淋巴细胞分离液于500×g离心30 min获得绒毛单个核细胞和蜕膜单个核细胞,并用PBS洗两遍。为测定Th17细胞,将上述单个核细胞重悬于RPMI-1640培养液中(含100 U/mL青霉素、100 μg/mL链霉素、2 mmol/L谷氨酸和10%热灭活的胎牛血清),调整细胞浓度约为1×106/mL。加入50 ng/mL佛波脂、1 μmol/L离子霉素和1 μL/mL莫能霉素,于37 ℃、5% CO2环境中培养4 h,备用。为测定Treg细胞,将上述单个核细胞悬液直接备用。
1.3.2 流式细胞术检测绒毛和蜕膜中Treg和Th17细胞数量 佛波脂和离子霉素下调T细胞表面CD4分子的表达,因此本实验以CD3+CD8-IL-17+细胞定义Th17细胞;而Treg细胞被定义为CD4+CD25+Foxp3+细胞。按试剂盒步骤对Th17和Treg细胞进行荧光抗体染色,孵育完成后上流式细胞仪检测,结果以阳性细胞所占百分比表示。
1.3.3 实时荧光定量PCR检测绒毛和蜕膜中RORγt和Foxp3的mRNA水平 收集所有入选对象的绒毛和蜕膜,用PBS冲洗去除黏液和血液。无菌条件下剪碎组织,加入0.25%的胰酶-EDTA(pH8.0)于37 ℃消化1 h,参照TRIzol试剂盒说明书方法抽提总RNA,并采用随机引物和RNase H反转录试剂盒生成cDNA,然后采用SYBR Premix Taq试剂盒在荧光定量PCR仪上完成扩增检测。引物序列为Foxp3,F:5′-TCT TCC TTG AAC CCC ATG CC-3′,R:5′-AAA TGT GGC CTG TCC TGG AG-3′;RORγt,F:5′-GAG CCA AGG CTC AGT CAT GAG AA-3′,R:5′-GTC CCT CTG CTT CTT GGA CAT-3′。以上所有实验均设置复孔检测。mRNA定量采用相对Ct法[6],看家基因GAPDH用作标准化,无模板标本用作无模板对照,目的基因定量公式为2-ΔCt= Power(2,-(Ct目的基因-CtGAPDH))。
1.3.4 ELISA检测外周血细胞因子水平 收集所有入选对象外周静脉血,800×g离心10 min分离血清备用。采用商品化的ELISA试剂盒测定血清中IL-17A、IL-17F、 TGF-β和IL-10的水平。以上所有实验均设置复孔检测。
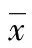
2 结 果
2.1 RSA患者绒毛和蜕膜中Treg和Th17细胞数量 RSA患者绒毛和蜕膜中Treg细胞数量均分别低于正常对照组(t=7.499,P<0.01;t=6.701,P<0.01);RSA患者绒毛和蜕膜中Th17细胞数量均分别高于正常对照组(t=7.994,P<0.01;t=8.694,P<0.01);RSA患者绒毛和蜕膜中Treg/Th17比值均分别低于正常对照组(t=10.030,P<0.01;t=11.122,P<0.01),见表1。
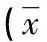
表1 RSA患者和正常对照组绒毛和蜕膜中Treg和Th17细胞数量比较±s)
2.2 RSA患者绒毛和蜕膜中RORγt和Foxp3的mRNA水平 RSA患者绒毛和蜕膜中Foxp3表达均明显低于正常对照组(t=14.132,P<0.01;t=14.411,P<0.01),而RORγt表达均明显高于正常对照组(t=14.132,P<0.01;t=12.377,P<0.01)。其中RSA患者绒毛中RORγt表达是正常对照组的2.5倍(5.7/2.3),蜕膜中RORγt表达是正常对照组的3.0倍(17.1/5.7);绒毛中Foxp3表达是正常对照组的0.2倍(2.1/10.5),蜕膜中Foxp3表达是正常对照组的0.2倍(1.5/7.5),见表2。
2.3 RSA患者外周血中Treg和Th17相关细胞因子水平 RSA患者外周血中Treg细胞相关细胞因子TGF-β和IL-10水平均明显低于正常对照组(t=10.691,P<0.01;t=13.182,P<0.01),而Th17相关细胞因子IL-17A和IL-17F水平均明显高于正常对照组(t=12.030,P<0.01;t=11.601,P<0.01),见表3。

表2 RSA患者和正常对照组绒毛和蜕膜中RORγt和Foxp3的mRNA水平比较

表3 RSA患者和正常对照组外周血Treg和Th17相关细胞因子比较
2.4 RSA患者和正常对照组绒毛和蜕膜中Treg、Th17细胞数量与外周血相关细胞因子的关系 RSA患者和正常对照组绒毛中Treg数量与外周血TGF-β、IL-10水平呈正相关(r=0.966,P<0.01;r=0.961,P<0.01),蜕膜中Treg数量与外周血TGF-β、IL-10水平也呈正相关(r=0.955,P<0.01;r=0.952,P<0.01);RSA患者和正常对照组绒毛中Th17数量与外周血IL-17A、IL-17F水平呈正相关(r=0.961,P<0.01;r=0.953,P<0.01),蜕膜中Th17数量与外周血IL-17A、IL-17F水平也呈正相关(r=0.967,P<0.01;r=0.972,P<0.01)。
3 讨 论
RSA是目前难治性不育中急需解决的问题,一般认为与染色体异常、内分泌失调、生殖结构畸形和感染有关;此外尚约有60%~70%患者原因不明,研究发现RSA患者体内免疫失衡可能是重要原因之一。Treg和Th17细胞是近年来新发现的不同于Th1、Th2的CD4阳性T细胞亚群,Treg细胞是一种下调免疫应答的细胞,表达Foxp3并通过接触抑制或分泌IL-10和TGF-β等细胞因子发挥维持自身免疫耐受和抗炎的功能;Th17细胞表达RORγt,主要分泌IL-17A和IL-17F,可能在自身免疫性疾病、炎症和肿瘤等多种免疫性疾病中起重要作用[2]。研究表明,Treg/Th17平衡失调与多种疾病有关[3],而其与RSA的关系目前尚不清楚。
正常的母胎免疫耐受是成功的妊娠过程的有力保证,正常孕妇的母胎免疫耐受既能抵抗微生物感染又不排斥表达半同种异体父系抗原的胚胎或胎儿[7]。Treg细胞是一群独特的CD4+T细胞亚群,具有免疫抑制功能,介导体内的免疫抑制效应,是维持免疫耐受和控制免疫应答的重要细胞。Treg细胞数量降低与机体受损的免疫内环境稳定和自身免疫性疾病的发生有关[8]。正常妊娠的小鼠和人类Treg细胞数量明显增多,在母体免疫细胞首次接触胎儿抗原是起关键的保护作用。Treg细胞增殖不足的小鼠有流产倾向,而正常妊娠小鼠的Treg细胞的增殖能力较高;有流产倾向的小鼠经过继免疫来自正常妊娠小鼠的Treg细胞能够阻止自发流产的发生[9]。本研究发现,RSA患者绒毛和蜕膜中Treg细胞数量和Foxp3的mRNA水平均低于正常对照组,其外周血中TGF-β和 IL-10水平也均低于正常对照组;同时,RSA患者和正常对照组的绒毛和蜕膜中Treg细胞数量与外周血中TGF-β和 IL-10水平呈正比。活化的Treg细胞能分泌包括TGF-β和 IL-10等大量的免疫抑制因子,而TGF-β和 IL-10参与调节Treg细胞的数量和功能,TGF-β是维持Treg细胞数量和功能的关键因子,IL-10能诱导Treg细胞的产生[10]。因此,本研究结果提示,RSA患者绒毛和蜕膜中Treg细胞数量减低和功能缺陷减弱了患者的免疫抑制功能,并与自发性流产的发生密切相关。
Th17细胞是另一群不同于Th1、Th2和Treg细胞的CD4+T细胞,分泌IL-17A、IL-17F、 IL-22和IL-26等细胞因子,原始CD4+T细胞在TGF-β、IL-6、IL-23和IL-1的作用下分化为Th17细胞[11]。Th17细胞可能在自身免疫性疾病、炎症和肿瘤等多种免疫性疾病中起重要作用[12]。本研究发现,RSA患者绒毛和蜕膜中Th17细胞数量和RORγt的mRNA水平均高于正常对照组,其外周血中IL-17A和 IL-17F水平也均高于正常对照组;同时,RSA患者和正常对照组的绒毛和蜕膜中Th17细胞数量与外周血中IL-17A和 IL-17F水平呈正比。IL-17通过介导中性粒细胞浸润,激活IL-1、IL-6、IL-8、TNF-α、NO、基质金属蛋白酶、NF-κB配体的受体活化剂和粒细胞巨噬细胞集落刺激因子而引发炎症反应[13]。因此,本研究结果提示,RSA患者绒毛和蜕膜中Th17细胞数量增多和过度的功能活化增强了患者的炎症反应,并与自发性流产的发生密切相关。
近年来Treg/Th17平衡与妊娠的关系受到广泛重视,研究发现RSA患者外周血和蜕膜中Treg细胞明显减少[14],作者前期研究也证实RSA患者外周血Treg细胞数量低下且免疫下调性细胞因子TGF-β和IL-10水平降低[15]。本研究发现,RSA患者绒毛和蜕膜中Treg/Th17比值明显低于正常对照组。Th17和Treg细胞来自同样的前体细胞,原始CD4+T细胞在TGF-β和IL-6刺激下分化为Th17细胞而在TGF-β刺激下分化为Treg细胞;同时Treg细胞转录因子Foxp3和Th17细胞转录因子RORγt能够相互抑制对方的功能。因此,本研究结果提示,Treg/Th17平衡失调与自发性流产的发生有关。
总之,本研究结果表明绒毛和蜕膜中Treg/Th17数量和功能平衡在维持正常妊娠中发挥重要作用,绒毛和蜕膜中Treg/Th17数量和功能失衡可能参与RSA免疫发病机制。探讨绒毛和蜕膜中Treg/Th17细胞数量和功能平衡与RSA发病机制的关系,将可能为诊断和治疗RSA的治疗提供理论和实验依据。
[1]Bubanovic IV.Induction of thymic tolerance as possibility in prevention of recurrent spontaneous abortion[J].Med Hypotheses,2003,60(4):520-524.
[2]Peiser M.Role of Th17 cells in skin inflammation of allergic contact dermatitis[J].Clin Dev Immunol,2013,2013:261037-261039.
[3]Galati D,De Martino M,Trotta A,et al.Peripheral depletion of NK cells and imbalance of the Treg/Th17 axis in idiopathic pulmonary fibrosis patients[J].Cytokine,2014,66(2):119-126.
[4]Wang WJ,Liu FJ,Qu HM,et al.Regulation of the expression of Th17 cells and regulatory T cells by IL-27 in patients with unexplained early recurrent miscarriage[J].J Reprod Immunol,2013,99(1/2):39-45.
[5]Lin QD,Qiu LH.Pathogenesis,diagnosis,and treatment of recurrent spontaneous abortion with immune type[J].Front Med China,2010,4(3):275-279.
[6]Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T) method[J].Nat Protoc,2008,3(6):1101-1108.
[7]Gobert M,Lafaille JJ.Maternal-fetal immune tolerance,block by block[J].Cell,2012,150(1):7-9.
[8]Sakaguchi S,Yamaguchi T,Nomura T,et al.Regulatory T cells and immune tolerance[J].Cell,2008,133(5):775-787.
[9]Yin Y,Han X,Shi Q,et al.Adoptive transfer of CD4+CD25+regulatory T cells for prevention and treatment of spontaneous abortion[J].Eur J Obstet Gynecol Reprod Biol,2012,161(2):177-181.
[10]Wang BL,Su H,Chen Y,et al.A role for trichosanthin in the expansion of CD4CD25 regulatory T cells[J].Scand J Immunol,2010,71(4):258-266.
[11]Yang L,Anderson DE,Baecher-Allan C,et al.IL-21 and TGF-beta are required for differentiation of human T(H) 17 cells[J].Nature,2008,454(7202):350-352.
[12]Qi W,Huang X,Wang J.Correlation between Th17 cells and tumor microenvironment[J].Cell Immunol,2013,285(1/2):18-22.
[13]Zhao L,Tang Y,You Z,et al.Interleukin-17 contributes to the pathogenesis of autoimmune hepatitis through inducing hepatic interleukin-6 expression[J].PLoS One,2011, 6(4):e18909.
[14]Wang WJ,Hao CF,Yi L,et al.Increased prevalence of T helper 17(Th17) cells in peripheral blood and decidua in unexplained recurrent spontaneous abortion patients[J].J Reprod Immunol,2010,84(2):164-170.
[15]杨小猛,赵丹,陈书恩,等.CD4+CD25+Treg 细胞、TGF-β和IL-10在反复自然流产中的变化[J].医药论坛杂志,2011,32(12):19-21.
Immune unbalance detection of Treg / Th17 in villus and deciduas in patients with habitual abortion and its clinical significance*
YANGXiao-meng1,ZHAODan2,DULi-wei1,TANGQiong-ling1,JIANGShu-ping1,CHENXiang1,CHENShu-en1,JIANGYan-hua3
(1.DepartmentofClinicalLaboratory,LuohuDistrictMaternalandChildHealthCareHospital,Shenzhen,Guangdong518019,China; 2.DepartmentofClinicalLaboratory,LuohuDistrictChronicDiseasePreventionandCureHospital,Shenzhen,Guangdong518023,China; 3.DepartmentofGynaecologyandObstetrics,LuohuDistrictMaternalandChildHealthCareHospital,Shenzhen,Guangdong518019,China)
Objective To investigate the role of immune unbalance of Treg/Th17 in villus and decidua on the immunopathogenesis in recurrent spontaneous abortion(RSA).Methods The villus and decidua specimens were collected from the patients with RSA and early pregnancy women of voluntarily terminating pregnancy(normal control group).The Treg/Th17 cell count was detected by the flow cytometry.The RT-PCR method was adopted to detect the mRNA levels of RORγt and Foxp3 in villus and decidua.The levels of peripheral blood IL-17A,IL-17F,TGF-β and IL-10 in the two groups were detected by ELISA.Finally,the correlations between Treg cells with the related cytokines and between Th17 cells with the related cytokines were statistically analyzed.Results Compared with the normal control group,the Th17 cells in villus and decidua in the patients with RSA were significantly increased(P<0.01),while the Treg cells were significantly decreased(P<0.01),the mRNA level of RORγt was significantly increased(P<0.01) and the mRNA level of Foxp3 was significantly decreased(P<0.01); the peripheral blood IL-17A and IL-17F levels in the RSA patients were significantly increased(P<0.01) and the TGF-β and IL-10 levels were significantly decreased(P<0.01).The Treg cells quantity was positively correlated with the peripheral blood TGF-β and IL-10 levels and the Th17 cells quantity was positively correlated with peripheral blood IL-17A and IL-17F levels in the RSA patients and the normal control group(P<0.01).Conclusion The imbalance of Treg/Th17 in villus and decidua may be related with the immunopathogenesis of RSA.
Recurrent spontaneous abortion; Balance of Treg/Th17; TGF-β; IL-10; IL-17A; IL-17F
广东省深圳市科技计划项目(医疗卫生类)(201203194)。
杨小猛,男,副主任技师,博士,主要从事分子免疫学和生殖免疫学基础研究工作。
10.3969/j.issn.1672-9455.2015.01.009
A
1672-9455(2015)01-0022-04
2014-05-03
2014-09-21)
