茶树萜烯类香气物质合成相关酶研究进展
2015-03-15张冬桃孙君叶乃兴陈桂信
张冬桃,孙君,叶乃兴*,陈桂信
茶树萜烯类香气物质合成相关酶研究进展
张冬桃1,孙君2,叶乃兴1*,陈桂信1
(1.福建农林大学园艺学院/茶学福建省高等学校重点实验室,福建 福州 350002;2.福建省农业科学院茶叶研究所,福建 福安 355015)
萜烯类化合物与茶叶香气品质密切相关,茶叶中橙花醇、芳樟醇、橙花叔醇、α-法尼醇、α-紫罗兰酮、茶螺烯酮、石竹烯、古巴烯、柏木醇等萜烯类香气物质通过MVA途径(甲羟戊酸途径)和MEP途径(2-C-甲基-D-藓糖醇-4-磷酸途径)合成,调节机制复杂,在很大程度上影响茶叶的品质。本文综述了茶叶萜烯类香气物质合成途径中相关酶的研究进展,探讨该代谢途径未来的重点研究方向。
茶叶香气;萜烯类化合物;代谢途径;酶
茶叶香气是评价茶叶品质优劣的重要指标之一,也是吸引消费者和提高市场竞争力的重要因子。随着国内外茶叶市场竞争愈演愈烈,对茶叶品质要求愈来愈高,茶叶香气的研究日益受到关注。近年来,随着香气挥发物提取和检测技术以及分子生物学、生物化学、生物信息学等学科的发展,多种技术相结合使得香气物质代谢研究渐渐深入,与茶叶香气物质合成密切相关的萜烯类化合物代谢的研究取得了较大进展,基本明确了萜烯类化合物的主要代谢途径、中间产物、关键酶及其基因,许多关键代谢酶基因序列已经得到克隆和分析[1],为今后深入研究茶叶香气形成机理奠定基础。至今,关于茶叶中萜烯类化合物合成途径中相关酶基因的综述报道较少,本文对茶叶萜烯类化合物合成途径及该途径中相关酶基因的研究现状进行了综述,对深入研究茶叶香气形成分子机制,特别是研究萜烯类化合物代谢分子机制提供一定参考。
1 茶叶香气物质研究现状
目前,已通过各种现代分析仪器从茶叶中鉴定出700多种香气成分,包含醇类、醛类、酮类、酯类、酚类、含氮化合物以及氧杂化合物等10余大类。茶叶香气物质按化学结构划分,可分为萜烯类及其衍生物、脂肪族类及其衍生物,芳香族衍生物,含氮、氧等杂环类及其他化合物[2]。
茶叶香气成分数百种,但决定茶叶香气的特征成分较固定,保护好这些特征成分可提高茶叶的香气品质[3]。国内外学者对影响茶叶香气的因素进行了大量研究,发现茶树品种、栽培措施、环境条件、加工工艺、贮藏条件等因素都对茶叶香气产生影响,特别是茶叶香气前体物质含量、香气物质间的转化及组成比例和相关代谢酶活性变化情况[4]。
1.1 茶叶香气合成途径
茶叶香气在很大程度上由芳樟醇、香叶醇、橙花醇、香草醇等单萜烯醇类化合物和苯甲醇、苯乙醇、水杨酸甲酯等芳香族化合物以及青叶醇等不饱和脂肪族化合物决定。茶叶香气形成途径主要有以下4条[5]:(1)儿茶素氧化作用及类胡萝卜素氧化降解作用,儿茶素偶联氧化形成邻醌,邻醌氧化氨基酸、醇、醛、类胡萝卜素等形成多种香气成分以及类胡萝卜素氧化降解形成茶螺烯酮、紫罗兰酮系等香气物质;(2)脂肪酸过氧化及降解作用,脂肪酸过氧化降解生成青叶醇、己烯醛等不饱和脂肪族醇、醛类化合物;(3)氨基酸的脱氨脱羧和美拉德反应,氨基酸脱氨脱羧后形成相应醛,以及与糖类等发生美拉德反应,生成具有焦糖香气的物质;(4)糖苷水解途径,糖苷类香气前驱体在糖苷类酶的作用下水解生成相应的醇类[6]。其中,醇类香气的糖苷水解途径备受关注,研究发现[7-8]香气前体化合物在茶鲜叶中是以单糖苷或双糖苷形式存在,其中25%香气前体物质以β-葡萄糖苷形式存在。
1.2 茶叶加工对茶叶香气物质形成的影响
茶叶香气是茶叶加工过程中受到热学、物理学、化学作用,叶细胞内部发生复杂的生理生化反应形成的。茶叶加工对于茶叶香气的影响极其重要,不同茶类加工工艺不同,酶促氧化程度不同,香型特征不同,香气化合物也不同。
绿茶加工工艺不同,形成清香、栗香、豆香、花香等不同香型特征。炒青绿茶杀青时间长,经热物理化学作用,萜烯类物质种类增加含量提高,苯甲醇、香叶醇等高沸点香气成分得以保留,多呈栗香或清香或豆香;蒸青绿茶杀青时间短,低沸点香气成分含量较高,带清香或花香[9]。烘青绿茶受热作用比炒青绿茶小,清香显,以二氢海葵内酯,石竹烯,雪松烯,杜松烯等高沸点挥发性化合物为主[10]。
具甜香、糖香的红茶品质特征形成主要是揉捻和发酵过程中发生酶促氧化作用。揉捻使糖苷酶与香气前体物质充分反应,释放萜烯醇类;而发酵使类胡萝素由结合态转为游离态,不饱和脂肪酸在脂肪氧化酶作用下降解为小分子的醛、酮、酸等[11]。
闷黄是加工黄茶的关键工序,湿热作用下多糖、蛋白质水解形成单糖与氨基酸,再进一步转化为香气物质[12]。陈香是黑茶特有的品质风格,晒青毛茶在渥堆过程由于湿热作用,微生物代谢释放胞外酶,发生酶促反应和甲基化反应,形成黑茶独特的香气[13]。萎凋是形成白茶品质的关键工序,不饱和脂肪酸在酶的作用下降解为醇、醛、酮和酸类香气化合物,己醛(苹果香)、反-2-己烯醛(青叶香伴有果香)、顺-3-己烯醇(青叶香)等香气成分含量较高[14]。
具有花香的乌龙茶其香气主要来源于加工过程中萜烯类和芳香醇类等配糖体的水解和脂肪酸、胡萝卜素类的氧化降解,在晒青和做青过程中大量形成[15]。做青过程中,摇青使茶鲜叶破损,细胞组织机械损伤,内部水分、氧气、膜透性等条件改变,促进多酚类的氧化,有利于酶活性的提高,令细胞液中的糖苷与糖苷水解酶充分接触,加快糖苷态香气前体物质的释放和水解,促进倍半萜烯类、己烯酯类、顺-茉莉酮、苯乙醛等香气物质的生成[16],最终生成橙花叔醇、芳樟醇等具花果香的香气物质[17]。
2 茶树萜烯类化合物研究现状
自然界中萜类化合物超过30000种,不仅结构具多样性,且大多生理活性活跃[18]。它们不仅参与植物香气的形成,而且在调节植物生长及其与环境的关系中起着重要的生态作用[19]。萜烯类化合物是甲戊二羟酸衍生的具有(C5H8)n通式的链状或环状的烯烃类衍生物,根据聚合程度分为单萜(n=2)、倍半萜(n=3)、二萜(n=4)、三萜(n=6)及多萜(n≥6)等,茶树中主要萜烯类化合物见图1。茶树中萜烯类化合物,特别是挥发性单萜(C10H16)与倍半萜(C15H24),大多具有宜人的花果香气[20],例如,单萜中芳樟醇(铃兰香、木香)、香叶醇(玫瑰花香),以及倍半萜中的橙花叔醇(花木香、似玫瑰及苹果香)等是茶叶的主要香气成分[21],很大程度上左右了茶叶香气品质。
近年来,有关萜烯类化合物代谢的研究取得了较大进展,基本明确了整个代谢途径过程。萜烯类物质有着共同的前体物质:异戊二烯基焦磷酸(Isopentenyl diphosphate,IPP)和3,3-二甲基烯丙基焦磷酸(Dimethylallyl pyrophosphale,DMAPP),其生物合成代谢途径主要包括两条(图2),其中一条是存在于胞质和内质网中的甲羟戊酸途径(mevaonate pathway,MVA),参与甾醇、倍半萜和三萜等次生代谢产物的生物合成;另一条是2-C-甲基-D-赤藻糖醇-4-磷酸途径(2-C-Methyl-D-erythritol-4-phosphate pathway,MEP),主要参与单萜、二萜、类胡萝卜素等的生物合成[22]。这两个途径中相关酶是合成香气物质的关键,其生理生化、分子生物学方面的研究对茶叶加工生产、遗传育种、生物防治等方面具有重要实践意义。
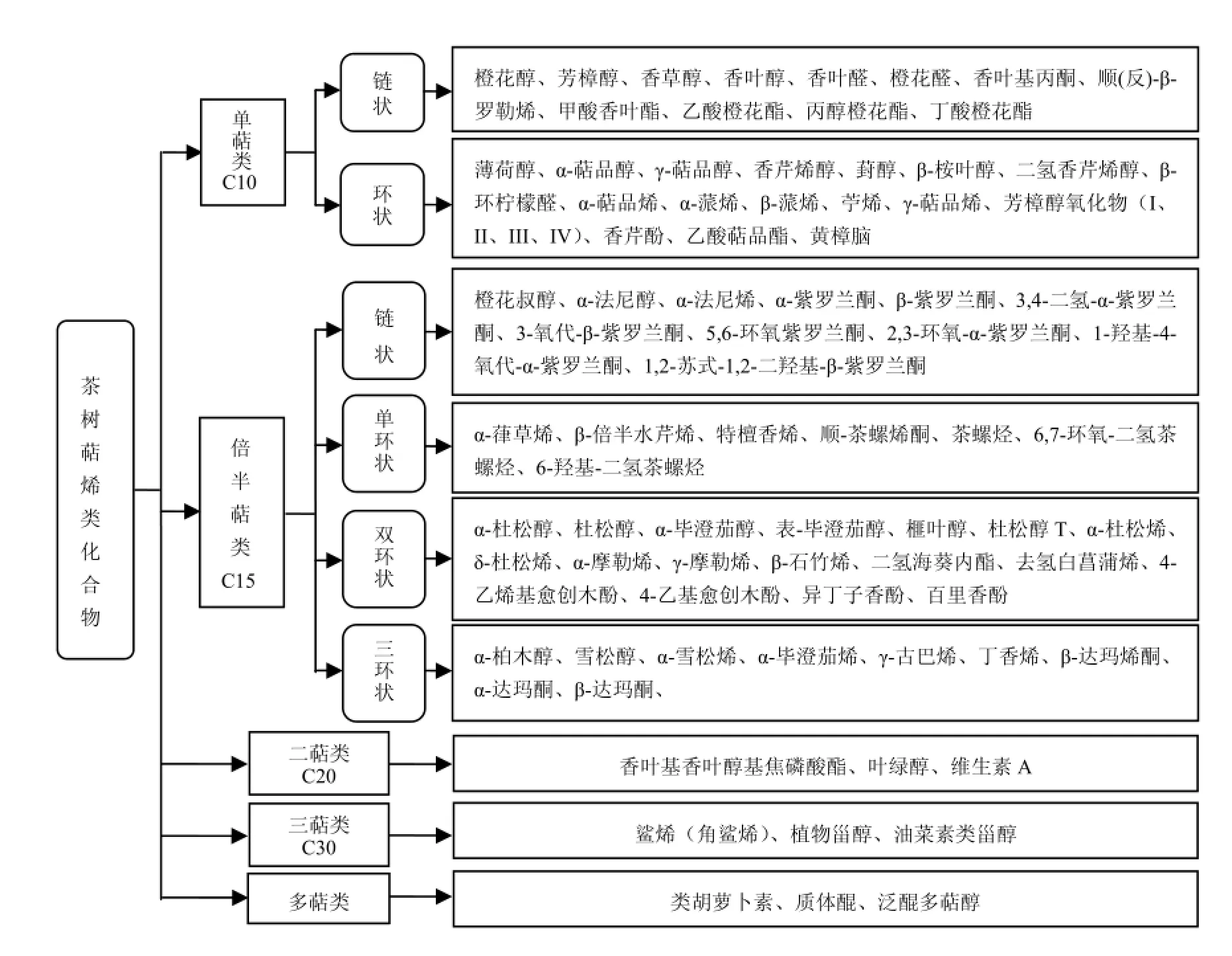
图1 茶树主要萜烯类化合物Fig.1 Major terpenes in Camellia sinensis
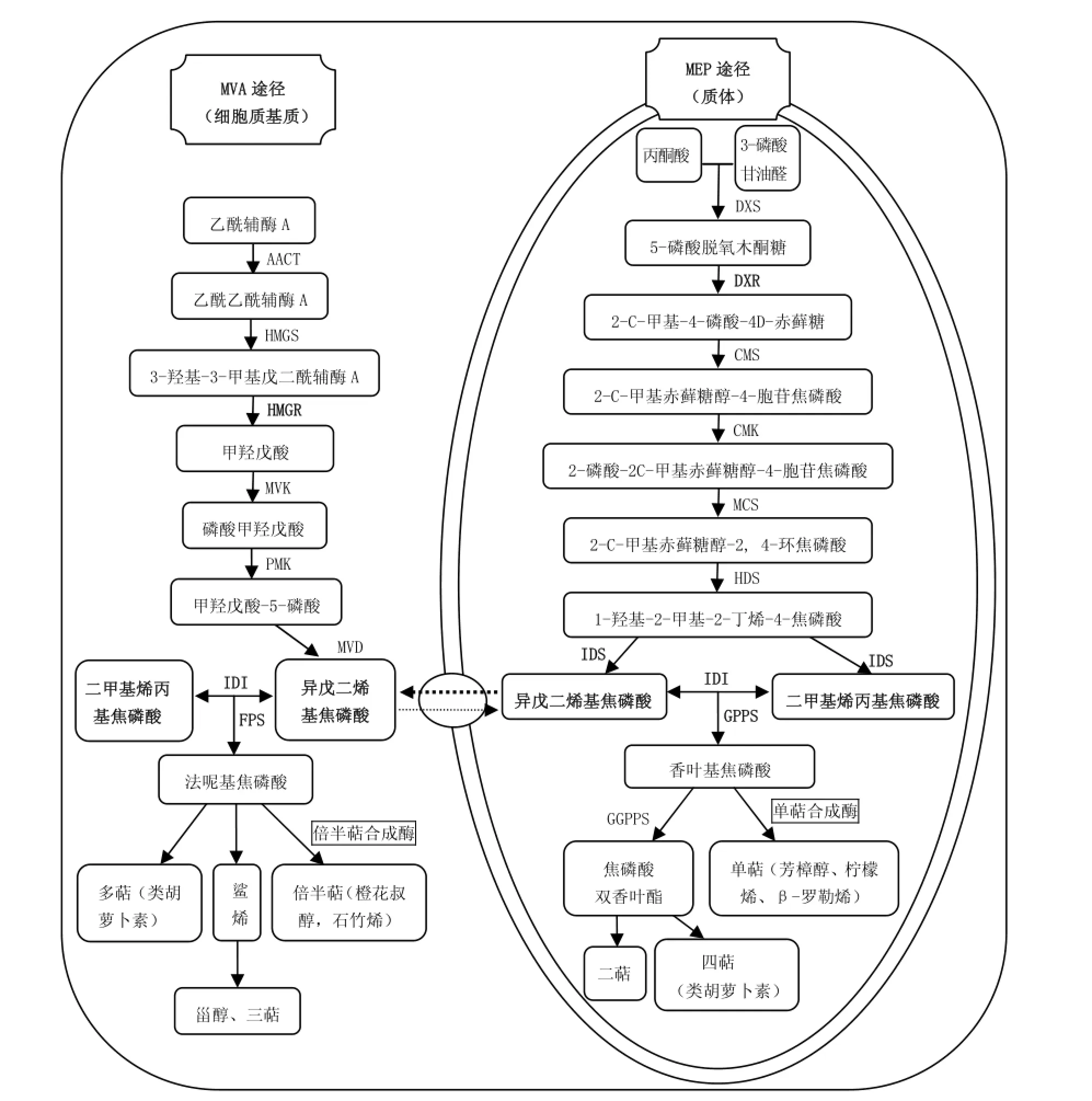
图2 茶树萜烯类化合物合成途径Fig.2 Pathways associated with terpene synthesis in Camellia sinensis
3 茶树萜烯类化合物代谢途径中相关酶研究现状
茶树萜烯类化合物合成途径中l-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)是影响萜类代谢前体IPP及DMAPP的限速酶;单萜和倍半萜合成酶是挥发性萜类代谢途径中的关键酶;糖基转移酶与茶鲜叶中糖苷态香气物质的合成、积累有关;糖苷水解酶水解糖苷态香气物质,释放香气化合物,控制萜烯类化合物转化形成挥发性萜类物质[23]。
3.1 异构酶类
DXR是MEP代谢途径中的限速酶。DXR将5-磷酸脱氧木酮糖(1-deoxy-D-xylulose-5-phosphate,DXP)转化为萜类合成的重要前体2-C-甲基-4-磷酸-4D-赤藓糖醇,是MEP合成途径中“碳流”分支点,是进行有效调控的靶点,是MEP代谢途径的关键步骤[24]。
异戊烯基焦磷酸异构酶(Isopentenyl diphosphate isomerase,IDI),催化IPP和DMAPP之间的同分异构转化,为产生法呢基焦磷酸和香叶基焦磷酸奠定物质基础[25]。IPP和DMAPP的缩合产物多次进行聚合反应,最终合成各种萜烯类化合物。刘敏等[26]研究发现,引入IDI提高了DMAPP的胞内浓度,有效催化了异戊二烯和β-胡萝卜素的生物合成,是下游代谢途径的总阀门,影响萜类合成前体库的代谢。
3.2 氧化还原酶类
HMGR是MVA代谢途径中重要的关键酶,催化HMG-CoA形成甲羟戊酸,是MVA途径中的限速酶,也是重要的调控位点[27],对植物萜类物质代谢有重要影响。但稳定提高IPP和植物固醇的产量不能只靠基因的过量表达,还需要与该途径中其他酶相互协调,才能有效提高终产物量。研究发现,泡囊丛枝菌根(Vesicalar-Arbuscular,VA菌根)共生可达到这一目的,它影响茶树根系HMGR基因的表达,调节相关激素代谢,影响茶树根系的生长[28]。
3.3 转移酶类
乙酰辅酶A酰基转移酶(Acetyl-CoA C-acetyltransferase,AACT),是MVA代谢途径上的第一个关键酶,直接影响主要活性成分的合成,催化蛋白质酰基化和去酰基化,使两分子乙酰辅酶A缩合为乙酰乙酰辅酶A,是真核生物进行蛋白质修饰最普遍的方式,调节蛋白质的生物活性及其基因表达,对茶树的生长发育具有重要作用[29]。
3.4 水解酶类
茶树生长发育次级代谢产物,如单萜烯醇、芳香族醇和不饱和脂肪族醇等挥发性物质大多以糖苷形式存在,且以樱草糖苷和葡萄糖苷为主,加工过程中糖苷类香气前体物质被内源糖苷酶水解,与糖苷合成、水解密切相关的酶类主要有β-樱草糖苷酶、β-葡萄糖苷酶I(β-glucosidase I)、β-葡萄糖苷酶II(β-glucosidase II)等,释放出的挥发性苷元是茶叶香气的物质基础[30-31]。光照、温湿度等条件引起糖苷类香气前体物质和糖苷酶活性差异,造成不同季节茶叶的香气成分存在差异,春茶和秋茶花香浓郁,而夏暑茶花香低淡[32]。
在杀青叶中加入葡萄糖苷酶,能产生芳樟醇、香叶醇,使杀青叶散发宜人的香气,而β-葡萄糖苷酶抑制剂(Hg及葡萄糖酸内酯)可以抑制茶鲜叶中芳樟醇和香叶醇的生成[33-34]。在红茶揉捻(切)、发酵期间添加外源酶,如β-糖苷酶、蛋白质酶、纤维素酶等可促进不溶性的大分子物质分解,变“废”为宝,高沸点香气物质增加,低沸点香气物质大幅度降低,明显改善红茶香气[35-36]。目前对β-葡萄糖苷酶和β-樱草糖苷酶的研究已从生理生化水平逐步向分子水平发展,已完成分离纯化[33]、活性测定[37]、在加工过程中的变化[38]、不同种质资源之间的差异[39]、基因克隆和生物信息学分析以及原核表达[40]等。
3.4.1 β-葡萄糖苷酶
β-葡萄糖苷酶,广泛存在于自然界中,动植物、微生物中[41]。Motoko等[42]首次证实了β-葡萄糖苷酶参与茶叶香气的释放,100 g茶鲜叶中含有20.8个活力单位的β-葡萄糖苷酶。β-葡萄糖苷酶将纤维素二糖和纤维素寡糖水解成葡萄糖,同时还可水解香叶醇、芳樟醇等单萜烯醇类芳香物质[31,37],以及对硝基苯β-D-半乳糖和β-D-木糖苷[43]。李叶云[44]推测茶树中β-葡萄糖苷酶为单体酶,用电泳和快速蛋白液相色谱(Fast protein liquid chromatography,FPLC)测得酶分子量。茶鲜叶中β-葡萄糖苷酶最佳提取条件为添加与鲜叶等重的交联聚维酮(PVPP)和 0.1 mol·L-1、pH=6.0的柠檬酸-柠檬酸钠缓冲液以及2~2.5 mol·L-1的甘油[45]。
3.4.2 β-樱草糖苷酶
樱草糖苷酶是另一个参与茶树糖苷态香气前体释放的重要糖苷水解酶,活性高于葡萄糖苷酶,茶树体内的β-樱草糖苷酶是双糖苷水解酶,水解β-樱草糖苷键释放出樱草糖苷[46]。当pH=5.0,T=50℃时β-樱草糖苷酶活性最高,聚丙烯酰胺凝胶电泳法(SDS-PAGE法)测得其分子量为61kD,等电点pI=9.4[8]。茶树经茉莉酸甲酯处理,β-樱草糖苷酶在叶片中的表达量增加3倍,极显著高于未经处理的空白对照[47]。
茶树β-樱草糖苷酶的功能、提取方法和酶活性测定方法等尚不稳定,需进一步进行深入研究,为今后研究樱草糖苷酶,研究茶叶萜烯类化合物香气物质、茶叶香气分子机制等奠定基础。
3.5 合成酶类
植物单萜物质,主要在质体中由前体物质香叶基焦磷酸(Geranyl diphosphate,GPP)经单萜合成酶催化生成;而植物倍半萜物质,主要在细胞质中由前体物质法尼基焦磷酸(Famesyl diphosphate,FPP)经倍半萜合成酶催化生成[48]。法呢基焦磷酸合酶(Farnesyl pyrophosphate synthase,FPS)存在于很多植物中,异戊二烯基焦磷酸和二甲基烯丙基焦磷酸在FPS的作用下生成FPP,系统进化模式分析表明,亲缘关系相近的物种,FPS酶具有保守氨基酸残基,FPS酶基因可作为理想的分子标记基因,用于植物分类、进化的研究[49]。
茶树萜烯类合成酶[50]中单萜合成酶主要有:月桂烯合成酶(Myrcene synthase)、芳樟醇合成酶(Linalool synthase,LIS)、反式β-罗勒烯合成酶(β-Ocimene synthase,β-OCS)、香叶烯合成酶(Myrcene synthase,MYS)、柠檬烯合成酶(Limonene synthase,LIM)、水芹烯合成酶(Phellandrene synthase,PHS)、香叶醇/香茅醇乙酰基转移酶(Geraniol/Citronellol acetylase)等;倍半萜合成酶主要有:大根香叶烯合成酶(Germacrene D synthase,GES)、法尼烯合成酶(Farnesene synthase,FAS);单萜/倍半萜合成酶主要有:橙花叔醇/芳樟醇合酶1(Nerolidol/Linalool synthase-1,NES/LIS-1);倍半萜/二萜双合成酶主要有:橙花叔醇/香叶基芳樟醇合成酶(Nerolidol/Geranyl linalool synthase,NES/GLS)。
安徽农业大学茶叶生物技术与生物化学重点实验室进行茶树转录组测序,得到相关萜类合成酶部分序列,通过基因序列比对,发现一些基因序列与其它植物的萜类合成酶基因相似度很高,其中芳樟醇/橙花叔醇合成酶(Linalool/Nerolidol synthase,LIS/NES)基因全长已被克隆登录[51],为深入研究茶树单萜合成酶基因奠定基础,以及从基因水平研究调控茶叶香气释放机理提供重要保障。
4 茶树萜烯类化合物合成途径相关酶基因的研究现状
茶树基因组大小约4.0 Gbp,是拟南芥基因组大小的近40倍,水稻的近7倍[52]。茶树是多年生木本、常异交植物,部分为三倍体植株,给基因组测序带来难题,目前茶树全基因组测序尚未完成,但2014年叶晓倩等[53]完成了国内首次茶树叶绿体全基因组157085bp(GenBank:KF562708.1)的测序工作,为茶树品种鉴定奠定良好基础,虽研究起步较晚,但取得了显著进展。通过同源探针筛选获得了许多茶树基因,如脂氢过氧化物裂解酶基因(Hydroperoxide lyase,HPL)[54]、水杨酸羧基甲基转移酶基因(Salicylic acid carboxyl methltransferase,SAMT)[55]、苯丙氨酸基因解氨酶基因(Phenylalanineammonialyase,PAL)[56]、咖啡因合成酶基因(Caffeine synthase,CS)[57]、查尔酮合成酶1基因(Chalcone synthase1,CHS1)、CHS2基因、CHS3基因[58]、脂氧合酶1基因(Lipoxygenase 1,LOX1)[59]、LOX2基因[60]、LOX3基因[61]、萜类代谢途径上相关基因[23,62-64]等。而FPS(专利号:201210239772.1)、DXR(专利号:201210239518.1)、β-Glu(专利号:CN201310177923.X)、CsLIS/NES(专利号:201310070031.X)等基因及其应用均已被申请专利。
茶树萜烯类化合物代谢途径中相关基因的分子生物学研究,为茶叶香气形成的分子机理研究奠定基础。搜索互联网GenBank、NCBI核酸序列数据库以及论文文献获得整理部分茶树萜烯类代谢途径中相关基因的研究情况,见表1。
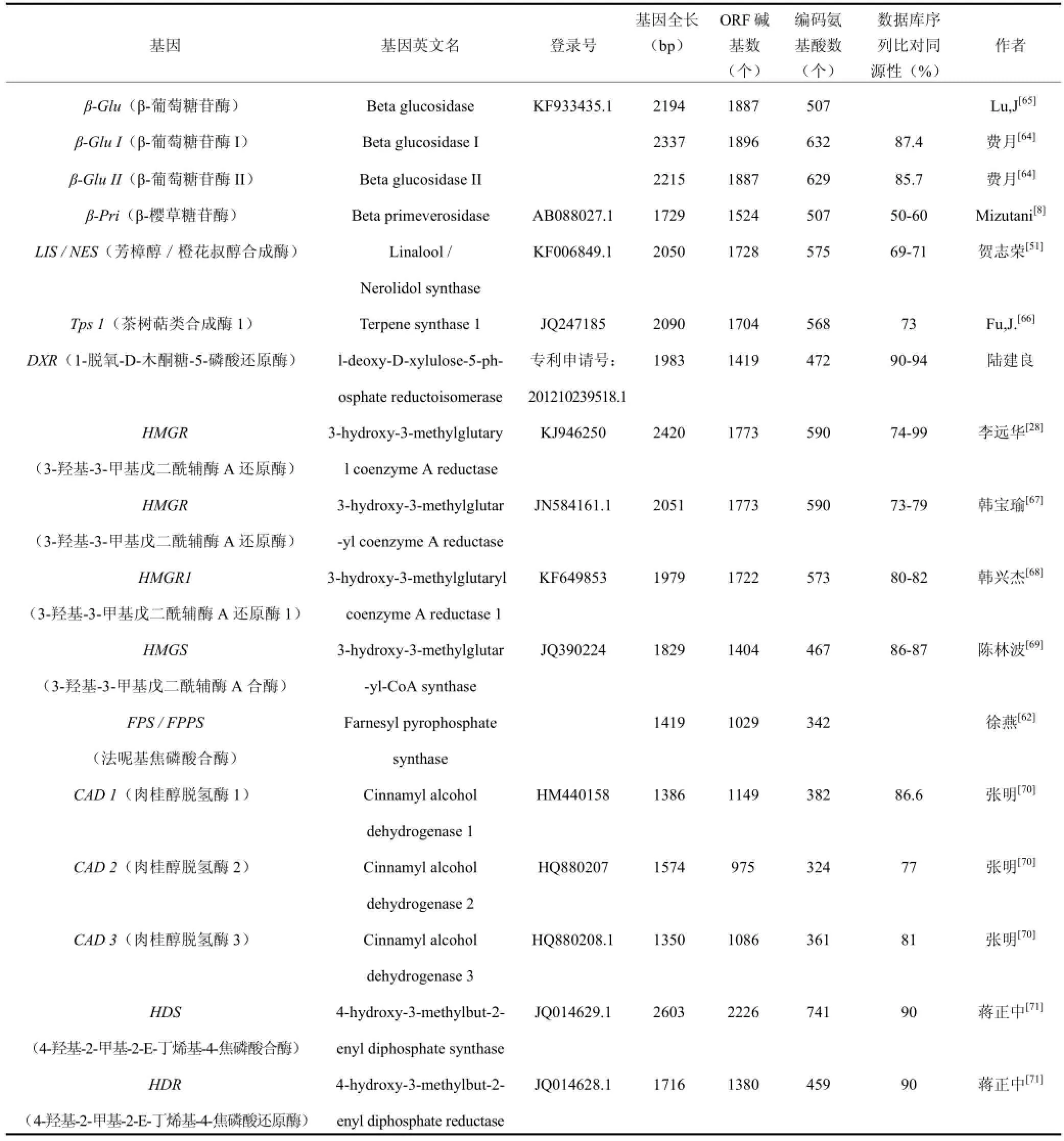
表1 茶树萜烯类代谢途径中相关基因的研究情况Table 1 Research on genes relating to terpene metabolic pathways in Camellia sinensis
4.1 异构酶基因
2013年徐燕[62]克隆了DXR基因,进行了分子生物学信息分析,并采用荧光定量法研究这些基因在不同茶树品种、不同萎凋时间以及不同紫外线照射时间的表达差异,研究发现DXR基因的表达与茶叶的失水胁迫具有显著相关性,不同品种之间、不同萎凋时间DXR基因的表达差异明显,而紫外线照射的影响较弱。
项威[63]根据课题组前期获得的茶树转录组测序结果获得IDI基因部分序列片段,有待进一步克隆研究,进行前体饲喂研究发现 IDI基因的表达量不受前体乙酰辅酶A的刺激影响,具体原因有待进一步研究分析。
4.2 氧化还原酶基因
徐燕[62]克隆了HMGR基因家族中I类的茶树HMGR基因,研究得到其分子式为C2804H4484N762O853S31,蛋白分子量约63.5kD,等电点(pI)为6.51。采用SSH技术分析VA菌根处理对福鼎大白茶根系的影响,获得HMGR基因全长序列,发现生物性和非生物性胁迫对HMGR基因表达有很大影响[28]。而茶树HMGR1和HMGR2的蛋白均为疏水性蛋白,分别与拟南芥、烟草和番茄遗传距离相近[72]。2015年韩兴杰等[73]通过同源克隆技术克隆登录了HMGR1基因的全长cDNA,命名为 CsHMGR1,分析发现其N-端序列差异较大,而催化活性区域的C-端相当保守,共含1个磷酸化位点、2个跨膜区、HMG-CoA 结合位点和NADPH结合位点、4个保守的催化活性残基。
4.3 转移酶基因
Wei Xiang等[74]克隆了茶树AACT 基因全长序列,编码408个氨基酸,与油柿中的AACT蛋白质序列同源性高达94%,分析预测定位不在细胞质或质体中,而在其他亚细胞空间。而愈伤组织转化试验因转化效率低等问题仅获得了少数转基因愈伤组织,对愈伤组织和叶圆片分别饲喂前体药物,基因在愈伤组织中的表达量明显比叶圆片的高,转录水平受到代谢底物的正调控。
4.4 水解酶基因
赵丽萍等[75]利用EST计划(植物基因组表达序列标签)得到了1680个基因片段,制备了全世界首张茶树cDNA芯片,成功检测到了2个茶叶香气基因:β-葡萄糖苷酶基因以及β-樱草糖苷酶基因。李远华[76]研究茶树β-葡萄糖苷酶基因,通过生物信息学分析、原核表达、该酶基因mRNA的表达和定位研究,发现其集中分布在细胞核内,部分定位于叶片表皮,栅栏、海绵组织中[77],成功构建的β-葡萄糖苷酶体外表达载体,显示不同品种表达强度不同,不同季节表达信号强度为春梢>秋梢>夏梢[78],为研究茶叶香气形成机理与调控奠定基础,特别对研究不同品种、不同季节对茶叶香气的影响有重要意义。赵丽萍等[79]检测发现茶树新梢不同叶位的β-葡萄糖苷酶基因和β-樱草糖苷酶基因表达水平存在差异,β-葡萄糖苷酶基因表达水平为第四叶>第三叶>第五叶>第二叶>一芽一叶,叶片成熟度增加基因表达上调,第四叶达到顶峰,而β-樱草糖苷酶基因表达水平则随着叶片成熟度的增加表达逐渐降低。与陈亮等[80]的研究结果有所差异,但都表明了一定成熟度的茶鲜叶其糖苷酶活性较高,糖苷香气前体物质更易转化为茶叶萜烯类香气物质,同时也为深入研究不同采摘标准影响茶叶香气奠定了基础。
2014年Ying Zhou等[81]首次在茶树花中发现并分离4个苯乙醇共轭糖苷:(R)-苯乙醇-吡喃型樱草糖苷((R)-1PE-Pri)、(S)-1PE-Pri和®-苯乙醇-吡喃型葡萄糖苷((R)-1PE-Glu)、(S)-1PE-Glu,研究发现苯乙醇樱草糖苷的浓度在茶花生长的每一阶段都低于苯乙醇葡萄糖苷,但在大肠杆菌中重组的β-樱草糖苷酶蛋白其水解作用高于天然的,苯乙醇共轭糖苷酶难以从茶树花中水解释放苯乙醇。而Hiromichi Saino[82]确定了晶体结构的樱草糖苷配合体,确定了3个活性部位subsites-1,subsites-2,和subsites-3,揭示活性部位的构架是底物专一特异性的原因,发现subsites-1和2主要接受氢键,而subsites-3接受各种芳香苷配基,但樱草糖苷酶不能识别色氨酸糖苷配基,是特殊的二糖脒抑制剂。
4.5 合成酶基因
贺志荣[51]利用课题组前期获得的转录组数据,克隆并登录茶树芳樟醇/橙花叔醇合成酶CsLIS/NES基因的全长,进行生物信息学分析、原核表达、烟草转化、亚细胞定位等研究,离体实验发现该基因具催化生成芳樟醇和橙花叔醇双功能,在茶树上却主要催化生成芳樟醇,难以检测到(E)-橙花叔醇,是催化产生芳樟醇的关键基因,并且茶树嫩叶表达量高于老叶,丰度变化与茶树中游离态和糖苷态芳樟醇的一致,对茶叶香气品质有直接的影响,为以后深入研究茶树单萜、倍半萜合成酶基因,为进一步研究催化生成橙花叔醇的酶基因提供借鉴。
徐燕[62]以福鼎大白茶作为实验材料,获得了茶树萜类代谢途径上FPS这3个关键酶基因的全长,还获得了牻牛儿基牻牛儿基二磷酸合酶基因
(Geranylgeranyl diphosphate synthase,GGPS)、5-磷酸脱氧木酮糖合成酶基因(1-deoxy-D-xylulose-5-phosphate synthase,DXS)和LIS基因的3'端序列,发现在不同品种、不同萎凋时间各个基因的表达强度不同,与茶树品种抗性、茶叶品质、萜类物质的积累转化是否存在关联有待进一步深入研究。
项威[63,74]克隆了茶树3-羟基-3-甲基戊二酰辅酶A合酶基因(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)、4-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶(4-hydroxy-3-methylbut-2-enyl diphosphate synthase,HDS)基因和法呢基焦磷酸合酶基因(Farnesyl pyrophosphate synthase,FPPS)的全长序列,推测其蛋白产物分别有464、741、341个氨基酸单位组成,与其他植物最高同源性分别为86%、100%和90%。分析预测分别定位在分泌系统或其他亚细胞空间、质体或其他亚细胞结构中、在除叶绿体、线粒体外的亚细胞结构和分泌途径中。对获得的少数愈伤组织和叶圆片分别饲喂前体药物,发现3个基因的表达在不同程度上受到代谢底物的调控,其原因有待进一步研究。
5 展望
近年来,茶树基因的分离、克隆、表达等分子生物学研究已取得显著进展,但与草本植物、园艺植物相比还有很大差距,数量较少,研究的广度和深度都不够,利用分子生物学对茶树育种、生产、加工等实际应用尚在起步实验阶段,科研成果未能转化为生产力。
茶叶萜烯类代谢途径与茶叶香气形成密切相关,研究萜烯类代谢途径中的相关酶基因具有重要意义。近年来,对于萜烯类代谢途径相关酶基因在不同茶树品种、不同成熟度叶片、组织(叶片、嫩梢、根系)、不同季节以及紫外照射时间处理等时空表达特性进行了分析研究,并在细胞组织机械损伤、高温、低温、冻害、寒害、病虫害等胁迫条件下进行定量表达研究,探究基因对胁迫因子的响应规律;另外,结合酶活力大小与萜烯类物质积累情况进行分析,探究基因时空表达与胁迫因子、萜烯类香气物质积累的关系,为探明茶叶香气形成分子机理,为改善茶园管理、茶叶加工等理论技术奠定基础。
探明茶叶香气形成机理,对于茶树品种创新、抗性育种、高香茶产品的研制都具有重要理论意义及应用价值。未来可进一步补充、完善香气物质代谢合成途径相关基因,特别是关键酶基因的分离、克隆、生物信息学分析、时空表达,构建表达载体、原核表达、分离克隆启动子、亚细胞定位、过量表达、农杆菌介导转化、烟草转化或茶树植株转化等获得转基因植株,如高香型、高氨基酸、低咖啡介导的基因转化到茶树效率低下的瓶颈。这些将为茶树遗传育种、茶叶加工、改善茶叶香气品质等提供广阔的发展空间和应用前景。
[1] Yang Z Y, Baldermann S, Watanabe N. Recent studies of the volatile compounds in tea[J].Food Research International,2013,(53):585-599.
[2] 张婉婷,张灵枝,王登良,等.加工工艺对乌龙茶香气成分影响的研究进展[J].中国茶叶,2010,32(4):10-l3.
[3] 张啟,罗龙新,程其春,等.茶香气成分研究进展及护香的探讨[J].农产品加工 学刊(下),2014(1):45-47,50.
[4] 袁杰,翁连进,耿頔,等.茶叶香气的影响因素[J].氨基酸和生物资源,2014,36(1):14-18,35.
[5] 郭雯飞.茶叶香气生成机理的研究[J].中国茶叶加工,1996,(4):34-37.
[6] 吕连梅,董尚胜.茶叶香气的研究进展[J].茶叶,2002, 28(4):181-184.
[7] Wang D, Kurasawa E, Yamaguchi Y, et a1.Analysis of glycosidically bound aroma precursors in tea leaves,2 Changes in glycoside contents and glycosidase activities in tea leaves during the black tea manufacturing process[J].Agfic Food Chem,2001,(49):1900-1903.
[8] Mizutani M, Nakanishi H, Ema J, et al. Cloning of β-primeverosidasea from tea Leaves,a key enzyme in tea aroma formation[J].Plant Physiology, 2002,(130):2164-2176.
[9] 谭月萍,黄建安,刘仲华.绿茶香气组成及其在加工中变化研究进展[J].茶叶通讯,2006,33(1):35-38.
[10] 叶乃兴,杨广,郑乃辉,等.烘青茶坯香气成分的SPME/GC-MS分析[J].福建农林大学学报:自然科学版,2006,35(2):165-168.
[11] Ramaswamy R. Carotenoid composition distribution and degradation to flavour volatiles during black tea manufacture and the effect of carotenoid supplementation on tea quality and aroma[J].Food Chemistry,2002,78(1):23-28.
[12] 周继荣,倪德江.黄茶品质形成机理及加工工艺研究进展[J].蚕桑茶叶通讯,2003,(3):5-6.
[13] 吕海鹏,钟秋生,王力,等.普洱茶加工过程中香气成分的变化规律研究[J].茶叶科学,2009,29(2):95-101.
[14] 郭雯飞,孟小环,罗永此.白牡丹与白毫银针香气成分的研究[J].茶叶,2007,33(2):78-81.
[15] 粱晓岚,陈春.乌龙茶香气形成机理初探[J].广东农业科学,1996,(4):24-27.
[16] 杨意成,梁月荣.乌龙茶花香形成机理的研究[J].茶叶,2008,34(1):10-14.
[17] 宛晓春.茶叶生物化学(第三版)[M].北京:中国农业出版社,2003.
[18] 乐贵洲,黄轩,刘波,等.具有反式六氢茚满结构的萜类化合物的合成研究进展[J].有机化学,2013,33(6):1167-1185.
[19] Gershenzon J, Dudareva N. The function of terpene natural products in the natural world [J]. Nat Chem Biol,2007,(3):408-414.
[20] 张正竹,施兆鹏,宛晓春.萜类物质与茶叶香气[J].安徽农业大学学报,2000,27(1):51-54.
[21] 袁海波,尹军峰,叶国注,等.茶叶香型及特征物质研究进展[J].茶叶科学,2009,29(8):14-15.
[22] 李莉,高凌云,董越,等.植物类异戊二烯生物合成相关酶基因研究进展[J].浙江师范大学学报:自然科学版,2008,31(4):461-466.
[23] 贺志荣,项威,徐燕,等.茶树挥发性萜类物质及其糖苷化合物生物合成的研究进展[J].茶叶科学,2012,32(1):1-8.
[24] Himmeldirk K, Kennedy I A, Hill R E, et al. Biosynthesis of vitamins B1 and B6 in Escherichia coli: concurrent incorporation of 1-deoxy-D-xylulose into thiamin (B1) and pyridoxol (B6) [J]. Chem Commun,1996:1187-1188.
[25] 郭万柱,吴彤,陈瑶先.动物微生物学[M].成都:四川科学技术出版社,1996:229-233,430-439.
[26] 刘敏,刘建忠,冯红茹,等.异戊二烯焦磷酸异构酶的表达及其催化功能验证[J].武汉科技大学学报:自然科学版,2013,36(3):214-218.
[27] Liao Z H, Chen M, Gong Y F, et al. Isoprenoid biosynthesis in plants:pathways,genes, regulation and metabolic engineering[J].J Bio Sci,2006, 6(1):209-219.
[28] 李远华,陆建良,范方媛,等.茶树根系HGMR基因克隆及表达分析[J].茶叶科学,2014,(6):583-590.
[29] 姚元枝,黎晓英,魏麟,等.鱼腥草乙酰辅酶 A 酰基转移酶基因克隆、表达及生物信息学分析[J].中草药, 2015,46(1):107-111.
[30] Hua W, Xiao Q, Ilg Y. Free and glycosidically boiled monoterpene alcohols in Qimen black tea[J].Food Chemistry.1996,56(4):395-398.
[31] Guo W F, Yamaguchi K, Watanabe N, et al. A primeverosidase as a main glucosidase concerned with the alcohol aroma formation in tea leaves[J].Bioscience Biotechology Biochemistry, 1995,(59):962-964.
[32] 张正竹,宛晓春,施兆鹏,等.茶鲜叶在不同季节及绿茶加工贮藏过程中糖苷类香气前体含量变化研究[J].食品与发酵工业,2005,29(3):1-4.
[33] Takeo T. Production of linalool and germinal by hydrolytic breakdown of bound forms in disrupted tea shoots[J].Phytochemistry,1981,120(9):2145-2147.
[34] 竹尾忠一.乌龙茶的香气特征[J].国外农学——茶叶,1984,(4):16-22.
[35] 夏涛,高萍.茶鲜叶匀浆悬浮发酵红茶饮品的香气品质研究[J].南京农业大学学报,1999,2(4):84-88.
[36] 陈荣荣,王根女,张献忠,等.糖苷酶在茶叶增香及香气形成中的应用研究进展[J].香料香精化妆品, 2014,(5):48-52.
[37] 王华夫,游小青.茶叶中β-葡萄糖苷酶活性的测定[J].中国茶叶,1996,(3):16-17.
[38] 夏涛,童启庆,董尚胜,等.红茶萎凋发酵中β-葡萄糖苷酶的活性变化[J].茶叶科学,1996,16(1):63-66.
[39] 骆耀平,董尚胜,童启庆,等.7个茶树品种新梢生育过程中β-葡萄糖苷酶活性变化[J].茶叶科学, 1997,(S1):25-28.
[40] 李远华,江昌俊,杨顺利,等.茶树β-葡萄糖苷酶cDNA克隆和原核表达[J].农业生物技术学报,2004,(6): 625-629.
[41] 杨晓宽.β-葡萄糖苷酶研究进展[J].河北科技师范学院学报,2012,26(1):77-81.
[42] Motoko Y, Katsuhide O, Kikue K. Studies on the precursors of monoterpene alcohols in tea leaves[J]. Agricultural and Biological Chemistry.1990, 54(4):1023-1028.
[43] 陈向东,藤尾雄策.日本根霉IF 5318胞外葡萄糖苷酶的纯化及部分特性[J].微生物学报,1997,937(5): 368-373.
[44] 李叶云.茶树中β-葡萄糖苷酶的研究[D].合肥:安徽农业大学,2000.
[45] 江昌俊,李叶云,王朝霞.茶树鲜叶中β-葡萄糖苷酶提取条件的研究[J].南京农业大学学报,2000,23(2): 93-96.
[46] 赵芹,童启庆.茶叶香气水解酶研究动态[J].福建茶叶,1999,(1):5-8.
[47] Jiang SH, LI W, Cheng ying M A, et al. Aroma changes of black tea prepared from methyljasmonate treated tea plants[J]. Journal of Zhejiang University Science,2014,15(4):313-321.
[48] Aharoni A, Jongsma MA, Bouwmeester HJ, et al. Volatile science Metabolic engineering of terpenoids in plant[J].Trends Plant Sci,2005, 10(12):594-602.
[49] Wang P, Liao Z, Guo L, et al. Cloning and functional analysis of a cDNA encoding Ginkgo Biloba farnesyl diphosphate synthase[J]. Molecules and Cells,2004,18(2):150-156.
[50] 刘晶晶,王富民,刘国峰,等.茶树萜类香气物质代谢谱与相关基因表达谱时空变化的关系[J].园艺学报, 2014,41(10):2094-2106.
[51] 贺志荣.茶树单萜/倍半萜合成酶基因CsLIS/NES的催化功能、时空表达以及对茶叶香气品质的影响[D].合肥:安徽农业大学,2013.
[52] Tanaka J, Taniguchi F. Estimation of the genome size of tea (Camellia sinensis),camellia(C japonica),and their interspecific hybrids by flow cytometry[J].Journal of the Remote Sensing Society of Japan,2006,(101):1-7.
[53] 叶晓倩,赵忠辉,朱全武,等.茶树龙井43叶绿体基因组测序及其系统进化(英文)[J].浙江大学学报:农业与生命科学版,2014,(4):404-412.
[54] Fu J Y. Molecular cloning and expression analysis of a putative sesquiterpene synthase gene from tea plant[J].Acta Physiol Plant.2013,35(1): 289-293.
[55] 曹士先.基于cDNA-aflp筛选茶树被茶尺蠖取食诱导的相关差异基因及SAMT的克隆与表达分析[D].合肥:安徽农业大学,2012.
[56] Matsumoto S, Takeuchi A, Hayatsu M. Molecular cloning of phenylalanine ammonialyase cDNA and classification of varieties and cultivars of tea plants (Camellia sinensis) using the tea PAL cDNA probe[J].Theoretical and Applied Genetics,1994, (89):67l-675.
[57] Kato M, Mizuno K, Crozie A, et a1. Caffeine synthase gene from tea leaves[J].Nature,2000,(406): 956-957.
[58] Takeuchi A, Matsumoto A, Hayatsu M. Chalcone synthase on Camellia sinensis: isolation of the cDNAs and the organ-specific and sugar-responsive expression of the genes[J].Plant Cell Physiology, 1994,35(7):1011-1018.
[59] Liu S A, Han B Y. Differential expression pattern of an acidic 9/13-lipoxygenase in flower opening and senescence and in leaf response to phloem feeders in the tea plant[J]. BMC Plant Biology. 2010,(10):228.
[60] Liu S A, Han B Y, Fu J Y. Lipoxygenase (LOX2) from tea plant (Camellia sinensis) [EB/OL]. http://www.ncbi.nlm.nih.gov/nuccore/FJ418174.
[61] Wu Y L, Wei C L, Zhang M. Cloning and functional analyses of the full-length genes isolated from the leaves of tea plant induced by Ectropic obilqua attack[EB/OL]. http://www.ncbi.nlm. nih.gov/nuccore/HM440161.
[62] 徐燕.茶树萜类合成途径关键基因克隆及表达研究[D].杭州:浙江大学,2013.
[63] 项威.茶树萜类代谢上游基因表达的代谢前体调控和茶树转基因系初探[D].合肥:安徽农业大学,2012.
[64] 费月.与茶叶香气形成相关的三个内源糖苷酶基因的克隆和原核表达[D].合肥:安徽农业大学,2012.
[65] Lu J, Fan F, Liang Y. Identification of differentially expressed genes in Camelliasinensis exposed to UV-B radiation by suppression subtractive hybridization[EB/OL]. http://www.ncbi.nlm.nih.gov/nuccore/KF933435.1
[66] Fu,J. Molecular cloning and expression analysis of a putative sesquiterpene synthase gene from tea plant (Camellia sinensis) [EB/OL]. http://www.ncbi.nlm.nih.gov/nuccore/JQ247185
[67] Han B, Wang M. A 3-hydroxy-3-methylglutaryl coenzyme A reductase (HMGR) from tea plant (Camellia sinensis) [EB/OL]. http://www.ncbi.nlm.nih.gov/nuccore/JN584161.1
[68] Han,X J , Xu L L , Liao L. Cloning of a cDNA encoding HMG-CoA reductase (HMGR) from tea (Camellia sinensis (L.) O. Kuntze) and its sequence analysis[EB/OL]. http://www.ncbi.nlm.nih.gov/nuccore/KF649853
[69] 陈林波,刘本英,汪云刚,等.茶树HMGS基因的克隆与序列分析[J].西北农业学报,2013,22(5):72-76.
[70] 张明.茶树中三个与茶尺蠖取食诱导相关的肉桂醇脱氢酶(CAD)基因克隆与功能分析[D].合肥:安徽农业大学,2011.
[71] 蒋正中.茶树MEP途径中HDS与HDR基因的cDNA全长克隆、功能分析与表达特征研究[D].合肥:安徽农业大学,2013.
[72] 乔新荣,马健,殷东林,等.茶树HMGR蛋白的生物信息学分析[J].贵州农业科学,2014,(8):26-29.
[73] 韩兴杰,徐玲玲,廖亮,等.茶树HMG-CoA还原酶基因全长cDNA克隆及序列分析[J].广西植物,2015,(2):242-249
[74] Wei X, Yan X, Fu M W, et al. In Silico Analysis and Feeding Assays of Some Genes in the Early Steps of Terpenoid Biosynthetic Pathway in Camellia Sinensis[J]. Journal of Tea,2013, 39(4):191-198.
[75] 赵丽萍,高其康,陈亮,等.茶树基因芯片的研制和初步应用[J].茶叶科学,2006,26(3):166-170.
[76] 李远华.茶树β-葡萄糖苷酶基因克隆,表达和分布定位[D].合肥:安徽农业大学,2003.
[77] 李远华,江昌俊,余有本,等.茶树叶片β-葡萄糖苷酶基因的原位PCR研究[J].茶叶科学,2004,24(2): 147-150.
[78] 李远华,江昌俊,余有本.茶树β-葡萄糖苷酶基因mRNA的表达[J].南京农业大学学报,2005,28(2): 103-106.
[79] 赵丽萍,陈亮,王新超,等.茶树新梢不同叶片中β-葡萄糖苷酶和β-樱草糖苷酶基因表达的实时定量PCR分析[J].茶叶科学,2006,26(1):11-16.
[80] 陈亮,赵丽萍,马春雷,等.茶树β-葡萄糖苷酶和β-樱草糖苷酶基因表达差异分析[J].园艺学报,2009, 36(1):87-92.
[81] Ying Zhou, Fang Dong, Aiko Kunimasa, et al. Occurrence of Glycosidically Conjugated 1-Phenylethanol and Its Hydrolase β-Primeverosidase in Tea (Camellia sinensis) Flowers[J].Journal of Agricultural and Food Chemistry.2014,62(32): 8042-8050.
[82] Hiromichi Saino, Tetsuya Shimizu,Jun Hiratake,et al.Crystal Structures of β-Primeverosidase in Complex with Disaccharide Amidine Inhibitors[J]. The Journal of Biological Chemistry.2014, 289(24):16826-16834.
Research Progress of Enzymes Associated with Terpene Synthesis in Camellia sinensis
ZHANG Dong-tao1,SUN Jun2,YE Nai-xing1*,CHEN Gui-xin1
(1. College of Horticulture,Fujian Agriculture and Forestry University/Key Laboratory of Tea Science at Universities in Fujian,Fuzhou,Fujian 350002,China; 2. Tea Research Institute,Fujian Academy of Agricultural Sciences,Fu’an,Fujian 355015,China)
Terpenes are closely related to the tea aroma. The aromatic substances, such as nerol, linalool, nerolidol, α-farnesol, α-ionone, theaspirone, caryophyllene, copaene, cedrol, etc. are synthesized through the mevaonate and 2-C-methyl-D-erythritol-4-phosphate pathways in the plant. The complex regulating mechanisms of the process greatly impact the tea quality. This paper reviews the current research and development on the related enzymes, which are responsible for the synthesis of the aromatic terpenes in the tea plants in the pathways. A discussion focusing on future directions for studies is also presented.
tea aroma; terpenes; metabolic pathway; enzyme
S571.1
A
2015-04-07 初稿;2015-06-09 修改稿
福建省农业高校产学合作科技重大项目(2013N5009);福建省“2011协同创新中心”中国乌龙茶产业协同创新中心(培育)专项(2013-51)。
张冬桃(1990-),女,硕士研究生,主要从事茶树种质资源创新与利用研究。
*通讯作者:叶乃兴(1963-),男,教授,研究生导师,主要从事茶树栽培育种与资源利用研究 Email:ynxtea@126.com
