P15基因抑制宫颈癌细胞迁移及侵袭的体外实验研究
2015-03-14宋敬张卓然李越韩世愈
宋敬,张卓然,李越,韩世愈
(1.哈尔滨医科大学附属第四医院,a 妇产科,b药学部,哈尔滨 150001;2.黑龙江省医院妇产科)
·基础研究·
P15基因抑制宫颈癌细胞迁移及侵袭的体外实验研究
宋敬1a,张卓然1b,李越2,韩世愈1a
(1.哈尔滨医科大学附属第四医院,a 妇产科,b药学部,哈尔滨 150001;2.黑龙江省医院妇产科)
[摘要]目的探讨P15基因转染对宫颈癌细胞系Hela细胞迁移和侵袭的影响。方法脂质体介导将pcDNA3.1(+)转染Hela细胞,稳定筛选后用RT-PCR检测转染细胞的P15的表达。根据转染的不同实验分为空白组、空载体转染组及p15 转染组。细胞划痕实验检测P15对Hela细胞迁移的影响;Transwell小室实验检测P15对Hela细胞侵袭的影响。 结果RT-PCR 发现空白组与空载体转染组细胞的p15 基因 mRNA 无表达,p15 转染组细胞p15mRNA 高表达;三组细胞0 h划痕宽度差异无统计学意义(P>0.05),48 h后P15转染组的划痕宽度明显变窄,小于空白组及空载体转染组(P<0.05),空白组及空载体转染组划痕宽度差异无统计学意义(P>0.05)。48 h后P15转染组的穿透细胞数明显少于空白组及空载体转染组(P<0.05),空白组及空载体转染组穿透细胞数比较差异无统计意义(P>0.05)。结论P15能够明显的抑制宫颈癌细胞的迁移与侵袭。
[关键词]宫颈肿瘤;HeLa细胞;转染;细胞运动
宫颈癌是慢性演变过程,多种因素及多种基因参与其中,使宫颈癌的发生及发展呈多步骤、多阶段的过程[1]。宫颈癌细胞侵袭性较强,目前已知其与细胞外基质金属蛋白酶诱导因子、Bcl-2、Caspase、Smac/DIABLO等基因有关,近来研究发现,P15与宫颈癌的发生及进展关系密切。李霞[2]的研究结果显示,P15基因与宫颈癌的浸润、转移及病人的生存期显著相关。P15基因最早研究其在细胞增殖调控中发生负性作用,且在多种器官肿瘤中 P15基因呈现出不同程度的缺失、重排、突变[3-5]。本次研究通过质粒转染P15基因,观察其对宫颈癌细胞的迁移与侵袭性的影响。
1材料与方法
1.1研究材料真核表达质粒 pCMV5-p15(哈尔滨医科大学药学院重点实验室赠),pcDNA3.1(+)-p15(本院实验室克隆),Hela细胞株(上海博谷生物科技有限公司),脂质体Lipofectamine2000(碧云天生物技术研究所),CO2培养箱(Bekman,美国),倒置显微镜及摄像器材(Nikon,日本),Transwell小室(北京博奥森生物技术有限公司)。
1.2方法
1.2.1细胞培养人宫颈癌Hela细胞,培养基为10%小牛血清的1640,环境控制为 37 ℃、5% CO2饱和湿度,1~2 d换液1次,显微镜下观察细胞形态学特征及培养液情况,细胞铺满60%~70%传代,第N+3-+4代用于继续实验。
1.2.2RT-PCR细胞总RNA用TRIzol试剂盒提取,引物序列见表1。反应 35 个循环,56 ℃退火。
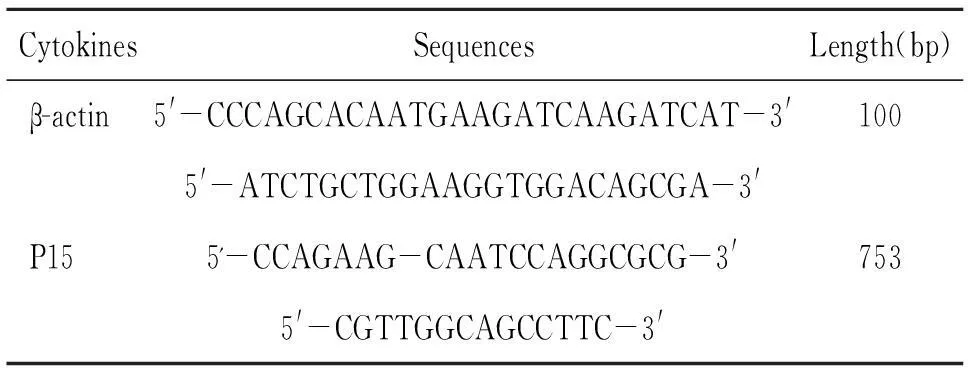
表1 P15及actin的引物序列与长度
1.2.3基因转染
1.2.3.1分组本实验分为 3 组。①空白组:未转染的Hela细胞;②空载体转染组:用pcDNA3.1(+)-neo 质粒转染Hela细胞;③p15 转染组:用pcDNA3.1(+)-p15转染Hela细胞。
1.2.3.2转染方法参照 Lipofectamine2000转染方法进行操作。转染 48 h 后进行培养,3 d后筛选阳性细胞培养,达到稳定转染后进行实验。
1.2.4划痕实验在6孔板背面用marker笔以每1厘米宽度横穿过孔划横线标记,每孔5条线,用直尺标记成平行线,无菌操作接种细胞,选取对数生长的细胞,直尺边缘与标记线重叠,使用无菌枪头比着直尺在板内沿着标记线划痕,用PBS冲洗细胞3遍,加入1 mL无血清1640培养基,放置培养箱中孵育。分别于0 h、48 h时后取样,倒置显微镜下测量划痕宽度,并拍照。
1.2.5Transwell小室实验制备细胞悬液,调整细胞浓度为5×105/mL。包被基底膜:Matrigel胶4℃过夜融化备用,用 4 ℃预冷的无血清1640培养基 1∶3稀释 Matrigel 至终浓度为 1 mg/mL,冰上操作;灭菌枪头包被小室的底部,37 ℃静置1h,使其干成胶状。取细胞悬液200 μL加入Transwell上室,下室加入500 μL的1640培养液,消除培养液与基质胶间的气泡。于48 h时后取样,吸出chamber上室液体,无菌镊子取出chamber,移至800 μL甲醇溶液内,室温固定 30 min。从甲醇溶液中取出 chamber,吸干甲醇溶液,移至800 μL结晶紫染色液中,室温染色 30 min,后用去离子水轻轻冲洗,吸干液体,棉棒擦去chamber上室表面的Matrigel胶。倒置显微镜下随机取 5视野,并计算穿膜细胞数。
1.3统计学处理应用SPPS 17.0统计软件进行数据分析,计数资料采用χ2检验,计量资料采用单因素方差分析。
2结果
2.1Hela细胞 P15 mRNA 表达检测 RT-PCR 发现空白组与空载体转染组细胞的P15 基因 mRNA 无表达,P15 转染组细胞P15mRNA 高表达,见图1。
2.2三组细胞划痕实验结果三组细胞0 h划痕宽度差异无统计学意义,48 h后P15转染组的划痕宽度明显变窄,小于空白组及空载体转染组(P<0.05),空白组及空载体转染组划痕宽度差异无统计学意义(P>0.05)。三组细胞划痕实验结果见图2。
2.3三组细胞Transwell实验结果48 h后P15转染组的穿透细胞数明显少于空白组及空载体转染组(P<0.05),空白组及空载体转染组穿透细胞数比较差异无统计学意义(P>0.05)。三组细胞Transwell小室实验结果见图3。
3讨论
控制肿瘤的转移是提高宫颈癌生存率的主要方法之一[6]。肿瘤的侵袭和转移受多种因素调节,多种基因参与其中。P15基因最早发现是细胞周期调控的关键因子,其主要作用是抑制细胞周期素依赖激酶 4/6(CDK4/6)活性,对细胞增殖周期进行调控。近年来发现P15基因与宫颈癌的发生及进展关系密切。Kim等[7]研究了p15在宫颈癌中的作用,表明P15基因的缺失与宫颈癌关系密切。郑金锋等[8]研究p15蛋白在子宫颈癌中的表达特点,结果显示P15蛋白在宫颈癌组织的表达率为17.07%(7/41),明显低于在正常宫颈组织中的表达率96.67%(29/30),P15蛋白阳性表达率与宫颈癌组织的病理学分级有关,P15与宫颈癌病理学分级存在相关性。说明抑癌基因P15的表达缺失与子宫颈癌的发生、发展和评估子宫颈癌恶性程度具有重要意义。李霞[2]的研究有着相似结果,P15基因产物的阳性表达率为55.6%(20/36),其表达率与宫颈癌病理类型无显著关系,但与宫颈癌的浸润、转移及病人的生存期显著相关,P15基因表达产物可以作为判断宫颈癌预后的指标。本次研究揭示了P15基因与宫颈癌细胞的迁移与侵袭的关系,结果显示,经转染P15的宫颈癌细胞的迁移与侵袭能力明显降低,提示P15基因不但参与了肿瘤的生长周期的调控,更参与了肿瘤的侵润及转移,其有望成为宫颈癌新的治疗途径。
(本文图1~3见插图1-2)
参考文献
[1]Saslow D,Solomon D,Lawson HW,et al.American cancer society,american society for colposcopy and cervical pathology,and american society for clinical pathology screening guidelines for the prevention and early detection of cervical cancer[J].CA Cancer J Clin,2012,62(3):147-172.
[2]李霞.宫颈癌组织中p15基因表达及其生物学意义[J].肿瘤防治研究,2000,27(2):99-100.
[3]Roesler JM,Livingston EH,Srivatsan E,et al.Deletion of P15(MTS2)in head and neck squamous cell carcinomas[J].J Surg Res,1998,77(1):50-54.
[4]Yurakh AO,Ramos D,Calabuig-farinas S,et al.Molecular and immunohistochemical analysis of the prognostic value of cell-cycle regulators in urothelial neoplasms of the bladder[J].Eur Urol,2006,50(3):506-515.
[5]Zhao N,Huang G,Gao L,et al.ECRG1,a novel candidate of tumor suppressor gene in the esophageal carcinoma,triggers a senescent program in NIH3 T3 cells[J].ExpBiol Med,2006,231(1):84-90.
[6]Li D,Cai J,Kuang Y,et al.Surgical-pathologic risk factors of pelvic lymph node metastasis in stage Ib1-IIb cervical cancer[J].Acta Obstet Gynecol Scand,2012,91(7):802-809.
[7]Kim JW,Namkoong SE,Ryu SW,et al.Absence of p15INK4B and p16INK4A gene alterations in primary cervical carcinoma tissues and cell lines with human papillomavirus infection[J].Gynecol Oncol,1998,70(1):75-79.
[8]郑金锋,马淑芳,耿明,等.p16和p15及PCNA在子宫颈癌组织中的表达及临床病理意义[J].中华肿瘤防治杂志,2007,14(4):291-293.
(收稿日期:2014-11-26)
中图分类号:R737.33
文献标识码:A
DOI:10.3969/J.issn.1672-6790.2015.01.018
作者简介:宋敬,副主任医师,Email:hydsysj@126.com
基金项目:黑龙江省青年科学基金资助(QC2013C105)
