第三代芳香化酶抑制剂辅助治疗绝经后乳腺癌疗效与安全性的Meta分析
2015-03-14隆建萍马秀芬毛宏岩独晓燕
隆建萍,马秀芬,毛宏岩,独晓燕
荟萃分析
第三代芳香化酶抑制剂辅助治疗绝经后乳腺癌疗效与安全性的Meta分析
隆建萍,马秀芬,毛宏岩,独晓燕
目的 系统评价第三代芳香化酶抑制剂(AIs)对乳腺癌疗效与安全性的影响。方法 计算机检索CochraneLibrary、PubMed、EMbase、中国生物医学文献数据库、万方数据库等,收集符合纳入标准的研究,检索时限均从建库至2014年10月,并追溯纳入研究的参考文献和手工检索相关会议资料。由2位研究者按照纳入与排除标准独立筛选文献、提取资料和评价质量后,采用RevMan5.2软件进行Meta分析。结果 共纳入11个随机对照研究,Meta分析结果显示,与他莫昔芬相比,AIs初始及序贯治疗方案都能显著提高总生存率(HR=0.91,95%CI0.84~0.99,P=0.04;HR=0.83,95%CI0.73~0.95,P=0.008);无病生存率在AIs初始治疗(HR=0.86,95%CI0.80~0.92,P<0.01)、序贯治疗(HR=0.72,95%CI0.64~0.99,P<0.01)及后续强化治疗方案组(HR=0.62,95%CI0.52~0.74,P<0.01)均有显著提高。AIs组序贯治疗方案骨折发生率略高于他莫昔芬(P=0.05),另2种治疗方案与他昔莫芬无显著差异(P>0.05);AIs治疗方案子宫内膜癌发生率低于他莫昔芬(P<0.01);AIs单药方案血栓发生率低于他莫昔芬,而序贯方案高于他莫昔芬(P<0.01);AIs单药方案及序贯治疗方案心血管不良事件发生率高于他莫昔芬(P<0.01),而后续强化方案与他莫昔芬无显著差异(P>0.05)。结论AIs较他莫昔芬能带来更多的生存获益,其中序贯治疗较起始治疗方案似更有优势;AIs降低了子宫内膜癌的发病率,而骨折、血栓、心血管不良事件等药物不良反应可以预防。
芳香化酶抑制剂;乳腺癌;总生存;无病生存率;药物副作用;系统评价
【DOI】 10.3969 /j.issn.1671-6450.2015.04.019
乳腺癌是女性常见的恶性肿瘤之一,全世界每年新诊断的乳腺癌患者多达130万以上。随着诊疗技术的不断提高,内分泌治疗已成为乳腺癌综合治疗的重要环节[1,2]。第三代芳香化酶抑制剂(AIs)包括非甾体类的阿那曲唑(anastrozole)和来曲唑(letrozole),以及甾体类的依西美坦(exemestane),具有耐受性较好、不良反应较小的特点,在临床上被用于乳腺癌初始治疗、他莫昔芬的序贯或后续强化治疗[3~5]。目前已有许多临床研究报道了AIs对绝经后早期乳腺癌患者的疗效优于他莫昔芬[6],但尚缺乏不同治疗方法的亚组分析及对最新临床研究结果的更新。为此,本研究拟系统评价AIs对绝经后乳腺癌患者疗效及安全性,报道如下。
1 资料与方法
1.1 纳入标准
1.1.1 研究设计: 国内外公开发表的关于AIs治疗绝经后乳腺癌的随机对照研究(RCT),主要有3种临床试验方案:(1)初始治疗。直接比较AIs单药(试验组)和他莫昔芬(对照组)5年疗效差别;(2)序贯治疗。试验组患者初始接受他莫昔芬治疗, 2~3年后改为AIs继续治疗, 对照组继续维持他莫昔芬5年治疗;(3)后续强化治疗。试验组患者接受他莫昔芬5年治疗后, 继续接受AIs强化维持治疗,对照组停止治疗或安慰剂治疗。文种限中、英文。排除标准:非随机对照研究、未对不同治疗方案进行比较、未报道具体临床结果、随访时间不足、数据不完整或质量低的文章。
1.1.2 研究对象: (1)绝经后女性,包括自然绝经、卵巢去势、化疗致停经等;(2)经病理组织学或细胞学检查确诊的乳腺癌术后患者;(3)雌激素受体(ER)和/或孕酮受体(PR)阳性;(4)无局部复发或远处转移病灶。
1.1.3 结局观察指标: 主要结局指标包括:总生存率(OS),无病生存率(DFS);次要结局指标包括:药物相关不良反应,包括骨折、子宫内膜癌、心血管不良事件、血栓形成等。
1.2 检索策略 以“aromatase inhibitors”“anastrozole”“letrozole”“exemestane”“tamoxifen”“breast cancer”为英文检索词,以“芳香化酶抑制剂”“阿那曲唑”“来曲唑”“依西美坦”“ 他莫昔芬”“乳腺癌”“乳腺恶性肿瘤”为中文检索词,计算机检索Cochrane Library、PubMed、EMbase、中国生物医学文献数据库、万方数据库等,收集符合纳入标准的研究,检索时限均为从建库至2014年10月。检索策略采用主题词与自由词相结合的方式,并辅以手工检索会议资料和追溯纳入文献的参考文献。
1.3 资料提取与质量评价 由2名评价员独立提取纳入研究资料,包括试验设计方法、期刊名称、第一作者、出版年、国别、随访时间、总生存率等指标,然后对结果进行交叉核对,对有分歧而难以确定是否纳入的研究通过讨论或与第三位研究员协商确定。采用Cochrane Handbook提供的方法对文献进行质量评价[6]。
1.4 统计学方法 采用Cochrane 协作网提供的RevMan 5.2软件进行Meta分析。对纳入研究进行异质性分析,统计学异质性采用χ2检验,检验水平为α=0.10 ,对无异质性(I2≤50%,P>0.10)的研究结果采用固定效应模型合并效应量,存在异质性(I2>50%,P<0.10)的则采用随机效应模型分析。如研究间异质性太大,无法进行Meta分析时,则进行描述性分析。提取各研究风险比(HR)来表示生存分析的合并干预效应。运用漏斗图对文章的发表偏倚进行判断。
2 结 果
2.1 检索结果及纳入研究的基本特征 初检文献673篇,通过阅读摘要和全文排除后纳入34篇,最后经过认真阅读全文,最终纳入符合标准的11篇研究,共34 070例患者,其中ATAC与IES031两个研究纳入包括激素受体阳性或未知的患者,其余研究纳入患者均为激素受体阳性。纳入研究基本情况见表1。
2.2 纳入研究的方法学质量评价 纳入研究均为多中心随机对照试验,基线基本一致,具有可比性,纳入研究的具体质量评价见表2。
2.3Meta分析结果
2.3.1AIs初始治疗: 共纳入2个研究,Meta分析合并后的总生存率(HR=0.91,95%CI0.84~0.99,P=0.04),无病生存率(HR=0.86,95%CI0.80~0.92,P<0.01),均提示AIs初始治疗方案较他莫昔芬单药治疗更能给绝经后激素受体阳性的乳腺癌患者带来生存获益。见图1。
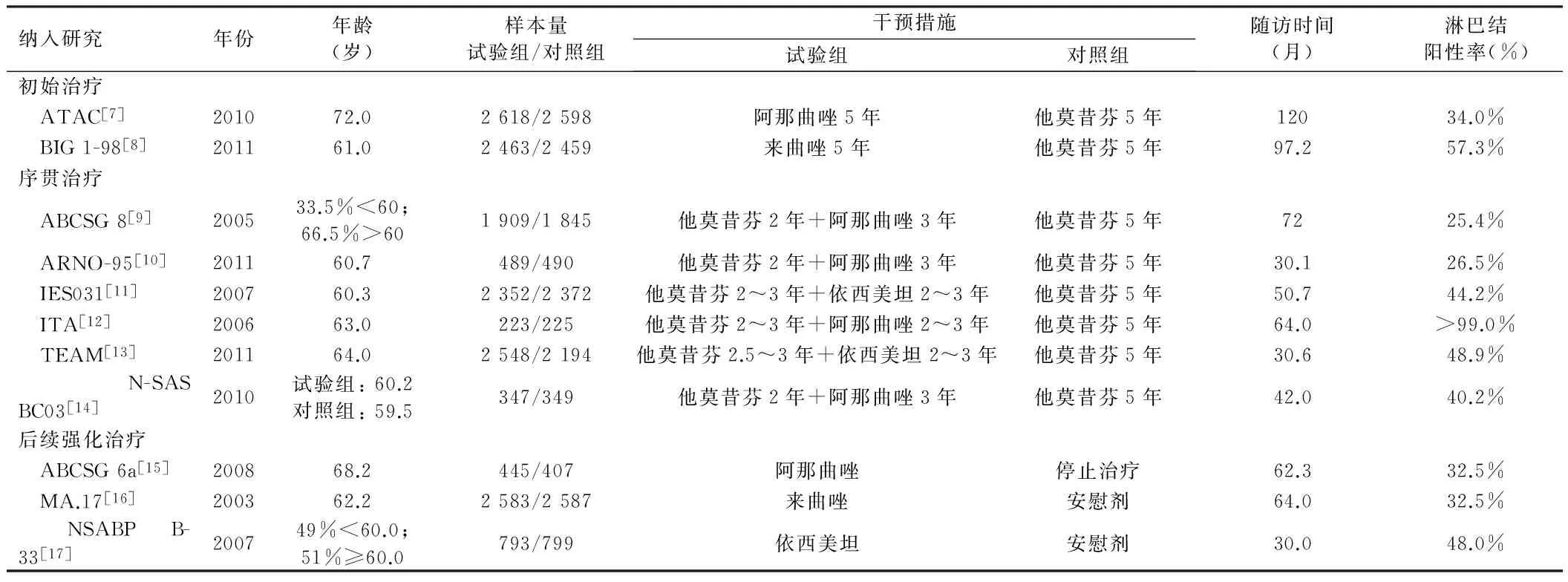
表1 纳入研究的基本情况

表2 纳入研究的方法学质量评价
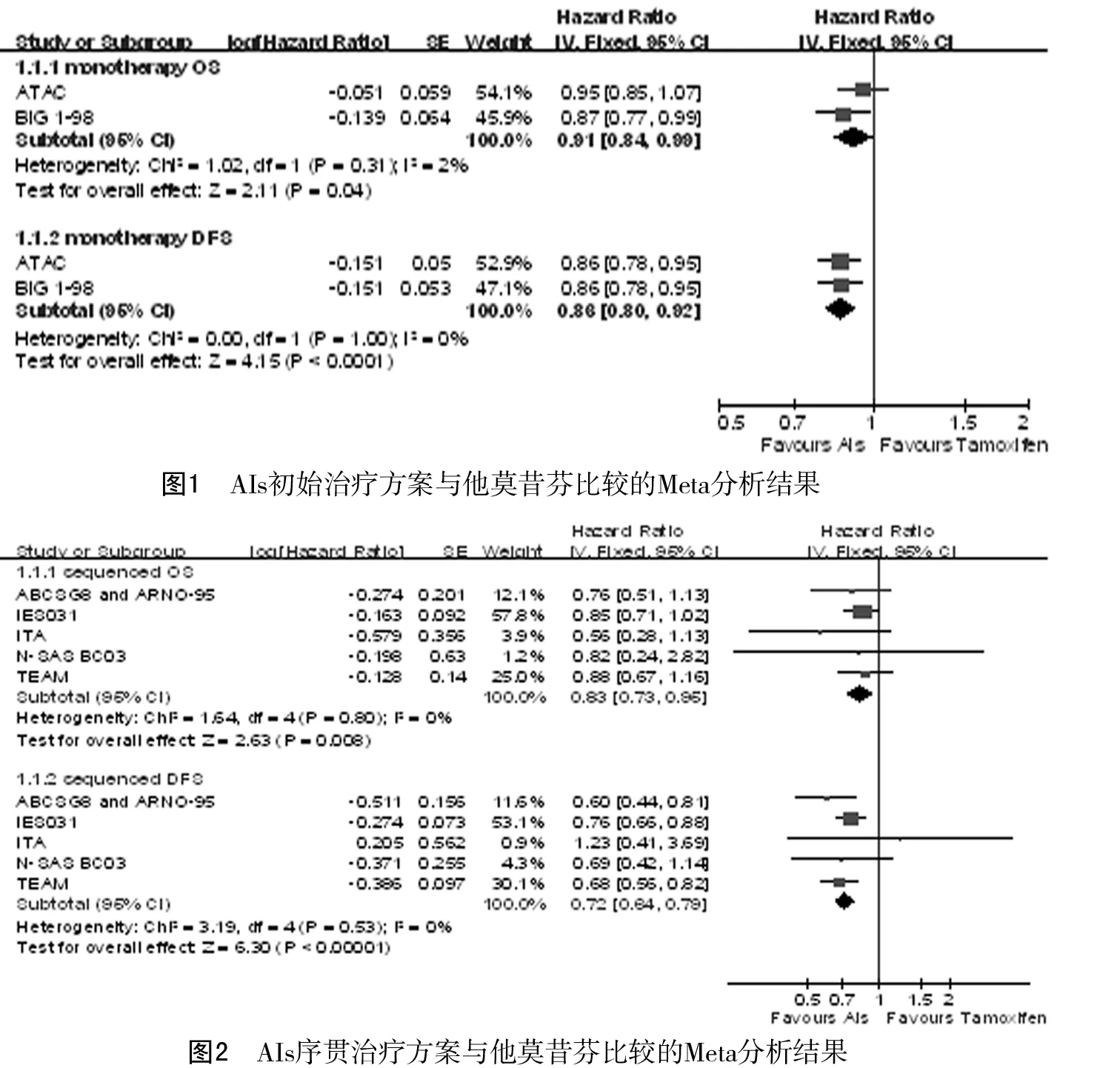
2.3.2AIs序贯治疗: 共纳入6个研究,Meta分析合并后的总生存率(HR=0.83,95%CI0.73~0.95,P=0.008),无病生存率(HR=0.72,95%CI0.64~0.79,P<0.01);以淋巴结是否转移和年龄(>60岁或≤60岁)2个影响预后的高危因素做亚组分析,合并后的无病生存率HR均提示AIs序贯治疗优于他莫昔芬维持治疗,且不受淋巴结转移与年龄因素影响(P<0.05)。见图2~4。2.3.3AIs后续强化治疗: 共纳入3个研究,Meta分析合并后的总生存率(HR=0.87,95%CI0.66~1.16,P=0.34),无病生存率(HR=0.62,95%CI0.52~0.74,P<0.01)。以淋巴结是否转移和年龄(>60岁或≤60岁)2个影响预后的高危因素做亚组分析,合并后的无病生存率HR均提示AIs序贯治疗优于他莫昔芬维持治疗,不受淋巴结转移与年龄因素影响(P<0.05)。见图5~7。
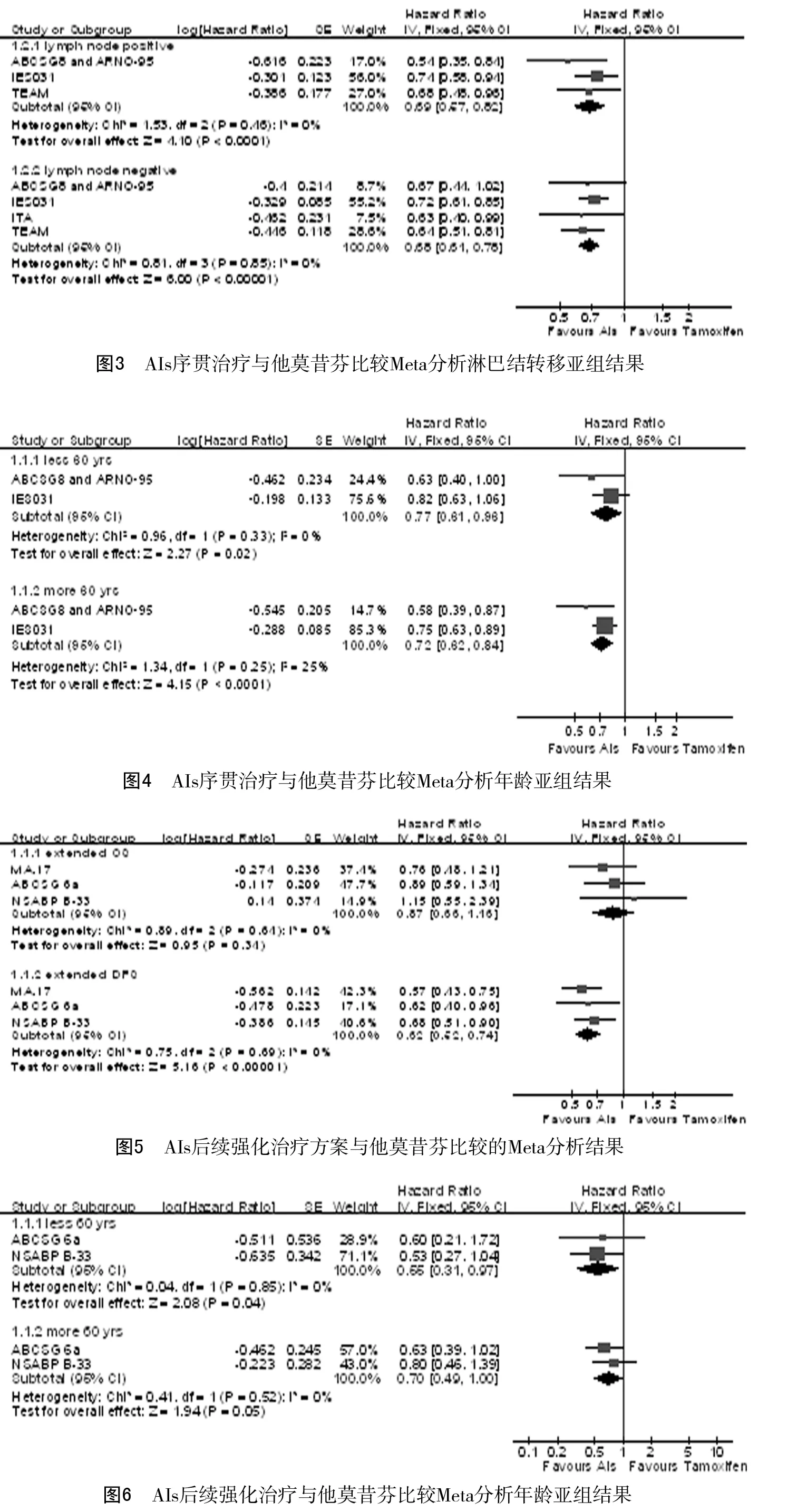
2.3.4 不良反应比较
2.3.4.1 骨折发生率AIs治疗方案与他莫昔芬比较发现,AIs序贯治疗方案骨折发生率高于他莫昔芬(OR=1.30,95%CI1.00~1.69,但P=0.05),仅具有临界劣势;而其他2种治疗方案与他莫昔芬比较无差异(P>0.05)。见表3。
2.3.4.2 子宫内膜癌发生率AIs治疗方案与他莫昔芬比较发现,AIs单药及序贯治疗方案子宫内膜癌发生率明显低于他莫昔芬(OR=0.26,95%CI0.14~0.50,P<0.01);OR=0.31,95%CI0.13~0.76,P=0.01)。见表3。2.3.4.3 血栓发生率AIs治疗方案与他莫昔芬比较发现,AIs单药治疗方案血栓发病率低于他莫昔芬(OR=0.61,95%CI0.50~0.75,P<0.01),而序贯治疗方案血栓发病率高于他莫昔芬(OR=1.89,95%CI1.21~2.95,P<0.01)。见表3。2.3.4.4 心血管不良事件发生率AIs治疗方案与他莫昔芬比较发现,AIs单药及序贯治疗方案心血管不良事件发生率高于他莫昔芬(OR=1.20,95%CI1.02~1.42,P=0.03);OR=1.15,95%CI1.05~1.26,P<0.01),而后续强化治疗方案心血管不良事件发生率与他莫昔芬比较无显著差异(P=0.64)。见表3。
2.3.5 发表偏倚分析: 本研究AIs序贯治疗方案总生存率和无病生存率Meta分析纳入的研究≥5个,漏斗图提示各研究以合并效应量为中心散开分布,存在较小的发表偏倚。见图8。

表3 AIs与他莫昔芬不良反应比较Meta分析结果

不良反应纳入研究异质性检验I2P值Meta分析结果OR(95%CI)P值骨折 起始治疗ATAC,BIG1-9893<0.011.22(0.80~1.97)0.36 序贯治疗ARNO-95,IES031,ITA,N-SASBC03,TEAM00.571.30(1.00~1.69)0.05 后续强化治疗ABCSG6a,MA.17,NSABPB-33160.301.23(0.97~1.56)0.08子宫内膜癌 起始治疗ATAC,BIG1-9800.560.26(0.14~0.50)<0.01 序贯治疗ARNO-95,IES031,N-SASBC03,TEAM00.680.31(0.13~0.76)0.01血栓 起始治疗ATAC,BIG1-9800.940.61(0.50~0.75)<0.01 序贯治疗N-SASBC03,TEAM00.771.89(1.21~2.95)<0.01心血管不良事件 起始治疗ATAC,BIG1-9800.811.20(1.02~1.42)0.03 序贯治疗ARNO-95,IES031,ITA,N-SASBC03,TEAM00.641.15(1.05~1.26)<0.01 后续强化治疗ABCSG6a,MA.17470.171.06(0.84~1.34)0.64
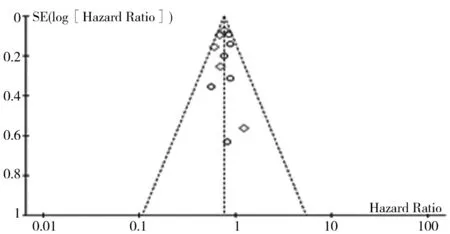
图8 AIs序贯治疗方案Meta分析的漏斗图
3 讨 论
乳腺癌是激素依赖性肿瘤,他莫昔芬曾一度是其主要的内分泌治疗手段,但也存在诸多局限性,如耐药及不良反应等。第三代AIs可通过抑制体内芳香化酶活性,阻断雌激素的合成达到抑制癌细胞生长,逐渐成为乳腺癌辅助内分泌治疗的发展方向。在我国,60%的乳腺癌患者是绝经前发病,有很大一部分患者在他莫昔芬治疗期间进入绝经期,此时是否改为AIs序贯治疗,目前尚无定论。2009年Gibson系统评价发现第三代AIs在改善绝经后妇女乳腺癌的DFS方面优于其他内分泌治疗方式[18],但对OS方面无明显优势;同年程凯等[19]系统评价发现依西美坦在近期肿瘤客观反应率与来曲唑、阿那曲唑的近期疗效相当,在远期疗效方面,依西美坦与他莫昔芬相当;2010年Dowsett等[20]Meta分析发现,与他莫昔芬相比,第三代AIs仅序贯及起始治疗方案显著降低复发率,但在OS及DFS方面无显著差异;由于纳入文献过少及随访时间过短,上述系统评价仍未能明确得出第三代AIs对绝经后乳腺癌患者的疗效与安全性。为此,我们在既往系统评价基础上更新和纳入了BIG1-98、ARNO-95等临床试验的近期研究结果,将结局观察指标锁定为OS及DFS;此外,尽管来曲唑、阿那曲唑及依西美坦均是第三代AIs,但前二者是通过与细胞色素P450酶亚单位的血红蛋白竞争性地结合,而依西美坦则是直接抑制芳香化酶,三者疗效之间可能存在未知差异,但现有的临床证据尚不能证明三者之间存在显著性差异,故我们将第三代AIs作为一个整体来研究,上述研究方法的变动旨在使系统评价的结果更具有临床参考价值。结果发现,第三代AIs序贯及起始治疗方案在OS及DFS方面均优于他莫昔芬,其中序贯治疗较起始治疗方案似更有优势,亚组分析提示年龄及淋巴结转移与否2个危险因素不影响AIs序贯治疗所带来的生存获益,结合我国乳腺癌发病特点,提示在他莫昔芬治疗期间进入绝经期的乳腺癌患者,序贯AIs治疗能带来更多的生存获益。此外,ATLAS临床试验发现,他莫昔芬维持治疗10年比5年能显著降低复发率及乳腺癌病死率[21]。本研究发现AIs后续强化治疗方案在DFS方面较他莫昔芬更有优势,但在OS方面无明显优势,提示他莫昔芬5年治疗后应继续内分泌治疗,但AIs与他莫昔芬孰优孰劣尚无循证依据。
药物不良反应也是权衡乳腺癌内分泌治疗选择的焦点,如他莫昔芬有发生子宫内膜癌、深静脉血栓等潜在风险;而AIs有骨质丢失、心血管不良事件等。本研究发现,骨折方面,AIs序贯治疗方案发生率稍高于他莫昔芬;子宫内膜癌方面,AIs单药及序贯治疗方案发生率明显低于他莫昔芬;血栓形成方面,AIs单药治疗发病率低于他莫昔芬,但序贯治疗方案明显高于他莫昔芬,原因可能是数据收集过少所致。心血管不良事件方面,AIs单药及序贯治疗方案发生率明显高于他莫昔芬。
本研究尚存在诸多局限性:(1)本系统评价缺乏生活质量、经济性评价等重要指标,降低了本研究的临床应用价值;(2)Meta分析基于既往已完成的临床试验,各研究可能存在潜在的临床异质性;(3)初始治疗和后续强化治疗相关研究较少,且采用的药物均不同,降低了结果的可信度;(4)缺乏AIs3种不同治疗方案之间的相互比较。
综上,对于绝经后激素受体阳性的乳腺癌患者,药物选择方面,AIs较他莫昔芬能带来更多的生存获益,其中序贯治疗方案似更有优势;药物不良反应方面,尽管AIs较他莫昔芬带来了更多的骨折、血栓、心血管不良事件,但这些都是可以预防和临床管理的,更为重要的是AIs降低了子宫内膜癌的发病率。AIs对乳腺癌内分泌治疗提供了新的方向,但需进一步的研究予以确认。
1HadjiP,ZillerV,KyvernitakisJ,etal.Persistenceinpatientswithbreastcancertreatedwithtamoxifenoraromataseinhibitors:aretrospectivedatabaseanalysis[J].BreastCancerResTreat,2013,138(1):185-191.
2KostevK,MayU,HogD,etal.AdherenceintamoxifentherapyafterconversiontoarebatepharmaceuticalinbreastcancerpatientsinGermany[J].IntJClinPharmacolTher,2013,51(12):969-975.
3 徐兵河.2013年最重要的乳腺癌研究进展[J/CD].中华乳腺病杂志:电子版,2014,8(1):1-5.
4 张厚云,赵凌云.乳腺癌内分泌治疗研究进展[J].中国普通外科杂志,2014,23(5):680-684.
5BauerschlagDO,MaassN,SchemC.StandardofcareandcontroversiesintheadjuvantendocrinetreatmentofHormone-Responsiveearlybreastcancer[J].BreastCare,2014,9(4):283-286.
6SchmidtN,KostevK,JockwigA,etal.Treatmentpersistenceevaluationoftamoxifenandaromataseinhibitorsinbreastcancerpatientsinearlyandlatestagedisease[J].IntJClinPharmacolTher,2014,52(11):933-939.
7CuzickJ,SestakI,BaumM,etal.Effectofanastrozoleandtamoxifenasadjuvanttreatmentforearly-stagebreastcancer: 10-yearanalysisoftheATACtrial[J].LancetOncol,2010,11(12):1135-1141.
8ReganMM,NevenP,Giobbie-HurderA,etal.Assessmentofletrozoleandtamoxifenaloneandinsequenceforpostmenopausalwomenwithsteroidhormonereceptor-positivebreastcancer:theBIG1-98randomisedclinicaltrialat8·1yearsmedianfollow-up[J].LancetOncol,2011,12(12):1101-1108.
9JakeszR,JonatW,GnantM,etal.Switchingofpostmenopausalwomenwithendocrine-responsiveearlybreastcancertoanastrozoleafter2years'adjuvanttamoxifen:combinedresultsofABCSGtrial8andARNO95trial[J].Lancet,2005,366(9484):455-462.
10ColleoniM,Giobbie-HurderA,ReganMM,etal.AnalysesadjustingforselectivecrossovershowimprovedoverallsurvivalwithadjuvantletrozolecomparedwithtamoxifenintheBIG1-98study[J].JClinOncol,2011,29(9):1117-1124.
11CoombesRC,KilburnLS,SnowdonCF,etal.Survivalandsafetyofexemestaneversustamoxifenafter2-3years'tamoxifentreatment(IntergroupExemestaneStudy):arandomisedcontrolledtrial[J].Lancet,2007,369(9561):559-570.
12BoccardoF,RubagottiA,GuglielminiP,etal.Switchingtoanastrozoleversuscontinuedtamoxifentreatmentofearlybreastcancer.UpdatedresultsoftheItaliantamoxifenanastrozole(ITA)trial[J].AnnOncol,2006,17(7):VII10-VII14.
13VanDeVeldeCJ,ReaD,SeynaeveC,etal.Adjuvanttamoxifenandexemestaneinearlybreastcancer(TEAM):arandomisedphase3trial[J].Lancet,2011,377(9762):321-331.
14AiharaT,TakatsukaY,OhsumiS,etal.PhaseIIIrandomizedadjuvantstudyoftamoxifenaloneversussequentialtamoxifenandanastrozoleinJapanesepostmenopausalwomenwithhormone-responsivebreastcancer:N-SASBC03study[J].BreastCancerResTreat,2010,121(2):379-387.
15MamounasEP,JeongJH,WickerhamD,etal.Benefitfromexemestaneasextendedadjuvanttherapyafter5yearsofadjuvanttamoxifen:Intention-to-treatanalysisoftheNationalSurgicalAdjuvantBreastandBowelProjectB-33trial[J].JClinOncol,2008,26(12):1965-1971.
16GossPE,IngleJN,MartinoS,etal.Arandomizedtrialofletrozoleinpostmenopausalwomenafterfiveyearsoftamoxifentherapyforearly-stagebreastcancer[J].NEnglJMed,2003,349(19):1793-1802.
17KaufmannM,JonatW,HilfrichJ,etal.Improvedoverallsurvivalinpostmenopausalwomenwithearlybreastcancerafteranastrozoleinitiatedaftertreatmentwithtamoxifencomparedwithcontinuedtamoxifen:TheARNO95study[J].JClinOncol,2007,25(19):2664-2670.
18GibsonLJ,DawsonCL,LawrenceDJ,etal.Aromataseinhibitorsfortreatmentofadvancedbreastcancerinpostmenopausalwomen[J].CochraneDatabaseofSystematicReviews,2007,7(1):CD003370.
19 程凯,徐珽,胡海波,等.依西美坦治疗绝经后妇女乳腺癌疗效的系统评价[J].中国循证医学杂志,2009,9(11):1220-1225.
20DowsettM,CuzickJ,IngleJ,etal.Meta-Analysisofbreastcanceroutcomesinadjuvanttrialsofaromataseinhibitorsversustamoxifen[J].JClinOncol,2010,28(3):509-518.
21DaviesC,PanH,GodwinJ,etal.Long-termeffectsofcontinuingadjuvanttamoxifento10yearsversusstoppingat5yearsafterdiagnosisofoestrogenreceptor-positivebreastcancer:Atlas,arandomisedtrial[J].Lancet,2013,381(9869):805-816.
Efficacy and safety of third generation aromatase inhibitors in postmenopausal women with breast cancer: a Meta-analysis
LONGJianping,MAXiufen,MAOHongyan,DUXiaoyan.
FirstDepartmentofBreast,MaternalandChildHealthHospitalofGansu,Lanzhou730050,China
Objective To system evaluate the third generation aromatase inhibitors (AIs) on breast cancer.Methods Computer retrieval of Cochrane Library, PubMed, EMbase, Chinese biomedical literature database, Wanfang database, collected studies that met the inclusion criteria, searched from inception of database to October 2014, and also searched the research references and manually searched relevant meeting 【Abstract】s. According to the inclusion and exclusion criteria, 2 reviewers independently screened literature quality; Meta-analysis was carried out using RevMan 5.2 software.Results 11 randomized controlled studies were enrolled, Meta-analysis results show that, compared with tamoxifen, initial AIs and sequential treatment program can significantly improve overall survival (HR=0.91, 95%CI 0.84-0.99,P=0.04;HR=0.83, 95%CI0.73-0.95,P=0.008);diseasefreesurvivalrateinAIsattheinitialtreatment(HR=0.86, 95%CI0.80-0.92,P<0.01),atsequentialtherapy(HR=0.72, 95%CI0.64-0.99,P<0.01)andfollowingintensivetherapyregimengroup(HR=0.62, 95%CI0.52-0.74,P<0.01)hadimprovedsignificantly.AIsgroupsequentialtreatmentregimenfractureratewasslightlyhigherthanthatoftamoxifen(P=0.05),theother2treatmentschemeshowednosignificantdifferencesfromtamoxifen(P>0.05);theincidenceofendometrialcarcinomainAIswaslowerthantamoxifentreatment(P<0.01);AIssingleregimen’sthrombosisincidencewaslessthantamoxifen,andsequentialschemewashigherthanthatoftamoxifen(P<0.01);AIssingleagentchemotherapyandsequentialtreatment’sadversecardiovasculareventsincidencewashigherthanthatoftamoxifen(P<0.01),andthesubsequentstrengtheningschemeshowednosignificantdifferencefromtamoxifen(P>0.05).Conclusion AIs can bring more survival benefit than tamoxifen, and the sequential therapy seems to be more advantages than initial treatment; AIs reduces the incidence of endometrial cancer, and need to prevent adverse reaction such as fracture, thrombosis, cardiovascular events.
Aromatase inhibitors;Breast cancer;Survival rate;Disease free survival rate;Drug side effects;System review
730050 兰州,甘肃省妇幼保健院乳腺一科
2014-11-21)
