中药大黄对番茄早疫病菌抑菌作用的初步研究*
2015-03-13王艳红贾桂燕葛文中王占斌杨翔宇
王艳红,贾桂燕*,葛文中,王占斌,杨翔宇,张 娣
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆163319;2.泰来县第一中学,黑龙江齐齐哈尔162400)
番茄早疫病是果蔬生产或采后常见病害,也是一种世界性病害,在美国、澳大利亚、以色列、印度、希腊等地发病率都很高,严重时可使产量损失35%~78%[1,2]。目前,用于防治这种病原菌的方法几乎均为化学方法,带来了很多食品安全隐患。同时,长期、大量地使用化学杀菌剂会造成环境污染、病菌产生抗药性等问题,因此,生物防治的研究引起了人们广泛的关注[3]。由于中药材具有副作用小,来源广,价格低廉,较少出现耐药性等优点,使得从中草药中筛选抗菌药物越来越受到国内外学者的广泛重视[4]。因此,研究高效低毒的植物源杀菌剂已成为当今新型杀菌剂创新研究的热点之一[5]。为了寻找抑菌效果显著、来源广泛的生物类杀菌剂,发现多种中药有明显的抑菌效果[6-8],选定大黄等15 种平时较多见的抑菌效果较好的中药材,测定其乙醇提取物对番茄早疫病的抑菌效果。
大黄(Chinese rhubarb)是蓼科多年生草本植物,药用其根及根茎,味苦、性寒,功能泻下攻积、清热泻火、止血解毒、活血祛瘀。是一种很好的清热解毒功效药,具有抑菌作用[9]。本文测定了其对番茄早疫病的最低抑菌浓度、对菌丝生长、孢子萌发的影响等,旨在为研制和开发防治番茄早疫病新型植物源农药提供依据。
1 实验部分
1.1 材料及仪器
1.1.1 供试中药材 青蒿、大青叶、龙胆、板蓝根、苦参、地榆、大黄、甘草、黄连、川楝子、苦楝皮、白鲜皮、黑胡椒、细辛、苍耳子均购于大庆福瑞邦医药公司。
1.1.2 供试菌种及试剂 番茄早疫病菌(Alternaria solani)由黑龙江八一农垦大学生命学院微生物教研室提供;所用试剂均为分析纯。
1.1.3 仪器设备
天平(上海精科天平);水浴锅(上海亚荣生化仪器厂);旋转蒸发仪(上海亚荣生化仪器厂);FA24N 型电子天平(上海越平科学仪器有限公司);HWS24 型电热恒温水浴锅(上海一恒科技有限公司);SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);恒温培养箱(上海福玛实验设备有限公司);HZQ-R 空气浴振荡器(中国哈尔滨东联电子技术开发有限公司)。
1.2 实验方法
1.2.1 中药材提取物的制备 将1.1.1 项下各中药粉碎,过20 目筛,分别称取50g 至1000mL 圆底烧瓶中,加入95%的乙醇500mL,浸泡8h,80℃水浴加热,回流提取2h,减压抽滤,重复上述提取过程3次,合并滤液,旋转蒸发浓缩至小体积[10],用50%乙醇定容至200mL,生药浓度为0.25g·mL-1保存,备用。
各中药材提取物编号为:(1)青蒿、(2)大青叶、(3)龙胆、(4)50%乙醇、(5)板蓝根、(6)苦参、(7)地榆、(8)大黄、(9)甘草、(10)黄连、(11)川楝子、(12)苦楝皮、(13)白鲜皮、(14)黑胡椒、(15)细辛、(16)苍耳子。(4)为对照实验。
1.2.2 马铃薯培养基的制备 按着参考文献[11]进行马铃薯培养基(PDA)的制备。
1.2.3 番茄早疫病孢子悬液的制备 按参考文献[13]的方法,将1.1.2 项的供试菌种在无菌条件下接入PDA 培养基中,恒温25℃培养,连续培养几代后,在试验前3~5d 再接种1 次培养备用。
上述菌种在PDA 平板上培养7d 后,注入4℃无菌水,用灭菌毛刷轻轻刮除气生菌丝,20~22℃培养箱中干燥,6h 后即可形成大量的分生孢子,用无菌水洗下孢子,制备成孢子悬液(1×106~107个·mL-1),备用。
1.2.4 供试15 种中药材抑菌率的测定 将100mL固体PDA 培养基用微波炉融化后,冷却至40℃左右,无菌操作条件下将待测菌株孢子悬液5mL 加入培养基中,振荡混匀后倒入15cm×20cm 的平板内,厚度约3.50mm,培养基凝固后均匀摆放牛津杯,每杯加入中药材提取液200uL,做好药物标记,每种药液设3 个平板。将平板置于28℃培养箱中培养48 h,观察并用十字交叉法测定抑菌圈直径[12],按下列公式计算抑菌率[13]。

1.2.5 大黄最低抑菌浓度的测定 将大黄母液(生药浓度为0.25g·mL-1)稀释,分别稀释为母液浓度的1/2、1/4、1/8、1/16、1/32、1/64(0.125、0.0625、0.03125、0.015625、0.0078125g·mL-1、0.00390625)将大黄母液编为1 号,其他稀释液按顺序编至2~7 号,以50%的乙醇为对照,并记为8 号。按2.4 中方法将8 个牛津杯均匀摆放在固体培养基中,每杯加入1~8 号液体200μL,做好标记,以下步骤同1.2.4。
1.2.6 大黄药液抑制菌丝生长的测定 无菌操作下将4mL 大黄母液加入100mL 液体PDA 中,冷却至40℃左右时分别接入1mL 2.3 项下制备的孢子悬液,50%乙醇为对照,放入空气浴振荡器中,25℃震荡培养,2d 后取出一瓶,之后每隔1d 取出一瓶,并做好标记1~5 号,减压抽滤,所得菌丝放入50℃烘箱中烘干至恒重,称量。以上操作过程重复3 次。
1.2.7 大黄药液抑制孢子萌发的测定 把按1.2.3项下操作所得的番茄早疫孢子悬液配制成l00 倍显微镜下每视野30~40 个孢子的浓度,将大黄母液稀释至原药液浓度的1/16 与上述孢子悬浮液以1∶l 配比混合,分别吸取100μL 置于脱脂棉保湿的培养皿中的凹玻片上,50%乙醇为对照处理组,28℃暗箱培养。4h 后镜检各处理的孢子萌发情况[14],以后每小时镜检一次,至对照完全萌发。
2 实验结果
2.1 供试中药材对番茄早疫病的抑菌率
供试的15 种中药材的95%乙醇提取物对番茄早疫病菌均有不同程度的抑制作用,其中黄连和大黄的抑菌效果最好,大黄的抑菌率高达93.9%,除龙胆外,其他14 种中药材的乙醇提取物的抑制率也均达到80%以上(见表1),因此选大黄进行后续试验。

表1 15 种中药材对番茄早疫病菌的抑菌率Tab.1 Inhibition rate of 15 kinds of Chinese herbal medicines on Alternaria solani
2.2 大黄拮抗番茄早疫病的最低抑菌浓度
不同浓度大黄药液对番茄早疫病菌的抑制率,具体结果见表2。

表2 不同浓度的大黄对番茄早疫病的抑菌率Tab.2 Inhibition rate of different concentrations of rhubarb on Alternaria solani
由表2 可知,大黄药液随浓度降低,其抑制番茄早疫病的抑菌率降低,最低抑菌浓度为0.015625g·mL-1,当把大黄稀释到0.0078125g·mL-1时,大黄几乎不具有抑菌能力。
2.3 不同培养时间大黄对番茄早疫病菌丝干重的影响
不同培养时间大黄处理组(药液母液浓度为0.25g·mL-1)及对照组的番茄早疫病菌的菌丝干重,结果如图1。

图1 不同培养时间大黄母液及对照处理的菌丝干重Fig.1 Rheum and control treatment on mycelium dry weight at different time
由图1 可见,大黄对菌丝的生长有很强的抑制作用,50%乙醇对照处理组,菌丝生长的最旺盛期在第4d,大黄母液处理组,菌丝生长的最旺盛期在第5d,延迟了番茄早疫菌生长旺盛期的到来。
2.4 大黄药液对番茄早疫病菌孢子萌发的抑制作用
大黄药液处理4h 后,番茄早疫病菌孢子基本无变化,少数孢子产生不明显的芽管,孢子与芽管交接处呈不正常肿大,对照组萌发率为50%。延长培养时间,处理12h 后观察,对照处理组孢子萌发达95%以上,菌丝长度达孢子长度10 倍以上,大黄药液处理的孢子萌发率仅为4.75%,且与对照组比(如图2 中B),大黄药液处理的孢子畸形,多为成串或成堆的囊泡,少数产生芽管,但较短,一般为孢子长度的二分之一,极少数芽管与孢子等长(如图2中A)。
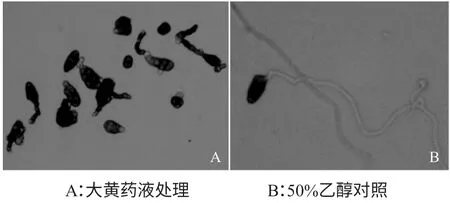
图2 大黄药液处理12h 后番茄早疫病菌孢子萌发形态Fig.2 Spore germination morphology of Alternaria solani by rheum treatment after 12 hours
3 结论
本论文所考察的15 种中药材乙醇提取物对番茄早疫病均有一定的抑制作用,其中中药黄连作用最强,大黄次之,大黄的抑制率达93.9%,且除龙胆外其他14 种中药材的乙醇提取物的抑制率均达到80%以上。虽然数据显示黄连的抑菌作用最强,但本文对大黄进行了深入实验,主要因为大黄的抑制作用较为稳定。参照文献可以得出,黄连在48h 后抑菌圈的直径会逐渐变小,但大黄的抑菌圈直径会基本保持不变。不同培养时间的大黄乙醇提取液对番茄早疫病菌菌丝也有不同的抑制作用,大黄可以延迟菌丝的生长旺期,同时大黄的乙醇提取液对孢子萌发也具有较强的抑制作用。
中药材有上千种,本实验只选取了其中的15种进行研究,主要因为这15 种药材价格低廉,容易获得,而且它们的抑菌作用也较强。中药材活性成分复杂,提取方法和所用溶剂不同,提取物中化学成分亦不同,本实验中的试剂也只采用了95%的乙醇作提取溶剂,没有进行甲醇、丙酮等溶剂的提取,因而提取物的活性成分不一定有代表性,尚有许多基础研究有待开展。现如今,中药抑菌作用的研究方法和手段也在不断改善和提高,但目前对中药抗菌作用的研究多局限于体外,体内的研究较少。“血清药理学”的提出,将使中药抗菌作用的研究进一步深入到体内,从而推动抗菌中药的研究和开发[15]。
[1]肖娱玉,曲一凡,张琪,等.番茄早疫病菌生物学特性研究[J].江苏农业科学,2010,(3):144-146.
[2]Reni Chaerani,Roeland E,Voorrips.Tomato early blight(Alternaria solani):the pathogen,genetics,and breeding for resistance[J].Journal of General Plant Pathology,2006,72:335-347.
[3]丘麒,罗建军,郝卫宁,等.21 种植物提取物对番茄早疫病菌等3 种病原菌抑菌活性的初步研究[J].安徽农业科学,2008,36(17):7306-7307;7311.
[4]杨淑文.32 种中草药抑菌活性的比较研究[J].安徽农业科学,2011,39(3):1361-1366.
[5]王连平,王汉荣,茹水江,等.浙江省番茄早疫病菌生物学特性研究[J].浙江农业学报,2002,14(6):320-325.
[6]毕亚玲,王波,黄保宏,等.2 种中药提取物对番茄灰雷病菌和番茄早疫病菌的抑制活性研究[J].安徽农业科学,2011,39(25):15309-15310;15313.
[7]李永刚,文景芝.中草药水提取物抑菌活性的测定[J].东北农业大学学报,2003,34(4):368-371.
[8]张从宇,朱向阳,王泽河.中草药提取物对植物病菌抑制和病害防治作用[J].安徽科技学院学报,2007,21(6):16-18.
[9]雷载权.中药学[M].上海:上海科学技术出版社,l995:98-99.
[10]张晶,陈全成,弓晓杰,等.不同提取方法对人参皂苷提取率的影响[J].吉林农业大学学报,2003,25(1):71-72.
[11]李顺鹏.微生物学实验指导[M].北京:中国农业出版社,2003:64-65.
[12]方仲达. 植病研究方法[M]. 北京:中国农业出版社,l998:198-202.
[13]刘洋,王飞,田治国,等.8 种园林草本植物挥发性物质的抑菌效果研究[J].西北农林科技大学学报,2009,37(3):141-145.
[14]张志清,刘剑,李娟.中药抑菌作用研究进展[J].中药材,2002,25(9):688-690.
