生殖支原体MG 427原核表达载体的构建和鉴定
2015-03-12周俊陈列松游晓星曾焱华吴移谋
周俊 陈列松 游晓星 曾焱华 吴移谋
生殖支原体(mycoplasma genitalium,Mg),是迄今发现能进行自我复制的最小的原核微生物,透射免疫电镜已证实Mg在宫颈上皮细胞内完整存在,在细胞培养模型中,M g能快速地粘附到上皮细胞,定植于细胞内,产生强烈的细胞免疫。M g侵入人类靶细胞后,导致宿主细胞持续性慢性致病,且症状隐蔽或无症状,可能其具有一系列的自身抵抗氧化应激的机制来确保其持续性感染和致病。先前有报道氧化修复酶蛋氨酸亚砜还原剂A(M srA)在氧化应激中能保护生殖支原体(M g)[1],近年来发现,过氧化物酶基因家族中的有机氢过氧化物抗性蛋白(Oh r),烷基氢过氧化物还原酶(AHPR)及渗透压诱导蛋白C(Osm C)分布于各种病原体,在感染部位将有机氧化物变为醇类的解毒过程中发挥了重要作用。同样地,生殖支原体基因组中也发现了相应的Oh r/Osm C同系物[2-3],作为渗透压调节器系统被广泛研究的Osm C直到最近发现与Oh r相似性后才揭示其功能,有学者认为部分Osm C蛋白与Oh r一样,能在体外降解H2O2和有机氢过氧化物[4-5]。生殖支原体MG 427是否有其类似功能,国内外研究甚少,本研究利用重组DNA技术构建了原核表达载体pGEX-6 p-1/MG 427,从而为进一步研究Osm C样蛋白,阐明Mg的致病机制奠定基础。
1 材料与方法
1.1 主要试剂 Mg-G 37标准株、pGEX-6 p-1载体及E.coliJM 109均为南华大学病原微生物研究所保存。细菌DNA提取及纯化试剂盒、质粒提取试剂盒、基因定点突变试剂盒为美国Axygen产品;Taq DNA聚合酶、限制性内切酶BamHI与NotI、T 4连接酶购自美国NEB公司;
1.2 细菌基因组DNA提取及MG 427扩增 采用细菌基因组DNA提取试剂盒从培养好的Mg标准株G 37中提取基因组DNA。从Gen Bank中获取mg427全基因序列,依据pGEX 6p-1载体上的多克隆酶切位点设计mg427基因的特异性引物。P 1:CGGAT AAA AAA TAC GAT ATC ACA,P 2: AAGGAAAAAATTA GTG GAC TAA AGT AAC GCT A。按94℃预变性5m in; 94℃变性30 s;55℃退火45 s;72℃延伸60 s;共35个循环的参数进行PCR扩增;末次循环后72℃延伸5m in,终止反应。琼脂糖凝胶中电泳并在紫外灯下观察,将产物纯化回收保存。
1.3 PCR产物和pGEX-6 p-1空载体的酶切 双酶切总体积为40.0μL,均含: 10×NEB bu ffer 3 4.0μL;100×BSA 0.4μL;BamHI 1.0μL;NotI 1.0μL;其中PCR双酶切体系中加mg427纯化产物10.0μL;d d H2O 23.6μL; pGEX-6 p-1载体双酶切体系中加PGEX-6P-1 15μL;ddH2O 18.6μL;然后分别置入37℃水浴箱中,保温酶切12 h。取酶切后于1.7%的琼脂糖凝胶上电泳,紫外灯下观察目的条带并回收纯化目的片段。
1.4 原核表达重组体pGEX-6 p-1/MG 427的构建 将纯化好的pGEX-6 p-1双酶切产物 2.5μL与mg 427PCR纯化产物6.0μL,加入T 4 DNA Linkage 0.5μL、T 4 buffer 1.0μL;置于22℃水循环仪中,连接30m in。之后转化至宿主E.coliJM 109构建pGEX-6 p-1/MG 427,经培养筛选阳性克隆对重组体进行扩增、双酶切及测序鉴定。
1.5 PCR介导的定点突变 在mg 427基因序列中第289~291位核苷酸所组成的密码子为TGA,为确保其在E.coli中表达,将其同义突变为TGG,突变引物如下:TB 1:5′—CGT GAA CTT AAC ATT CAC TGG GAA ATT CAC TCT CCT AAT G—3′,TB 2:5′—C ATT AGG AGA GTG AAT TTCGTG AAT GTT AAG TTC ACG—3 ,突变扩增条件如下:95℃ 30 s;95℃ 50 s,55℃ 40 s,68℃ 5m in,共12个循环,68℃补全延伸10m in,4℃保存。在反应体系中加1μLDpnI限制性内切酶37℃下恒温水浴箱孵育1 h消化目板质粒DNA。将突变好的产物转化感受态E.coliXL-Blue。筛选阳性克隆对重组体进行双酶切及测序鉴定。
2 结果
2.1mg 427基因的扩增 用特异性引物扩增MG-37标准株目的基因mg427,获得约426 bp大小条带,与目的片段大小一致。见图1。
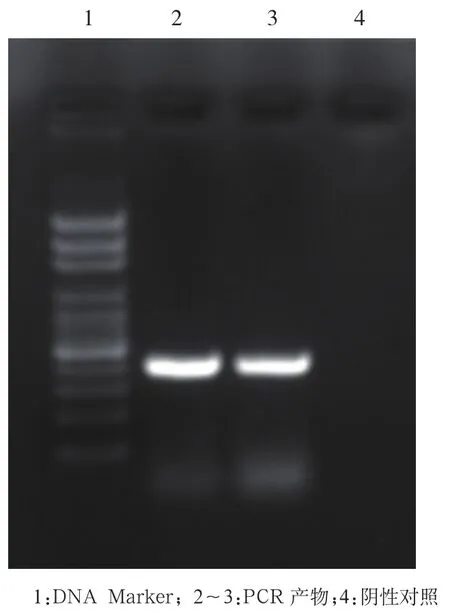
图1 琼脂糖电泳分析mg427 PCR扩增结果
2.2 pGEX-6 p-1/MG 427重组质粒的鉴定 PCR扩增重组好的pGEX-6 p-1/MG 427质粒也可获得约426 bp的片段;经BamHI和NotI双酶切重组质粒,结果经琼脂糖凝胶电泳,在紫外线下可见:大片段接近5000 bp,小片段与目的基因长度426 bp相近,初步证明mg427目的基因成功地嵌入pGEX-6 p-1 载体中。见图2。
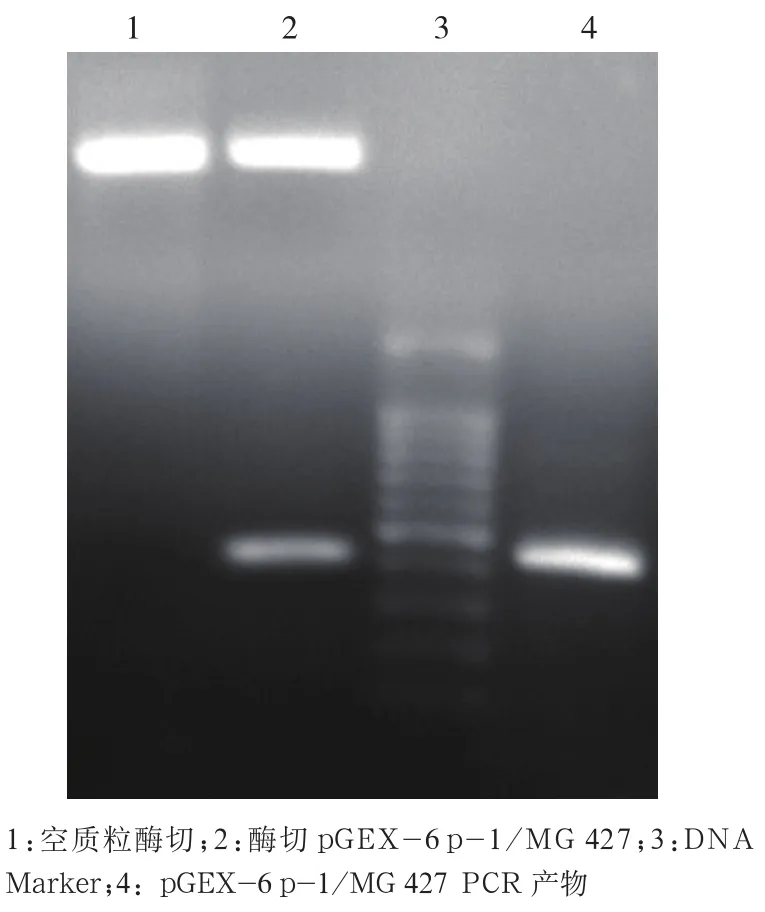
图2 重组质粒pGEX-6 p-1/MG 427的酶切与PCR鉴定
2.3 重组质粒目的基因测序 将重组质粒送上海生工进行DNA序列测定,测序结果与GenBank所登录的Mg G 37的mg 427序列进行blast,结果显示二者完全一致,且密码子读码框架正确。
2.4 PCR介导的定点突变后目的基因测序 将突变后的重组质粒进行测序,测序结果与GenBank所登录的Mg G 37的mg 427序列进行blast,在mg 427基因序列中第289~291位核苷酸所组成的密码子为TGA突变为TGG,整个核苷酸序列未发生缺失、错配、移码。
3 讨论
支原体的致病机制主要包括掠夺宿主细胞营养成分、黏附或融合以及免疫病理引起的损伤。当支原体感染宿主细胞后,能在原发部位产生ROS,包括超氧化物、H2O2以及有机氢过氧化物等(OHPS)[6-7],这些物质作用于DNA碱基或磷酸核糖部分,可引起病原体DNA不可逆的损伤[8-9],这要求支原体必须具备某些保护性机制以防止宿主对自身损伤,以维持其入侵宿主细胞,并能在在宿主内形成慢性感染的过程中具有非常重要的意义。通过我们前期的生物信息学研究,发现在Mg种系群中也有Osm C的基因同源编码序列mg 427存在,然而其功能目前尚未明了。
本研究以Mg G 37基因组DNA为模板,PCR扩增出mg 427基因序列,同时选用pGEX-6 P-1为表达载体,构建pGEX-6 p-1/mg 427重组质粒。由于Mg的一个重要的分子生物学特征是在其转录翻译过程中以TGA作为色氨酸的密码子,而在E.coli中TGA却是转录终止的信号,这影响了Mg基因在E.coli中的表达。我们利用单点突变技术将TGA特异性突变为TGG。突变筛选后再行测序鉴定,确使该基因全序列在大肠埃希菌中得以高效表达。通过对重组质粒进行酶切鉴定和进一步的核苷酸序列分析,证实了插入序列与目的基因的一致性及读码框正确。在成功构建原核表达载体pGEX-6 p-1/mg 427后,为后续进一步研究生殖支原体的致症机制提供了可能。
[1] Dhandayuthapani S,Blaylock MW,Bebear CM,et al.Peptide methionine sulfoxide reductase (MsrA) is a virulence determinant in Mycoplasma genitalium[J].JBacteriol,2001,183:5645-5650.
[2] Zhang W,Baseman JB.Functional characterization of osmotically inducible protein C (MG_427) from Mycoplasma genitalium[J].J Bacteri ol,2014,196(5):1012-1019.
[3] Caswell CC,Baumgartner JE,Martin DW,et al.Characterization of the organic hydroperoxide resistance system of Brucella abortus 2308[J].J Ba cteriol,2012,194(18):5065-5072.
[4] Saikolappan S,Das K,Sasindran SJ,et al.OsmC proteins of Mycobacterium tuberculosis and Mycobacterium smegmatis protect against organic hydroperoxide stress[J].Tuberculosis (Edinb),2011,91(1):S119-S127.
[5] Ta P,Buchmeier N,Newton GL,et al.Organic hydroperoxide resistance protein and ergothioneine compensate for loss of mycothiol in Mycobacterium smegmatis mutants[J].J Bacteri ol,2011,193(8):1981-1990.
[6] Machado CX 1,Pinto PM,Zaha A,et al.A peroxiredoxin from Mycoplasma hyopneumoniae with a possible role in H2O2 detoxification[J].Microbiolog y,2009,155(Pt 10):3411-3419.
[7] Sornchuer P,Namchaiw P,Kerdwong J,et al.Copper chloride induces antioxidant gene expression but reduces ability to mediate H 2O2 toxicity in Xanthomonas campestris[J].Microbiology,2014,160(Pt 2):458-466.
[8] Chen Z,Lu M,Zhuang G,et al.Enhanced bacterial biosensor for fast and sensitive detection of oxidatively DNA damaging agents[J].Anal Chem,2011,83(9):3248-3251.
[9] Fontenelle C,Blanco C,Arrieta M,et al.Resistance to organic hydroperoxides requiresohr and ohrR genes in Sinorhizobium meliloti[J].BMC Microbiol,2011(11):100-107.
