特立帕肽对老年去卵巢大鼠血管钙化的影响
2015-03-11陈斌花陈秋霞姜醒华
陈斌花+陈秋霞+姜醒华


[摘要] 目的 观察特立帕肽对老年去卵巢大鼠血管钙化的影响,并探讨其发挥作用的分子机制。 方法 用30只10个月龄SD大鼠,随机分为3组:假手术组、去卵巢组及特立帕肽治疗组。特立帕肽治疗组给予20 μg/kg特立帕肽皮下注射,隔天1次,持续12周。术前及给药期间收集大鼠血清,给药结束后观察子宫的组织学变化。酶联免疫吸附法(ELISA)检测血中未羧化基质羧基谷氨酸蛋白(uc-MGP)的量及雌激素的变化;原子分光光度计测量血管总钙含量;Von Kossa染色观察动脉钙化;免疫组化法观察血管uc-MGP的表达;荧光实时定量PCR扩增MGP mRNA,观察其在胸主动脉的表达水平。 结果 血清中uc-MGP含量去卵巢组最高,特立帕肽治疗组其次,假手术组最低(P<0.05)。去卵巢组及特立帕肽治疗组雌激素水平明显下降(P<0.05)。去卵巢组血管总钙含量明显高于假手术组(P<0.01),特立帕肽治疗组明显低于去卵巢组(P<0.01)。血管未羧化MGP表达出现在血管钙化周围区域,钙化严重组表达较多。特立帕肽治疗组阳性较少表达。去卵巢组表达量最低,假手术组MGP mRNA表达量最高,特立帕肽治疗组表达量介于两者之间,差异有统计学意义(P<0.01)。 结论 特立帕肽对绝经后血管钙化有改善作用,可能是通过调节MGP的基因表达及活性发挥作用。
[关键词] 特立帕肽;MGP;去卵巢大鼠;血管钙化
[中图分类号] R982 [文献标识码] A [文章编号] 1674-4721(2015)01(c)-0004-05
骨质疏松和血管钙化的发病率逐渐升高,给社会和人类造成极大的危害。近期,Lampropoulos等[1]研究表明,绝经后女性骨质疏松和血管钙化可同时出现,且具有相关性。血管钙化是高度可调控、与骨质形成相似的细胞生物学过程,血管钙化和骨质疏松的发病在流行病学、分子生物学、细胞生物学、遗传学和影像学研究均表明具有共同的机制[2]。
近年来,对骨质疏松症的治疗有了明显的进展,临床所用的药物主要是抗骨吸收,而甲状旁腺激素(parathyroid hormone,PTH)是唯一刺激骨形成的治疗药物。PTH是由84个氨基酸残基组成的一条直链多肽分子,在骨稳态的调节过程中发挥重要作用,具有促骨吸收和促骨形成的作用,生物效应依赖于PTH的作用模式,小剂量间断使用促进骨形成,持续使用则引起骨丢失。2002年11月重组人甲状腺激素rPTH(1-34)产品特立帕肽(teriparatide,Forteo)获美国FDA批准用于治疗骨质疏松症。有研究显示,特立帕肽可以改善高糖诱导大血管的血管钙化[3],而特立帕肽对女性绝经后骨质疏松同时高发血管钙化的影响尚未见报道,本研究探讨特立帕肽对老年去卵巢大鼠血管钙化的影响及初步机制。
1 材料与方法
1.1 材料
10个月龄Sprague-Dawly(SD)雌性大鼠(购自南京大学模式动物研究所);特立帕肽注射液(购自上海市嘉瑞医药有限公司);大鼠未羧化基质γ羧基谷氨酸蛋白(uc-MGP)定量检测试剂盒(购自北京方程生物科技有限公司);基质γ羧基谷氨酸蛋白(未羧化)一抗(Abcam);超敏二步法免疫组化检测试剂盒(北京中山金桥生物有限公司);酶标仪(北京普天新桥技术有限公司);原子分光光度计(上海光谱仪器有限公司);PRISM 7500 PCR仪(美国ABI公司);Prime Script RT reagent Kit(Perfect Real Time)(DRR037S)、Premix Ex Taq(Perfect Real Time)(DRR039A)、PCR配套试剂(购自上海机康生物技术有限公司);其余试剂均为市售分析纯。
1.2 实验分组及动物模型构建
30只SD雌性大鼠适应性喂养2周后,随机分为假手术组(n=10)与模型组(n=20),大鼠用戊巴比妥钠溶液(浓度3%,按0.1 ml/100 g计量)腹腔注射麻醉,俯卧位,切除卵巢。假手术组仅切除卵巢周约卵巢大小的部分脂肪。手术1周后将模型组随机分为去卵巢组(单纯去卵巢)和特立帕肽治疗组(去卵巢后特立帕肽干预治疗)。
1.3 药物干预及标本收集
特立帕肽治疗组给予20 μg/kg皮下注射,隔天1次,持续12周。术前及术后隔两周眼眶静脉丛取血,共收集5次。实验动物于13周末麻醉后开腹取胸腹主动脉全长,主动脉弓下约2 cm于-80℃冰箱保存,再向下截取1 cm保存于4%多聚甲醛固定液中。
1.4 ELISA测定血清中uc-MGP含量及雌激素水平
5次血清uc-MGP含量及手术前和实验结束时血中雌激素水平按照试剂盒说明书进行,在酶标仪(波长450 nm)测定样本吸光度,根据标准曲线计算各样本中uc-MGP及雌激素的含量,所有标本集中检测。
1.5 血管总钙含量测定[4]
胸主动脉(约1 cm)80℃烤干,称重,加入2 mol/L硝酸3 ml,18℃消化并烤干,冷却后加入去离子水(含27 nmol/L的氯化钾和27 μmol/L的氯化镧)10 ml复溶,取2 ml加入1%氯化锶100 μl,原子吸收分光光度计测吸光度(波长422.7 nm),测定组织的钙含量[nmol/(mg·pr)]。
1.6 血管Von Kossa染色[4]
血管组织进行石蜡包埋、切片,行常规脱腊、脱水后浸入5%的硝酸银溶液中,日光照射60 min,再用3%的硫代硫酸钠溶液处理5 min定影,碱性品红复染、脱水、透明、封片。
1.7 免疫组化检测uc-MGP的表达量
取上述石蜡切片脱蜡脱水,抗原修复后,滴加正常兔血清封闭液,室温孵育30 min;滴加兔抗大鼠uc-MGP多克隆抗体(1∶400),4℃过夜;滴加二抗,37℃孵育1 h;滴加DAB显色液;苏木素复染,1%盐酸酒精分化,稀氨水返蓝,梯度酒精脱水干燥封片,镜下观察。
1.8 Taq Man探针法荧光定量PCR检测大鼠血管中MGP mRNA的转录水平
按Trizol RNA提取试剂盒说明书步骤提取组织总RAN,用核酸分析仪测定RNA浓度和纯度,OD260/280为1.8~2.0。立即反转录合成cDNA:取2 μl RNA样本,反应体系20 μl,反应条件:37℃ 15 min,85℃ 5s,1个循环。取2 μl cDNA模板进行目的基因MGP和内参基因GAPDH的PCR扩增。引物及探针均由上海机康生物技术有限公司设计合成。MGP引物序列:上游引物3′-GCATCTAGTCCCGCATCGC-5′,下游引物3′-CAATGCCTCAGACCAAAGTATAAGG-5′,探针序列:3′-(Eclipse)GACTTCATCGCCAACATCCGCCGCA-5′(FAM);GAPDH序列:上游引物 3′-TCAGTATGACCTTGTACATCTGGT-5′,下游引物3′-CTCTAGGGCGATTGTAGTTTACC-5′。探针序列:3′-(Eclipse)TGA-CACGGCAACTTGAACGGCACC-5′(FAM)。PCR反应体系:Premix Ex TaqTM(1×)25 μl,MGP上下游引物(10 μmol/L)各1.0 μl,荧光探针溶液2.0 μl,ROX Reference Dye(50×)1.0 μl,DNA模板2.0 μl,灭菌蒸馏水16.0 μl,总反应体系为50.0 μl;内参基因GAPDH优化后的反应体系:Premix Ex TaqTM(1×)25 μl,GAPDH Forward Primer(10 μmol/L)0.8 μl,MGP Reverse Primer(10 μmol/L)0.8 μl,荧光探针溶液1.6 μl,ROX Reference Dye(50×)1.0 μl,DNA模板2.0 μl,灭菌蒸馏水18.0 μl,总反应体系为50.0 μl。反应条件均如下。预变性:95℃ 3 s,PCR:95℃ 5 s,60℃ 34 s,循环40次。每个标本检测3次。根据公式ΔΔCt=(CtMGP-CtGAPDH)实验组-(CtMGP-CtGAPDH)对照组,计算MGP的相对表达量。
1.9 统计学处理
采用SPSS 16.0统计软件处理数据,计量资料以x±s表示,不同时间各组比较采用重复测量数据的两因素多水平方差分析,多组比较采用单因素方差分析,两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 去卵巢大鼠模型评估
2.1.1 子宫组织HE染色切片光镜下观察 卵巢切除13周后,假手术组显示大鼠子宫内膜上皮为单层柱状,固有层有丰富的基质细胞和腺体,腺腔扩张,肌层玻璃样变不明显(图1A);去卵巢组显示子宫内膜明显增生与鳞状化生,较厚,固有层基质细胞、腺体和血管明显减少,腺腔多闭合,肌层玻璃样变性(图1B);特立帕肽治疗组显示子宫内膜上皮排列紊乱,固有层的基质细胞、腺体和血管减少,肌层玻璃样变轻,整体情况明显好于去卵巢组(图1C)。
2.1.2 各组大鼠术前和术后13周血中雌激素水平的比较 各组术前雌激素水平比较差异无统计学意义(P>0.05);去卵巢组及特立帕肽治疗组术后13周血中雌激素水平较术前及假手术组明显降低(P<0.05)(表1)。
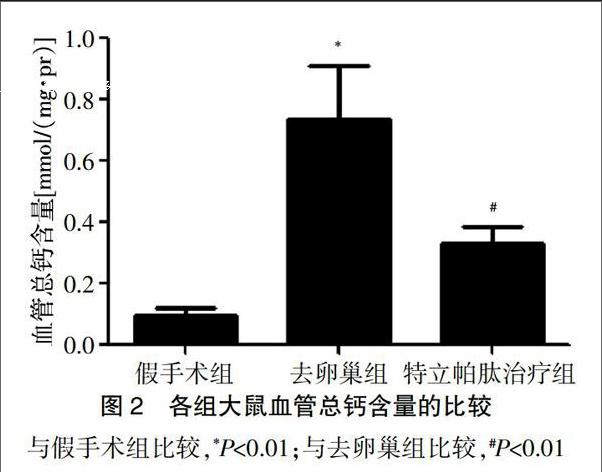
2.2 各组大鼠血管总钙含量的比较
去卵巢组血管总钙含量明显高于假手术组(P<0.01);特立帕肽治疗组血管总钙含量较去卵巢组降低(P<0.01)(图2)。
2.3 各组大鼠主动脉Von Kossa染色情况
去卵巢组可见血管内中膜钙沉积(黑色颗粒,图3B);特立帕肽治疗组使内中膜沉积的钙明显减少(图3C)。
2.4 各组大鼠血清uc-MGP含量的变化
去卵巢组术后血清uc-MGP含量明显升高,特立帕肽治疗组uc-MGP升高趋势不如去卵巢组明显(P<0.05),假手术组无明显变化(图4)。
2.5 各组大鼠主动脉uc-MGP免疫组化染色情况
各组血管壁均可见uc-MGP表达(棕黄色颗粒),去卵巢组表达uc-MGP明显较假手术组多,特立帕肽治疗组较去卵巢组的表达量减少(图5、图6)。
2.6 各组大鼠血管MGP mRNA相对表达量的比较
MGP mRNA表达量最高的是假手术组,表达量最低的是去卵巢组,特立帕肽治疗组表达量介于两者之间,差异有统计学意义(P<0.01)(表2)。
3 讨论
血管钙化和骨质疏松是老年人的常见病,尤其多见于绝经后女性,而且常伴行出现,给家庭和社会带来沉重的负担。作为唯一刺激骨形成的骨质疏松治疗药物——特立帕肽,具有增加骨密度、降低椎体骨折风险的确切效果,成为抗骨质疏松治疗药物的新突破[5]。特立帕肽对绝经后女性高发血管钙化的影响尚不明确,本研究在老龄去卵巢大鼠模型上系统评价了特立帕肽对血管钙化的影响,并对其机制进行初步的探讨,发现特立帕肽可以增加血管组织中MGP,使循环及组织中未羧化MGP的含量减少,进而影响血管钙化。
MGP最早从牛骨骼中分离出来,是一种维生素K依赖性蛋白,因其含有5个γ-羧基谷氨酸残基,活化需要γ-羧化作用,称为Gla蛋白[6]。它在骨、软骨及心、血管、肺等软组织中都有表达[7-8]。在血管中,血管平滑肌、巨噬细胞和内皮细胞都可合成MGP,是血管内异位钙化和软骨内骨形成的重要调节因子。维生素K使MGP谷氨酸残基羧化为有活性的γ-羧基谷氨酸基质蛋白,与羟基磷灰石亲和力增高,抑制钙沉积及羟基磷灰石晶体增长从而抑制血管钙化。如果MGP羧基化不完全,则以未羧化的MGP残基(uc-MGP)形式存在,其结合矿物质能力低下。大量研究显示,循环uc-MGP和各种病理状态(如慢性心力衰竭、肾衰竭、糖尿病风湿性疾病等)下的血管钙化成正相关,有望成为心血管事件新的生物标志物[9-11]。
本研究证实在去卵巢模型中,特立帕肽干预后血管组织中MGP增加,而血管及血液中未羧化MGP减少。以往关于PTH对MGP影响的研究大多针对透析或糖尿病患者,而对绝经后女性PTH对MGP的影响鲜有报道。绝经后女性血管钙化和骨质疏松同时高发,在用特立帕肽治疗骨质疏松的同时对血管钙化的影响不得不引起重视。
本研究用12个月龄雌性去卵巢大鼠模拟老年女性绝经后状态。雌性大鼠虽没有绝经期,但去卵巢后的身体状态与绝经后女性相似,是国际上最为常用的一种模拟妇女绝经后骨质疏松的模型[12]。实验结果中去卵巢后子宫HE染色形态变化及雌激素水平减少说明建模成功。
本研究显示,去卵巢组血管钙化增加和流行病学调查的绝经后女性血管钙化风险增加的报道相符。特立帕肽间断小剂量给药后,去卵巢大鼠的血管钙化明显改善。之前也有PTH减少血管钙化的报道,但是主要针对糖尿病患者[3]和肾衰竭患者[13],而对女性绝经后血管钙化的影响尚未见报道。为探讨其机制,笔者检测了循环uc-MGP的含量和在血管中的分布及血管组织中MGP mRNA的变化。特立帕肽在改善血管钙化的同时,使循环及血管组织中uc-MGP的含量减少,血管MGP mRNA增加,说明特立帕肽可能通过调节MGP的活化及转录调节去卵巢大鼠的血管钙化。Suttamanatwong等[14]在体外研究显示,PTH能增加成骨细胞中MGP的表达,参与PTH诱导的骨矿化过程。PTH可能通过蛋白激酶A及其他信号通路调节成骨细胞内MGP的表达。有研究显示,PTH通过改变Sp和Runx2转录因子的活性来调节成骨细胞内MGP的表达[15-18]。关于PTH对uc-MGP的影响尚未见报道,但以上都说明PTH和MGP之间存在密切联系。
综上所述,去卵巢大鼠血管钙化加重,并伴有血管MGP mRNA表达减少,血管及血液中uc-MGP增加。特立帕肽干预可以改善血管钙化,使血管MGP mRNA表达升高,血管及血液uc-MGP降低,说明MGP在绝经后女性血管钙化的发病机制中有重要作用,而特立帕肽调节MGP基因的表达及活化作用可能是其抑制血管钙化作用机制之一。本实验只用了一种剂量和干预时间,不同剂量及干预时间可能会对MGP和血管钙化的影响不同,所以,特立帕肽抑制绝经后女性血管钙化,防治绝经后心血管疾病的合适剂量、使用时间及对其他系统的影响等有待进一步临床观察与研究,具体的作用机制有待进一步探讨。
[参考文献]
[1] Lampropoulos CE,Papaioannou I,D′Cruz DP.Osteoporosis—a risk factor for cardiovascular disease?[J].Nat Rev Rheumatol,2012,8(10):587-598.
[2] 齐永芬.关注血管钙化和骨质疏松共同发病机制[J].中国动脉硬化杂志,2009,17(4):253-255.
[3] Shao JS,Cheng SL,Charlton-Kachigian N,et al.Teriparatide(human parathyroid hormone 1-34)inhibits osteogenic vascular calcification in diabetic low density lipoprotein receptor-deficient mice[J].J Biol Chem,2003,278(50):50195-50202.
[4] Wu SY,Zhang BH,Pan CS,et al.Endothelin-1 is a potent regulator in vivo in vascular calcification of vascular smooth muscle cells[J].Peptides,2003,2(4):1149-1156.
[5] McNeilly T,McNally C,Finch M,et al.Recombinant PTH:a study of the outcome of teriparatide therapy for 138 patients with osteoporosis[J].Ulster Med J,2013,82(2):89-93.
[6] Price PA,Urist MR,Otawara Y.Matrix Gla protein,a new gamma-carboxyglutamic acid-containing protein which is associated with the organic matrix of bone[J].J Biochem Biophys Res Commun,1983,117(3):765-771.
[7] Price PA,Williamson MK.Primary structure of bovine matrix Gla protein,a new vitamin K-dependent bone protein[J].J Biol Chem,1985,260(14):971-975.
[8] Fraser JD,OtawaraY,Price PA.1,25-Dihydroxyvitamin D3 stimulates the synthesis of matrix gamma-carboxyglutamic acid protein by osteosarcoma cells.Mutually exclusive expression of vitamin K-dependent bone proteins by clonal osteoblastic cell lines[J].J Biol Chem,1988,26(3):911-916.
[9] Boxma PY,van den Berg E,Geleijnse JM,et al.Vitamin K intake and plasma desphospho-uncarboxylated matrix Gla-protein levels in kidney transplant recipients[J].PLoS One,2012,7(10):e47991.
[10] van den Heuvel EG,van Schoor NM,Lips P,et al.Circulating uncarboxylated matrix Gla protein,a marker of vitamin K status,as a risk factor of cardiovascular disease[J].Maturitas,2014,77(2):137-141.
[11] Dalmeijer GW,van der Schouw YT,Magdeleyns EJ,et al.Matrix Gla protein species and risk of cardiovascular events in type 2 diabetic patients[J].Diabetes Care,2013, 36(11):3766-3771.
[12] Tezval M,Biblis M,Sehmisch S,et al.Improvement of femoral bone quality after low-magnitude,high-frequency mechanical stimulation in the ovariectomized rat as an osteopenia model[J].Calcif Tissue Int,2011,88(1):33-40.
[13] Sebastian EM,Suva LJ,Friedman PA.Differential effects of intermittent PTH(1-34)and PTH(7-34)on bone microarchitecture and aortic calcification in experimental renal failure[J].Bone,2008,43(6):1022-1030.
[14] Suttamanatwong S,Franceschi RT,Carlson AE,et al.Regulation of matrix Gla protein by parathyroid hormone in MC3T3-E1 osteoblast-like cells involves proteinkinase A and extracellular signal-regulated kinase pathways[J].J Cell Biochem,2007,102(2):496-505.
[15] Suttamanatwong S,Jensen ED,Schilling J,et al.Sp proteins and Runx2 mediate regulation of matrix gla protein(MGP)expression by parathyroid hormone[J].J Cell Bioc-hem,2009,107(2):284-292.
[16] Cancela L,Hsieh CL,Francke U,et al.Molecular structure,chromosome assignment,and promoter organization of the human matrix Gla protein gene[J].J Biol Chem,1990, 265(25):150402-150408.
[17] Lavienja AJ,Braaml LM,Arnold PG,et al.Beneficial effects of vitamins D and K on the elasticproperties of the vessel wall in postmenopausal women:a follow-up study[J].Thromb Haemost,2004,91(2):373-380.
[18] Price PA,Nguyen TM,Williamson MK.Biochemical characterization of the serumfetuin-mineral complex[J].J Biol Chem,2003,278(24):22153-22160.
(收稿日期:2014-09-16 本文编辑:李亚聪)