玉米储藏霉菌类群及玉米赤霉烯酮含量的研究
2015-03-11李听听李广富卢中一
李听听 陈 伟 李广富 卢中一
(山东农业大学食品科学与工程学院,泰安 271018)
全球每年约有25%的农作物被真菌毒素污染,约2%的农作物因污染严重而失去营养和经济价值,造成数千亿美元的经济损失[1-2]。玉米属于不耐储品种,在储藏期间会受到各种微生物特别是霉菌的危害,尤其在高湿高温的环境下,霉菌生长旺盛,其分泌的毒素对人体有很强的致癌作用。因此,防止真菌污染和真菌毒素是粮食储藏过程中最关键的问题之一[3]。
玉米赤霉烯酮(ZEN)是由玉米赤霉菌、串珠镰刀菌、禾谷镰刀菌、三线镰刀菌等真菌所产生的真菌毒素,造成的危害仅次于黄曲霉毒素[4]。ZEN主要污染玉米、小麦、大麦、燕麦等农作物及动物饲料。ZEN是具有雌激素作用的真菌毒素[5]。玉米中检测到ZEN浓度高达11.88 mg/kg,在燕麦、小麦、大麦和高粱中也广泛检出 ZEN[6]。我国 GB2715—2005《粮食卫生标准》规定小麦和玉米中的ZEN不得超过60 μg/kg。
本试验设定不同的相对湿度和水分含量,对玉米储藏中的霉菌数量、类群及玉米赤霉烯酮含量进行测定,并分析粮食储藏过程中ZEN含量与霉菌数量及类群间的关系,先使用Shannon指数(H)、Margalef丰富度指数(D)和Pielou均匀度指数(E)来评价霉菌群落遗传多样性分析,最后用SAS v9.0软件进行显著性分析,从而确定不同相对湿度储藏环境下,优势霉菌活动差异性、ZEN产量差异性及相关性。旨在为更好的粮食储藏提供理论参考。
1 材料与方法
1.1 仪器与试剂
1.1.1 玉米原料
岱玉D4收获于2013年10月份,购买自泰安市农贸市场。
1.1.2 仪器
TC-512 PCR扩增仪:上海创萌生物科技有限公司;美国Bio-Rad伯乐变性凝胶电泳仪(DGGE):上海肯强仪器有限公司;GelDoc 2000凝胶成像仪:北京乾明基因技术有限公司。
1.1.3 试验试剂
真菌培养基:PDA培养基,察氏培养基,孟加拉红培养基[7]。
PCR-DGGE试剂:真菌基因组DNA提取试剂盒(E.Z.N.A.TMHP Fungal DNA Kit,OMEGA):北京全式金生物技术有限公司;2×Taq MasterMix(with dye):北京康为世纪生物科技有限公司;Tris(Solarbio)、Na2EDTA·2H2O(Sigma)、去离子甲酰胺(Solarbio)、TE(Solarbio):北京全式金生物技术有限公司。
1.2 试验方法
1.2.1 玉米含水量调节[8]
将初始含水量12.1%的玉米调节至12.4%、14.3%、15.9%、17.6%、19.9%5 个梯度[9]。将清理的玉米分5等份,每份约5 kg,置于塑料容器中,采用喷雾方法,加入不同量的无菌水,按其含水量计算调节至目标含水量所需的理论添加无菌水量,用喷雾器分3次将理论添加无菌水量的蒸馏水喷到粮食表面,边喷边搅拌,以保证着水的均匀。着水后的玉米放置塑料袋内,排出袋中空气,密封于冰箱4℃冷藏保存,平衡24 h。
1.2.2 模拟储藏
干燥器(180 mm)内放置不同饱和盐溶液,以形成不同相对湿度的密闭环境。分别以NaCl、KNO3和KCl的饱和盐溶液配置在30℃形成75%、84%、92%不同的相对湿度[10]。将称取的玉米样品500 g分别放在无菌透气保鲜袋内,将保鲜袋放在装有不同饱和盐溶液的干燥器内,置于30℃恒温培养箱中培养(见表1)。

表1 模拟储藏的15个处理组
1.2.3 玉米霉菌菌落计数及分离与鉴定
参照国标食品卫生微生物学检验霉菌和酵母计数(GB 4789.15—2010)。玉米中霉菌的分离及鉴定参照GB/T 4789.16、中国真菌志第五卷“曲霉属及相关有性型”执行[11]。
1.2.4 高效液相色谱法(HPLC)测定玉米赤霉烯酮
1.2.4.1 玉米赤霉烯酮的提取和净化[12]
提取:准确称取10 g玉米粉于250 mL锥形瓶中,加入40 mL 乙腈 -水 -乙酸(84∶15∶1,V/V)溶液并混匀,超声30 min,期间混匀1次,然后置于振荡器上振荡30 min,再用滤纸过滤,收集滤液。
净化:移取8.0 mL滤液过免疫亲和柱Mycosep 226柱净化,准确转移4 mL净化液于试管中。
衍生:将试管放于60℃水浴氮气吹干,后加200μL正己烷和100μL三氟乙酸,塞上塞子,放在40℃的水浴锅中衍生20 min。
定容:将衍生后的样品溶液放在60℃水浴氮气吹干,加入1 mL甲醇-水(1∶1,V/V)溶液定容,在涡旋机上涡旋1 min后,倒入10 mL注射器中过0.22 μm的有机PTFE滤膜,待测。
1.2.4.2 玉米赤霉烯酮标准溶液的配制与柱前衍生
吸取黄曲霉毒素标准溶液200μL,在60℃水浴下氮气吹干,衍生化方法同1.2.4.1。
1.2.4.3 液相色谱条件
色谱柱:Diamonsil C18(2)(250 mm×4.6 mm,5μm,日本岛津)。流动相:A为含1%的磷酸溶液:B 为乙腈(55∶45,V/V)流速:0.35 mL/min;进样量:20μL;柱温:30℃;荧光检测器:激发波长235 nm,发射波长460 nm。
1.2.4.4 玉米赤霉烯酮的换算公式y=(0.067 9x-0.175 6)×(40/4)×100×10-3式中:y为每kg玉米中所含玉米赤霉烯酮的量ug/kg;x为峰面积。
1.2.5 玉米真菌遗传多样性测定
1.2.5.1 DGGE变性凝胶电泳
1)玉米上真菌总DNA的提取。采用OMEGA(E.Z.N.A.TMHP Fungal DNA Kit)试剂盒,具体按照试剂盒说明书进行。
2)真菌的ITS区段进行PCR反应。以1)中提取的DNA为模板,反应体系为50∶2μL 10μM ITS1-F-GC(5'-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCT TGG TCA TTT AGA GGA AGT AA-3')(下划线部分为 GC clamp)[13],2 μL 10 μM ITS2 - R(5'- TGT GTT CTT CAT CGA TG-3'),PCR Mix预混液25 μL,dd H2O 19μL。扩增程序:94℃预变性5 min,20个循环(94℃变性1 min;65~0.5℃退火45 s;72℃延伸1 min),15个循环(94℃变性1 min;55℃退火45 s;72℃延伸1.5 min),最终72℃延伸7 min。PCR产物使用1.2%琼脂糖凝胶电泳检测。
3)将各处理3平行PCR产物采用OMEGA公司Cycle-Pure Kit试剂盒回收纯化为50μL,具体步骤参照说明书进行。
4)采用Bio-Rad公司Dcode型梯度胶制备装置,制备变性剂浓度从30%~60%的8%聚丙烯酰胺凝胶。待胶凝固后,加入 PCR产物45μL和10×Loading Buffer 15μL的混合物,在1×TAE缓冲液中,50 V预跑30 min,然后150 V电泳6 h。
5)电泳结束后将凝胶放在DuRed核酸染液(泡染法)染色40~50 min。采用UVP(Gel Doc-It Imaging System)成像系统拍照,并用(Bio-Rad)软件进行图像分析。
1.2.5.2 DGGE部分条带测序
使用TIANGEN公司ZeroBack Fast Ligation Kit及DH5α感受态细胞进接合结合转化,提交条带测序在华大基因测序。采用MEGA5.1对测序结果进行分析。序列提交到 NCBI(http://www.ncbi.nlm.nih.gov/pubmed)的BLAST程序进行同源性比较。
1.3 数据统计方法
使用 Shannon指数(H)、Margalef丰富度指数(D)和Pielou均匀度指数(E)来评价细菌群落遗传多样性,其计算公式为:
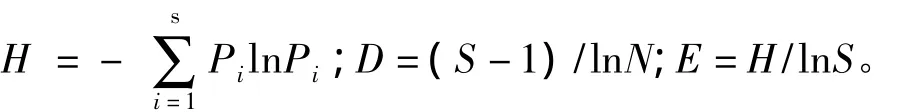
式中:Pi为某一条带的强度与同泳道中所有条带总强度的比值,即Pi=ni/N;S为每一泳道总的条带数[14]。数据处理和分析采用SASv9.0软件。
2 结果和分析
2.1 玉米赤霉烯酮标准曲线方程及样品的初始浓度
ZEN浓度与峰面积呈现良好的线性回归方程y=0.067 9x-0.175 6,相关系数0.996 1。检测样品初始质量浓度为24.89μg/kg
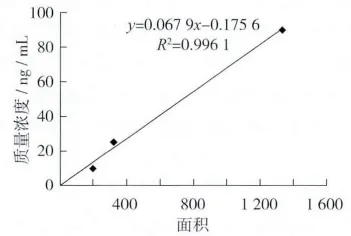
图1 玉米赤霉烯酮的标准曲线
2.2 不同储藏环境下霉菌总数,木霉、串珠镰刀菌数量与玉米赤霉烯酮含量
2.2.1 RH 75%环境下
玉米在温度30℃RH 75%的环境中储藏28 d,随玉米初始水分含量增加,串珠镰刀菌呈上升趋势,霉菌菌量、木霉菌量和玉米赤霉烯酮的含量均呈先升后降的趋势(表2)。霉菌和木霉均在初始水分含量为15.9%处取得最大菌落数,ZEN在初始水分含量14.3%处有最大毒素含量,是初始毒素量的11.40倍。当玉米中的水分含量超过14.3%,串珠镰刀菌数量大幅度增加,而ZEN积累量开始逐渐下降。可能原因有2,一是此时环境不适合ZEN的产生,即产毒菌株产 ZEN的能力下降;二是霉菌中其他菌[15-16],尤其是木霉[17]均能通过细胞壁吸附、产生某种降解ZEN的物质和营养竞争作用等多种方式抑制了镰刀菌生长、产毒及增强了玉米上毒素的降解能力。也进一步说明,并不是镰刀菌的数量越多,产生毒素的量就越多,镰刀菌产毒是多种因素共同作用的结果。

表2 RH 75%不同水分含量霉菌总数、木霉、串珠镰刀菌与玉米赤霉烯酮的量
2.2.2 RH 84%环境下
在温度30℃RH 84%的环境下不同含水量的玉米经过28 d的储藏后,随着玉米中初始水分含量的增加,木霉量和ZEN的积累量呈逐渐上升趋势,霉菌量和串珠镰刀菌呈相同的波浪起伏式趋势(表3)。且都在初始水分含量19.9% 时取得相对较大值,且ZEN的量是初始值的11.44倍。

表3 RH 84%不同水分含量霉菌总数、木霉、串珠镰刀菌与玉米赤霉烯酮的量
2.2.3 RH 92%环境下
在温度30℃RH 92%的环境下不同含水量的玉米经过28 d的储藏后(表4),随着玉米水分的增加,霉菌总量和木霉量都呈先上升后下降的趋势,且在15.9%处取得最大值,此时ZEN含量也是初始值51.30倍;ZEN积累量与串珠镰刀菌量的变化有相同的趋势,均在19.9%处取得最大值,且ZEN是初始值的95.28倍,说明高湿度的环境下利于ZEN的产生,这与参考文献[18-20]中的研究结果相一致。

表4 RH 92%不同水分含量霉菌总数,木霉、串珠镰刀菌与玉米赤霉烯酮的量
经单因素方差分析,在RH 75%和92%、温度30℃的环境下,经过28 d储藏后,玉米中霉菌量、木霉量和ZEN积累量均有显著性差异(P<0.05),串珠镰刀菌无显著性差异(P>0.05);在RH 84%、温度30℃下,除了串珠镰刀菌有显著性差异(P<0.05),其余均无显著性差异(P>0.05)。
综上所述,霉菌在中高湿度环境下更易生长和产毒。串珠镰刀菌会在高湿度环境下产生ZEN,产毒量随初始水分含量升高而增加。在低湿度环境下,初始水分对木霉抑制ZEN的影响明显,抑制效果随初始水分升高而迅速增加;在中高湿度环境下,木霉对ZEN的抑制效果更强,且受初始水分影响较小。
2.3 玉米储藏期间霉菌多样性变化
通过 DGGE-PCR方法对在 RH 75%、84%、92%温度30℃玉米储藏28 d真菌群落进行测定,DGGE电泳结果如图2所示。在RH 92%环境下,样品水分含量12.4%和14.3%的霉菌丰富度较高,高湿度高水分含量的样品10(RH 92%,水分含量19.9%)菌群很单一,丰富度低。
处理6(RH 92%、含水量12.4%)和处理7(RH 92%、含水量14.3%)多样性指数最高,丰富度指数较高,而高湿度高水分含量的处理10(RH 92%,含水量19.9%)多样性和丰富度相对较低(表5)。再次论证了由图2得出的结论。
综上分析可知,水分和环境湿度是菌落生长的重要因素,也是菌源的丰富度的重要决定因子,但菌群丰富度并不是与相对湿度或水分含量绝对正相关,而是每个样品的最佳菌群丰富度都有一个适宜的相对湿度和水分含量。
选择15个处理样品中亮度比较明显的条带(1~19共19条)进行测序比对(表6)。比对结果与已发表序列的相似性达到91%~100%,19条带共测定出12个序列,其中有4个序列为未培养菌类,占到总序列数的33.3%;其中黄曲霉和黑曲霉各占2个序列,均占到总序列数的16.7%;镰刀菌占1个序列,占总序列数的8.3%。

图2 玉米霉菌ITS区的DGGE分离

表5 储藏玉米霉菌多样性、丰富度及均匀度指数变化

表6 测序及比对结果
2.4 相关性分析
经相关性分析表明:在温度30℃,不同含水量的玉米经过28 d的储藏后,在RH 75%的环境下,玉米中的霉菌总量、木霉、串珠镰刀菌数量和水分含量均与ZEN的积累量呈负相关。在RH 92%的环境下,28 d的霉菌总量、串珠镰刀菌、木霉数量和水分含量均与ZEN的积累量呈正相关;且玉米中镰刀菌数与 ZEN积累量呈显著正相关(P<0.05,k=0.902);在RH 84%的环境下,经过28 d储藏,木霉量和水分含量与ZEN积累量呈显著正相关(P<0.05),玉米中镰刀菌数和霉菌总数与ZEN积累量呈负相关;在3种储藏环境下,储藏玉米霉菌的多样性指数(H)和丰富度指数(D)均与ZEN积累量呈显著性负相关(P<0.05)。
综上3个不同的储藏环境相关性的分析,在中、低湿度环境下,玉米上的镰刀菌数与ZEN量呈现明显负相关性,这说明在中低湿度环境下,ZEN的积累量生物因素和环境因素的影响较大。在高湿度环境下,玉米上镰刀菌与ZEN呈现显著正相关性,即ZEN积累量主要是由镰刀菌数为主导,而受其他霉菌影响相对较少。

表7 ZEN与串珠镰刀菌、木霉、霉菌及水分间相关性
3 结论
3.1 玉米在RH 75%的环境中串珠镰刀菌数量最大的初始含水量是15.9%,产毒最多的玉米初始水分含量却是14.3%,其毒素量是初始毒素量的11.40倍;玉米在RH 84%和92%的环境中串珠镰刀菌数量和产毒量最大的初始含水量均是19.9%,其毒素积累量分别是初始毒素量的11.44倍和95.28倍。在低湿度环境下,初始水分对木霉数量抑制ZEN含量的效果随初始水分升高而迅速增强;在中高湿度环境下,木霉对ZEN的抑制效果更强,且受初始水分影响较小。
3.2 RH 92%,含水量12.4%和14.3%的霉菌类群较多,即菌丰富度高,含水量19.9%时菌群丰富度低。经相关性分析,在RH 75%的环境下,玉米中的霉菌总数、木霉、串珠镰刀菌数量和水分含量均与ZEN的积累量呈负相关;在RH 92%的环境下,均呈正相关;在RH 84%的环境下,木霉数量和水分含量与ZEN积累量呈显著正相关(P<0.05),镰刀菌和霉菌总量与ZEN积累量呈负相关;在3种储藏环境下,储藏玉米霉菌的多样性指数(H)和丰富度指数(D)均与ZEN积累量呈显著性负相关(P<0.05)。
[1]夏红民,岳宁,张鹏.Mycotoxins,出入境农产品安全卫生检验的重要对象一真菌毒素[J].检验检疫科学,2000,10(5):56-59
[2]Bennett JW,Klich M A.Mycotoxins[J].Clinical Microbiology Reviews,2003,16(3):497 -516
[3]刘峰良,赵志辉,谢晶.谷物中真菌毒素的研究进展[J].广东农业科学,2012,39(19):115 -119
[4]周庆安,周建成,殷举亮,等.肉毒碱的营养生理功能及其应用[J].粮食与饲料工业,2002(10):26-27
[5]Zinedine A,Soriano J M,Molto J C,et al.Review on the toxicity,occurrence,metabolism,Detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food Chemical Toxicol,2007,45(1):1 -18
[6]Mrotensen G K,Strobel B W,Hansen H C.DegTadation of zearalenone and ochartoxin A in Three Danish agricultural soils[J].Chemosphere,2006,62(10):1673 -1680
[7]GB/T 4789.28—2003食品卫生微生物学检验染色法,培养基和试剂[S]
[8]黄淑霞,蔡静平,田海娟.主要粮食品种储藏期间霉菌活动特性研究[J].中国粮油学报,2010,25(1):99 -102
[9]GB 5009.3—2010食品中水分的测定[S]
[10]GB/T 6999—2010环境试验用相对湿度查算表[S]
[11]齐祖同.中国真菌志第五卷曲霉属及相关有性型[M].上海:科学出版社,1997
[12]证翠梅.高效液相色谱-四级杆-飞行时间质谱法同时测定粮食中13种真菌毒素[D].泰安:山东农业大学,2012
[13]Koort J,Coenye T,Vandamme Pet al.Streptococcus parauberis associated with modified atmosphere packaged broiler meat products and air samples from a poultry meat processing plant[J].International Journal of Food Microbiology,2006,106(3):318 -323
[14]Qin H,Li GZ,Ye Z Q,Xu QF,Cao Z H.Evolvement of soil bacterial community in intensively managed Phyllostachys praecox stand and related affecting factors[J].Chinese Journal of Applied Ecology,2010,21(10):2645 -2651.
[15]李冰,董征英,常维山.黑曲霉对黄曲霉毒素B1的降解与应用研究[J].饲料博览,2012,25(11):6 -10
[16]徐丹,秀兰,永仙,等.黑曲霉对黄曲霉生长、产毒及黄曲霉毒素B1的影响[J].中国微生态学杂志,2011,23(6):490-496
[17]宋晓妍,孙彩云,陈秀兰,等.木霉生防作用机制的研究进展[J].中国农业科技导报,2006,8(6):20 -25
[18]路子显,伍松陵,等.玉米赤霉烯酮生物合成和降解的研究进展[J].中国生物工程杂志,2011,31(2):116 -123
[19]程忠刚,林映才,等.饲料霉变的原因、危害及其预防[J].饲料工业,2011,32(3):1 -2
[20]杜晓煜.禾谷镰刀菌产毒分析及其毒素检测方法的研究[D].福州:福建农林大学,2011.
