环境雌激素双酚A暴露对小鼠乳腺的影响
2015-03-11张付闯石元朔黄长江董巧香
张付闯,石元朔,高 慧 ,黄长江,董巧香*
(1.温州医科大学环境与公共卫生学院,浙江温州 3 25035;2.美国德克萨斯大学健康医学中心,美国圣安东尼奥 7 8229-3900)
双酚 A(bisphenol A,BPA),学名 2,2-二(4-羟基苯基)丙烷,是目前世界范围内使用量最大的化学物质之一,主要用于工业生产塑料,环氧树脂等。日常生活中,矿泉水瓶、食品包装袋、医疗器械、牙科填充剂等都含有双酚A。双酚A在正常使用过程中可以从食物、饮料容器、牙齿密封剂及其他含有该物质的物品中泄漏出来。研究显示,在人体的血清、尿液、羊水、滤泡膜以及胎盘等中均检测到双酚A的存在[1-4]。2003-2004年,美国健康和营养调查协会对6岁以上不同年龄和性别的调查者尿样进行检测发现,92%以上人的尿样中检测到BPA[5-6]。近期对上海地区8~15岁儿童的尿样检测显示,84.9%的样本能检测到双酚A[7]。双酚A的暴露是普遍存在的,应该引起人们足够的重视。
低剂量暴露双酚A能够引起细胞内反应。双酚A对雌激素受体α(estrogen receptorα,ERα)和雌激素受体β(estrogen receptorβ,ERβ)具有一定的亲和力,这种亲和力相对于内源性雌激素要低很多[8]。在有些情形下,双酚A具有和雌激素相同的效力。除了与ERα和ERβ结合外,双酚A可与 G-蛋白偶联受体 30(G protein-coupled receptor 30,GPR30)结合发挥作用[9]。目前,已经提出多个双酚A可能作用的靶点,大量的研究结果显示,双酚A的一些代谢产物更能起到模拟雌激素的作用。
以小鼠和大鼠为模型的研究结果显示,围产期暴露环境剂量的双酚A可导致乳腺导管结构的恶性改变,而这种改变在随后的发展过程中可能形成乳腺瘤[8,10]。双酚A的暴露同样也能增加青春期乳腺导管对内源性雌激素的敏感性。早期双酚A暴露导致的乳腺导管组织的异常变化在乳腺后期的发展变化过程中一直存在。围产期前,大鼠暴露双酚A能够增加乳腺癌前期病变和原位肿瘤的发生概率,同时在后期的发展过程中更容易形成乳腺癌[11]。因而,双酚A很有可能是一种潜在的乳腺致癌物。
本研究首次采用FVB GFP品系雌性小鼠研究双酚A暴露对哺乳期结束后的小鼠乳腺、卵巢和子宫变化的影响。通过对乳腺的异常变化分析及对双酚A在乳腺病变发展过程中的作用进行探索,为雌激素内分泌干扰物对乳腺的影响及乳腺癌的发生提供实验依据。
1 材料与方法
1.1 材料
1.1.1 试验动物
3月龄FVB GFP小鼠购自美国 Jackson实验室。初始为雌雄各一只,在德克萨斯大学健康医学中心动物房严格按照实验规则繁殖。实验过程中所用器具及饲料均不含双酚A,繁殖至得到满足本试验需要的相同年龄组的雌鼠个数。
1.1.2 实验仪器
动物麻醉系统购自美国Microflex公司,剪刀购自美国Harvard Apparattus公司,渗透泵购自美国Alzet公司,动物解剖显微镜购自日本Nikon公司,石蜡切片机购自美国Leica公司。
1.1.3 试剂耗材
双酚A粉末购自美国Sigma公司;二甲基亚砜购自美国Sigma公司;吉姆萨染液购自美国Ricca chemical公司;Ki67抗体 (RM-9106)购自美国Thermo公司;酒精,福尔马林,二甲苯溶液,Citri-Solv溶液和WM封片剂均购自美国Fisher公司。
1.2 方法
1.2.1 动物分组及双酚A暴露
对2.5月龄的FVB GFP雌性小鼠进行交配,看到阴道栓的当天记为怀孕的第1天。怀孕8 d后将孕鼠随机分为3组,用渗透泵连续28 d暴露于BPA环境中。BPA溶解于50%的二甲基亚砜,每日处理剂量分别为0,25,250 ng·kg-1。每个处理7个重复。
1.2.2 小鼠阴道细胞的收集
哺乳期结束后1个月,用异氟烷麻醉小鼠30 s,颈椎脱臼小鼠。处死小鼠后,立即用滴管吸取少量水打入阴道,反复吸入吸出,将含有阴道细胞的水溶液涂在载玻片上,制作阴道细胞涂片。吉姆萨染色液进行染色,显微镜下观察细胞的组成。
1.2.3 乳腺、子宫和卵巢组织的收集和处理
阴道细胞采集完后,腹部朝上固定小鼠,用外用手术刀在腹部近阴道中央处,颈椎线向头部方向,上皮做一个切口,注意不要剪破腹腔膜。中线向四肢方向上皮各做一个切口,拉扯并固定小鼠外皮。用内用手术刀及镊子取下小鼠腹股沟区乳腺和胸部乳腺。乳腺取下后,分别进行全组织染色和常规石蜡组织切片。
收集母鼠子宫和卵巢组织时,取下后快速将其放入含有福尔马林缓冲溶液的器皿中,在显微镜下去除子宫及卵巢边缘的其他脂肪组织,直至观察到子宫及边缘色泽单一且光滑为止。组织固定完全后,转移至70%的酒精中保存。测量组织宽度和重量数据时,应保证组织处于正常自然延伸状态,统一使子宫棕色胎位点侧向上,解剖显微镜下拍照保存。使用精密天平测重量前,用吸水纸将组织外的酒精吸取完全并快速称量,酒精具有很强的挥发性,所以应防止吸干后在外边时间过长而损坏组织。
1.2.4 乳腺增生性导管结构的定量分析
乳腺导管的病理学切片HE染色后可以观察到四种导管形态,包括以正常的双层细胞结构为主的乳腺导管、多个细胞层增生性病变的导管、非典型腺管增生的导管和发生原位癌的导管。显微镜下对以上乳腺导管形态分别观察计数,进一步可以计算得到每个样品中四种形态总的导管个数。增生性导管结构所占的百分比/%=增生性导管个数/总的导管个数×100。
1.2.5 免疫组织化学染色的定量分析
显微镜下观察Ki67免疫组织化学染色后的切片,并对每个样品中的导管结构进行计数,得出总的导管个数。以单个乳腺导管结构为单位,Ki67阳性染色后构成导管细胞的细胞核呈棕黄色,当棕黄色细胞核数占该导管总细胞核数比例大于或等于10%时,认为导管有Ki67表达并以此计数。Ki67表达导管所占百分比/%=Ki67表达导管个数/总的导管个数×100。
1.3 统计分析
采用Graphpad Prism 6软件对数据进行单因素方差分析及T检验,测定结果以平均值±标准差表示。P<0.05时判定为差异显著。
2 结果与分析
2.1 雌鼠动情周期变化观察
显微镜下观察吉姆萨染色后的小鼠阴道细胞涂片,如图1所示 (比例尺50μm)。动情前期,卵泡生长加速,可观察到大量有核上皮细胞及少量角质化细胞;动情期,卵泡成熟、排卵,显微镜下满视野角质化上皮细胞及少量有核上皮细胞;动情间期,黄体退化,显微镜下可以同时看到白血球、有核上皮细胞和角质化上皮细胞;动情后期,黄体生成,显微镜视野下绝大部分为白血球细胞。小鼠动情周期的不同阶段对小鼠的乳腺的影响很大,处于动情后期的乳腺分支芽端明显较其他时期增多,本实验中所有用于分析的小鼠均不在动情后期。
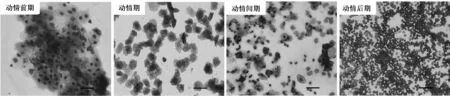
图1 母鼠动情周期变化
2.2 双酚A暴露对母鼠子宫及卵巢的影响
子宫和卵巢作为重要的生殖器官对乳腺的正常发育有着重要的调节作用。如图2所示 (比例尺5 mm),各处理组间子宫宽度、子宫和卵巢总重及卵巢重均无显著差异 (P<0.05)。通过分析典型的子宫含有卵巢的照片发现,对照组子宫两侧的胎位点数相差很大,为不对称型分布;经双酚A暴露的处理组,母鼠子宫两侧的胎位点数则更为对称,相差较小。
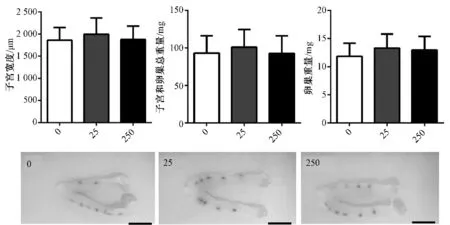
图2 母鼠子宫宽度和子宫及卵巢的重量变化
2.3 双酚A暴露对母鼠乳腺导管形态的影响
为评价不同剂量双酚A暴露对小鼠乳腺导管的影响,用胭脂红染液进行乳腺全组织染色,WM封片剂封片,解剖显微镜下观察乳腺导管密度和分支结构的变化。如图3所示 (比例尺100μm),经双酚A暴露的母鼠乳腺较对照组发生极其明显的变化。对照组乳腺导管具有清晰完整的二级结构和三次分支结构。与对照组相比,双酚A暴露组导管密度明显增大,二级结构和三次分支结构发生了异常变化。双酚A处理组的母鼠乳腺导管宽度明显大于对照组,250 ng·kg-1双酚A处理组母鼠乳腺变化最为明显。
2.4 双酚A暴露对母鼠乳腺病理学结构的影响
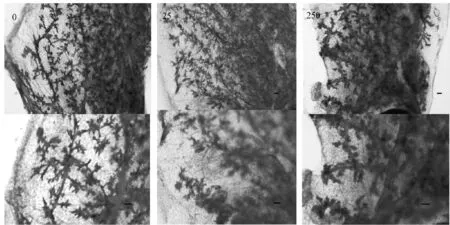
图3 母鼠乳腺形态学结构

图4 母鼠乳腺组织病理学结构
如图4所示 (比例尺为50μm),正常的乳腺导管为双层细胞结构,病变后多个细胞层的增生性导管结构增加。定量计算所有非正常双层细胞乳腺导管所占的百分比,分析结果显示,0,25,250 ng·kg-1中增生性的导管结构百分比分别为14.0%,45.6%和29.5%,双酚A暴露组非正常双层细胞乳腺导管的比例与对照组相比均具有显著意义的提高 (P<0.001)。说明双酚A确实能显著增加乳腺病理性病变。
2.5 双酚A暴露对母鼠乳腺导管Ki67表达的影响
Ki67是一种核蛋白,主要在增殖细胞中表达。为进一步分析双酚A暴露对小鼠乳腺导管的影响,对样品进行Ki67免疫组织化学染色。如图5所示(比例尺为50μm),25 ng·kg-1双酚 A处理组Ki67表达导管百分比极显著高于对照组 (P<0.001);250 ng·kg-1中Ki67表达导管百分比为14.8%,与对照组7.8%相比显著上升 (P<0.01)。表明双酚A暴露能够显著增加Ki67表达导管所占的比例。
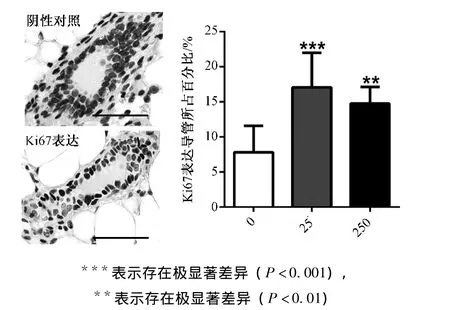
图5 母鼠乳腺导管Ki67表达率
3 小结与讨论
双酚A作为一种重要的工业化合物,因其在日常生活中普遍存在且可能作为一种潜在的乳腺癌致癌物而引起越来越多的重视。对CD-1的小鼠的研究发现,暴露环境剂量的双酚A可以使小鼠1月龄时乳腺导管填充脂肪垫的比例增加,同时也可以显著增加6月龄小鼠末端芽的数目[12]。另外,大量的实验也表明环境雌激素双酚A的暴露可以改变乳腺对自身分泌激素的敏感性[13],增加后期对乳腺癌患病的易感性[14]。双酚A诱导乳腺增生的机制性研究有待继续。
本研究针对FVB GFP品系受孕第9天雌性小鼠通过泵移植进行双酚A暴露。结果表明,双酚A显著改变了雌鼠导管的正常发育形态。低剂量双酚A处理组和高剂量双酚A处理组雌鼠导管密度较对照组明显升高,导管的二级结构和三次分支结构出现了异常的变化。双酚A暴露组子宫宽度和卵巢的重量与对照组相比无显著性差异 (P>0.05),双酚A暴露后对卵巢和子宫的总重量无明显作用,与已发表结果相一致[15]。双酚A处理后雌性小鼠子宫两侧的胎位点分布较对照组分布更为对称,因而可以判断双酚A暴露可能对雌性小鼠受精着床有一定影响。作为雌激素和孕酮等的分泌器官[16],双酚A的暴露对卵巢产生的微小变化极有可能影响到对乳腺导管的调控,进而呈现出乳腺导管的异常变化。对乳腺组织的病理学结构特征分析,低剂量和高剂量双酚A暴露均能增加增生性导管结构,表现为该结构占总体导管结构的百分比较对照组升高,差异有统计学意义 (P<0.001)。25,250 ng·kg-1双酚A暴露后Ki67表达导管所占百分比与对照组相比显著性升高 (P<0.01)。乳腺导管密度、分支结构、主导管宽度和病理学结构的异常变化是乳腺病变发展过程中的重要危险参考因素[10]。
本试验首次采用FVB GFP转基因品系受孕小鼠进行双酚A暴露,并对哺乳结束1个月后的乳腺进行分析,结果表明FVB GFP转基因小鼠是研究双酚A诱发乳腺异常变化的敏感动物模型。雌性小鼠对于孕期暴露双酚A十分敏感,双酚A改变了导管的正常发育并且使增生性导管的比例显著性增加。本次研究可以为双酚A对乳腺的影响提供一定参考,同时对人类有效预防乳腺病变及乳腺癌的临床诊断,治疗及预后有医学参考价值。
[1] Dekant W.Human exposure to bisphenol A by biomonitoring:methods,results and assessment of environmental exposures[J].Toxicology & Applied Pharmacology,2008,228(1):114-134.
[2] Shelnutt S,Kind J,Allaben W.Bisphenol A:Update on newly developed data and how they address NTP's 2008 finding of“Some Concern”[J].Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2013,57:284-295.
[3] Cao X L,Popovic S,Arbuckle T E,et al.Determination of free and total bisphenol A in human milk samples from Canadian women using a sensitive and selective GC-MS method [J].Food additives & contaminants part a,chemistry,analysis,control,exposure & risk assessment,2015,32(1):1-6.
[4] Volkel W,Kiranoglu M,Fromme H.Determination of free and total bisphenol A in human urine to assess daily uptake as a basis for a valid risk assessment [J].Toxicology Letters,2008,179(3):155-162.
[5] Lakind J S.Bisphenol A(BPA)daily intakes in the United States:estimates from the 2003-2004 NHANES urinary BPA data[J].Journal of Exposure Science & Environmental Epidemiology,2008,18(6):608-615.
[6] Calafat A M,Ye X,Wong L Y,et al.Exposure of the U.S.population to bisphenol A and 4-tertiary-octylphenol:2003-2004 [J].Environmental Health Perspectives,2008,116(1):39-44.
[7] Huang Y Q.Bisphenol A(BPA)in China:a review of sources, environmental levels, and potential human health impacts [J].Environment International,2012,42:91-99.
[8] Munoz-De-Toro M.Perinatal exposure to bisphenol-A alters peripubertal mammary gland development in mice [J].Endocrinology,2005,146(9):4138-4147.
[9] Wetherill Y B,Akingbemi B T,Kanno J,et al.In vitro molecular mechanisms of bisphenol A action[J].Reproductive Toxicology,2007,24(2):178-198.
[10] Murray T J,Maffini M V,Ucci A A,et al.Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure [J]. Reproductive Toxicology,2007,23(3):383-390.
[11] Acevedo N,Davis B,Schaeberle C M,et al.Perinatally administered bisphenol A as a potential mammary gland carcinogen in rats [J].Environmental Health Perspect,2013,121(9):1040-1046.
[12] Markey C M.In utero exposure to bisphenol A alters the development and tissue organization of the mouse mammary gland[J].Biology of Reproduction,2001,65(4):1215-1223.
[13] Barrett J R. Opening the window to cancer:Potential mechanism behind increased susceptibility in rats exposed prenatally to BPA [J].Environmental Health Perspective,2010,118(11):490.
[14] Tharp A P.Bisphenol A alters the development of the rhesus monkey mammary gland [J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(21):8190-8195.
[15] Wang D.Pubertal bisphenol A exposure alters murine mammary stem cell function leading to early neoplasia in regenerated glands[J].Cancer Prevention Research,2014,7(4):445-455.
[16] Wang L,Zhao D,Di L,et al.The anti-hyperplasia of mammary gland effect of Thladiantha dubia root ethanol extract in rats reduced by estrogen and progestogen [J].Journal of Ethnopharmacology,2011,134(1):136-140.
