大鼠脑出血后活化星形胶质细胞EGFR-JAK1/STAT3表达及Genistein 的抑制作用
2015-03-11肖霖,刘珍,武衡
肖 霖,刘 珍,武 衡
目前,许多研究认为星形胶质细胞活化在脑出血后脑损伤中可能起着重要的作用,脑损伤后,星形胶质细胞通过自分泌、旁分泌多种细胞因子促进自身的分裂增殖,其中转化生长因子-α(TNF-α)、表皮生长因子(EGF)是刺激活化AS 进入细胞周期的关键因子[1],而表皮生长因子受体(epidermal growth factor receptor,EGFR)是TNF-α、EGF 两种配体的共同受体。EGFR 是ErbB(ErbB1-4)家族的一员,是一种跨膜糖蛋白,属受体型酪氨酸蛋白激酶(RTK),与配体结合后,受体二聚化导致细胞内酪氨酸蛋白激酶活化,通过激活下游多条信号转导通路(Ras/Raf/MEK/ERK/MAPK 通路、PI3K/PDK1/Akt 通路、JAK/STAT 通路)[2]将信息传递到核内,作用靶基因,参与调节许多细胞的增殖、分化与迁移。近来有研究发现,在中枢神经系统损伤(外伤、卒中、肿瘤)或神经系统变性(阿尔茨海默病、帕金森病)[3]等情况下,EGF 及EGFR 在星形胶质细胞表达迅速上调,并长时间持续存在。我们最近的研究也表明,体外培养的星形胶质细胞应用睫状神经营养因子(CNTF)活化后,EGFR mRNA 表达明显上调[4],表明EGFR 可能介导了星形胶质细胞活化的信号转导,是触发星形胶质细胞由静息状态转变为活化状态的上游信号调控分子。而JAK/STAT 通路是EGFR 下游信号传导通路之一,基于此,我们选择染料木黄酮(genistein,GST)特异地抑制酪氨酸激酶活性[5],通过抑制EGFR 表达,进一步抑制其下游信号系统的激活,从而抑制细胞生长,为脑损伤后干预星形胶质细胞活化提供新的药效学靶点。
1 材料与方法
1.1 实验动物和试剂 体重200~300 g SD大鼠60 只(南华大学实验动物部购买),雌雄各半。鼠脑立体定位仪;常用试剂均为国产分析纯。
1.2 大鼠脑出血模型制作 大鼠以10%水合氯醛(400 mg/kg)腹腔注射麻醉,固定于鼠脑立体定位仪,参照鼠脑立体定位仪图谱,确定进针的部位:以前囟为原点,向后1.4 mm,矢状缝右侧旁开3.2 mm,开一约2 mm×2 mm 大小的正方形骨窗,通过微量注射器向下进针5.6 mm,缓慢注入0.20 U/μl的Ⅶ型胶原酶2 μl。神经功能评分采用Bederson 5 分制评分法:无神经功能缺失症状0 分;提尾时损伤对侧前肢屈曲1 分;前肢屈曲及对侧抵抗推力下降2 分;向对侧转圈3 分;向对侧转圈及意识障碍4 分。1~3 分为造模成功大鼠。
1.3 实验分组与给药 造模后大鼠随机分为3 组(每组20 只),脑出血模型组(ICH 组):造模后大鼠正常饲养,自由饮水;GST 组:造模后腹腔注射7.5 g/L 浓度Genistein(剂量50 mg/kg),1 d 一次;DMSO 组:造模后每天腹腔注射相同剂量DMSO 溶液。每组大鼠分别于术后1 d、7 d、14 d 和28 d 4 个时间点进行处理,各时间点随机选取5 只大鼠。
1.4 组织处理 大鼠用10%水合氯醛腹腔注射麻醉,打开胸腔,充分暴露心脏,经左心室插管至升主动脉,用血管钳钳夹腹主动脉,剪开右心耳,经左心室快速灌入生理盐水100~150 ml 左右,当右心耳流出液变清亮时,再用4%多聚甲约200 ml 灌注固定,然后取脑组织浸泡于4%多聚甲醛溶液中固体过夜后包埋成蜡块,切片备用。
1.5 GFAP、EGFR 免疫组织化学 免疫组织化学采用SABC 法,对照组用PBS 代替一抗。细胞质内出现棕黄色颗粒为阳性细胞。每张切片随机选择5 个不同的视野,用Quantimet570 图像分析系统Quic 图像分析软件进行分析,测定阳性细胞的平均吸光度值(A 值)。
1.6 Western blot 法检测p-JAK1 及p-STAT3提取各组脑组织总蛋白,10%聚丙烯酰胺凝胶电泳,转膜,10%脱脂奶粉封闭后,加入一抗、二抗孵育,最后用增强化学发光剂进行底物显色。使用凝胶成像分析系统进行灰度扫描,以p-JAK1/p-STAT3 与βactin 灰度值的比值进行比较分析。
1.7 统计学分析 采用SPSS13.0 统计软处理,计量资料用均数±标准差(±s)表示,同一时间点组间及不同时间点组内的比较采用方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分 3 组大鼠在脑出血术后1 d,神经功能评分无明显差异(P>0.05);第7、14、28 天,GST 组与ICH 组、DMSO 组比较,差异有统计学意义(P<0.05);DMSO 组与ICH组比较,差异无统计学意义(P>0.05);GST 组的第7、14、28 天与第1 天比较,差异有统计学意义(P<0.05);DMSO 组、ICH 组第7、14 天与第1 天比较,差异无统计学意义(P>0.05);第28 天与第1 天比较,差异有统计学意义(P<0.05,见表1)。
2.2 各组大鼠GFAP、EGFR 表达的比较 脑出血后第1、7,14、28 天均可见GFAP、EGFR 阳性表达,脑出血后第1、7 天,ICH 组、DMSO 组及GST 组GFAP、EGFR 阳性表达无明显差异(P>0.05),第14、28 天,GST 组GFAP、EGFR 阳性细胞明显增多,与ICH 组、DMSO 组比较,差异有统计学意义(P<0.05),各时间点DMSO 组阳性细胞表达与ICH 组比较,差异无统计学意义(P>0.05,见表2)。
2.3 各组p-JAK1、p-STAT3 蛋白表达水平比较 脑出血后,大鼠脑内p-JAK1、p-STAT3 表达水平明显上调,7 d 达高峰(见图1),14 d 开始下降,28 d仍有少量表达。第7 天GST 组p-JAK1、p-STAT3 水平较ICH 组、DMSO 组明显下调,差异有统计学意义(P<0.05,见图2),其余时间点,各组表达差异无统计学意义(P>0.05)。
表1 各组大鼠神经功能评分比较(n=20,±s)

表1 各组大鼠神经功能评分比较(n=20,±s)
与同时间点ICH、DMSO 组比较* P<0.05;与同组1 d 比较#P<0.05
表2 各组大鼠GFAP、EGFR 阳性表达平均吸光度值(A 值)比较(n=20,±s)

表2 各组大鼠GFAP、EGFR 阳性表达平均吸光度值(A 值)比较(n=20,±s)
与同时间点ICH、DMSO 组比较* P>0.05;与同时间点ICH、DMSO 组比较#P<0.05

图1 各组第7 天p-JAK1、p-STAT3 蛋白表达
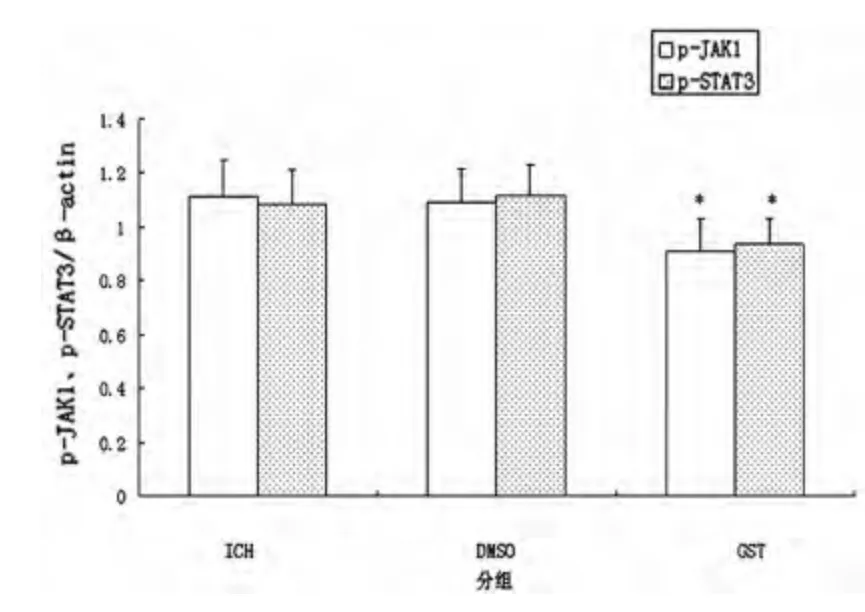
图2 各组第7 天p-JAK1、p-STAT3 表达
3 讨论
在中枢神经系统内,星形胶质细胞对神经元起结构支持作用。正常情况下,中枢神经系统中星形胶质细胞存在静止态、活化态两种并存细胞形态,但在病理条件下(出血、梗死、外伤等),大量星形胶质细胞在细胞因子作用下,从静息状态快速向活化状态转变,星形胶质细胞活化后,其在不同时期对脑损伤起着截然不同的作用,在病变早期,星形胶质细胞活化增殖过程中产生的细胞因子与增殖细胞一起,将损伤区与非损伤区隔离,避免胶质活化瀑布效应造成进一步的损伤[6]。但在星形胶质细胞活化增殖晚期,早期的多种有益功能逐渐消失,反而分泌许多有害因子,形成化学屏障,影响神经再生,同时,星形胶质细胞过度增生形成的胶质瘢痕可形成机械性屏障,阻碍轴突的再生、延长和融合[7],并且胶质瘢痕可以形成微血管套,压迫微血管,影响局部的血液供应。因此,探讨星形胶质细胞的活化机制、功能及调控因素,对于调控脑损伤后星形胶质细胞活化,减少胶质瘢痕的形成,促进脑损伤后神经功能的恢复具有重要的意义。
脑损伤后,星形胶质细胞活化是损伤刺激通过一系列级联反应,由细胞外通过细胞膜、细胞质传递到细胞核,导致细胞周期调控信号通路相关蛋白(如细胞周期蛋白cyclinsD1)等表达增高,从而启动细胞周期的进程,促使细胞由G1 期向S 期转化,导致星形胶质细胞不断增殖活化,到后期形成胶质瘢痕,影响神经功能的恢复[7]。研究表明,大鼠脑缺血后,活化星形胶质细胞中存在EGFR 表达上调,而且随着时间的递进其阳性表达值迅速上调,阻断EGFR 的表达可抑制星形胶质细胞活化,达到保护缺血性脑损伤作用,表明EGFR 可能是脑损伤后促进星型胶质细胞的活化重要因素。本研究发现,脑出血后第7天,脑组织中出现明显的EGFR 阳性表达星形胶质细胞,第14、28 天仍可见EGFR 阳性表达。同时,实验还发现,EGFR 阳性表达与GFAP 阳性表达值成正相关性变化,予以GST 阻断EGFR 表达后,能明显抑制星形胶质细胞的活化,表明EGFR 参与了脑出血后星形胶质细胞活化进程。
那么EGFR 是通过何种下游信号传导途径调控星形胶质细胞增殖活化的呢?目前,EGFR-JAK/STAT 信号转导途径与肿瘤细胞的增生关系已经明确,那么,我们是否可借鉴而用于研究其是否与星形胶质细胞增殖有关呢?目前尚无此方面的研究。不过,近来已有许多研究表明JAK 及STAT 家族成员在中枢神经系统的发育和损伤修复过程中存在不同程度的表达[8]。JAK/STAT 信号传导途径在中枢神经系统的研究,以往主要集中在神经免疫调节领域,与胶质细胞的关系是最近才为人们所认识,而且主要集中在小胶质细胞,如脑缺血可使小胶质细胞的JAK/STAT 信号传导途径活化,在星形胶质细胞活化、增殖中的作用目前不清楚。JAK-STAT 途径主要是各种细胞因子与受体结合,使其二聚体化,JAK 相互靠近、磷酸化,使受体上的酪氨酸残基磷酸化,通过STAT 形成二聚体后,STAT 与受体分离,转位到核内,结合到DNA 序列,从而调控基因表达。目前,已知AS 上有众多细胞因子(如IL-1、IL-6、EGF、TNF-α等)的靶点,所以,我们推测当这些细胞因子与AS 上的受体结合后,可激活JAK/STAT 信号转导途径,而STAT3 在GFAP 启动子上有结合位点,激活后进入核内与其位点结合,引起酪氨酸的快速磷酸化和AS中STAT-3 的核转位,从而调节靶基因的表达,导致星形胶质细胞的活化增生[9]。本实验显示,脑出血后星形胶质细胞中EGFR 表达上调,p-JAK1、p-STAT3 蛋白表达水平也上调,代表星形胶质细胞的应激性反应的GFAP 表达值也相应上调,表明脑出血后,活化的EGFR 经下游信号JAK1/STAT3 通路,诱导星形胶质细胞过度增殖,从而发挥其对神经功能的损伤作用。在给予EGFR 阻断剂干预后,GFAP表达值、p-JAK1、p-STAT3 蛋白水平均受到抑制,神经功能恢复,由此提示EGFR-JAK1/STAT3 信号转导途径在大鼠脑出血后星形胶质细胞化中发挥重要作用。
[1]Shim YJ,Shin YJ,Jeong SY,et al.Epidermal growth factor receptor is involved in clusterin-induced astrocyte proliferation[J].Neuroreport,2009,20(4):435-439.
[2]Departamento de D,Facultad de M,Pontificia U,et al.Epidermal growth factor receptor(EGFR)and squamous cell carcinoma of the skin:molecular bases for EGFR-targeted therapy[J].Pathol Res Pract,2011,207(6):337-342.
[3]Yang Q,Wang EY,Huang XJ,et al.Blocking epidermal growth factor receptor attenuates reactive astrogliosis through inhibiting cell cycle progression and protects against ischemic brain injury in rats[J].Neurochem,2011,119(3):644-653.
[4]郭志慧,武 衡.星形胶质细胞活化与表皮生长因子受体表达的相关性研究[J].中风与神经疾病杂志,2010,26(8):683-685.
[5]Lin AH,Leung GP,Leung SW,et al.Genistein enhances relaxation of the spontaneously hypertensive rat aorta by transactivation of epidermal growth factor receptor following binding to membrane estrogen receptors-α and activation of a G protein-coupled,endothelial nitric oxide synthase-dependent pathway[J].Pharmacol Res,2011,63(3):181-189.
[6]Milos P,Marcela P.Astrocyte reactivity and reactive astrogliosis:costs and benefits[J].Physiol Rev,2014,94(10):1077-1098.
[7]Yang Q,Wang EY,Huang XJ,et al.Blocking epidermal growth factor receptor attenuates reactive astrogliosis through inhibiting cell cycle progression and protects against ischemic brain injury in rats[J].Neurochem,2011,119(3):644-653.
[8]Liu YD,Holdbrooks AT,Patrizia DS,et al.Therapeutic efficacy of suppressing the JAK/STAT pathway in multiple models of experimental autoimmune encephalomyelitis[J].J Immunol,2014,192(1):59-72.
[9]Lucile BH,Ceyzeriat K,Carrillo-de Sauvage MA,et al.The JAK/STAT3 pathway is a common inducer of astrocyte reactivity in Alzheimer’s and Huntington’s diseases[J].J Neurosci,2015,35(2):2817-2829.
