MMP-9 在单纯疱疹病毒性脑炎中的表达及对血脑屏障的影响
2015-03-10曾艳平关景霞卢祖能
周 瑜,曾艳平,周 琴,关景霞,卢祖能
单纯疱疹病毒性脑炎(herpes simplex encephalitis,HSE)是临床上常见的中枢神经系统感染疾病,导致脑组织出血坏死性损害,神经功能障碍较严重,但其具体的病理机制尚不明确。研究发现,小胶质细胞激活介导的继发性免疫损伤在其中起着关键的作用[1,2]。在脑损伤的各种病理因素中,基质金属蛋白酶(MMPs)的作用受到广泛关注,MMPs,尤其是MMP-9 可以促进脑组织毛细血管破坏,导致脑组织继发性脑水肿和脑出血[3,4]。MMP-9 在HSE 发病机制中的作用尚不清楚,本实验探讨HSE 中MMP-9 的表达及其对血脑屏障的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 3 周龄Balb/c 雄性小鼠95只,体重11~13 g,购自湖北省实验动物中心。
1.1.2 主要试剂 HSV-1 病毒和Vero 细胞由华中科技大学武汉协和医院中心实验室病毒室惠赠,H-DMEM 培养基、新生牛血清购自Gibco 公司,胰酶(Trypsin)购自美国AMRESCO 公司,抗体均购自美国eBioscience 公司,BB-94 购自British Biotech Pharmaceuticals 公司,明胶(gelatin)购自美国Sigma公司。
1.1.3 主要仪器 超净工作台(苏州净化设备厂),台式高速离心机(上海医用分析仪器厂),CO2恒温细胞培养箱(美国Napco 5410-220),低温离心机(美国Beckman 公司),微量加样器(美国基尔森公司),低温冰柜(日本MDF-382E),恒温水浴箱(重庆万达有限公司),解剖剪、镊(上海医疗仪器厂),血细胞计数板(西安化学试剂厂),相差显微镜(日本Olympus),激光扫描共聚焦显微镜(Olympus Fluoview FV500 Imaging System),6、24 孔培养板(美国Gibco 公司),一次性细胞培养瓶(美国Corning-Costar 公司)。
1.2 方法
1.2.1 病毒的滴定 HSV-1 病毒通过Vero 细胞中培养增殖后收集上清液,用维持液[含5%(体积分数)新生牛血清的DMEM 培养基]10 倍系列稀释,Vero 细胞于96 孔板中长成单层细胞,接种系列稀释的病毒液,对照孔和感染病毒孔均加入100 μl维持液。37 ℃、5%(体积分数)CO2细胞培养箱孵育。每天观察并记录出现细胞病变(细胞折光性增强、细胞变大变圆或融合性病变)的孔数。细胞病变不再发展时,经Reed-Muench 法计算TCID50 病毒滴度为10~5/20 μl,选择100 倍TCID50 病毒滴度10~3/20 μl 接种小鼠。
1.2.2 实验分组 实验小鼠20 只分为对照组和病毒组各10 只,观察14 d 内小鼠的发病情况及存活率,留取脑组织行病理切片。30 只随机分为对照组和病毒组,每组15 只,用于明胶酶谱及免疫荧光共聚焦检测。另取45 只小鼠分为对照组、病毒组、BB-94 处理组各15 只,用于脑组织水含量及血脑屏障通透性分析。
1.2.3 动物模型 按体质量3.5 ml/kg 予小鼠10%(体积分数)水合氯醛腹腔注射麻醉后,从右侧眼外眦与外耳道口连线中点处进针2~3 mm,向颅内注入HSV-1 制造HSE 模型。对照组注入细胞培养上清液20 μl,病毒组注入病毒液20 μl,BB-94处理组在注入病毒液20 μl 后12 h 给予BB-94(30 mg/kg)腹腔注射。
1.2.4 脑组织MMP-9 及MMP-2 明胶酶谱检测 分别于感染后第3 天、第7 天,每组小鼠取3 只深度麻醉后断头,取脑组织约0.2 g 在1 ml 冷匀浆缓冲液中匀浆,超声20 s 后,4 ℃12 000 ×g,离心15 min,收集上清,考马斯亮蓝法测定各样品中蛋白含量,随后上样于含1 mg/ml 明胶的10% SDSPAGE,电泳。电泳后,凝胶在50 mmol/L Tris-HCl buffer (pH 7.6,2.5% Triton X-100,5 mmol/L CaCl2,1 μmol/L ZnCl2)中漂洗两次,每次45 min;之后在50 mmol/L Tris-HCl buffer (pH 7.6,5 mmol/L CaCl2,1 μmol/L ZnCl2)中再漂洗两次,每次30 min;在孵育液[50 mmol/L Tris-HCl (pH 7.6),5 mmol/L CaCl2,1 μmol/L ZnCl2,0.02% Brij-35]中于37 ℃孵育42 h,使上样液电泳后条带中的金属蛋白酶充分降解凝胶中的明胶底物,之后凝胶经考马斯亮兰R-250 染色3 h,然后脱色,即可见在相应质量金属蛋白酶所在条带明胶降解处,为白色透明条带,而其余凝胶背景为蓝色。利用激光扫描光密度分析法半定量分析扫描条带。
1.2.5 脑组织MMP-9 免疫荧光共聚焦检测感染后第3 天,取3 只病毒组小鼠深度麻醉后断头,取右侧大脑半球行冰冻切片,3% BSA(用TBS 稀释)于室温下封闭1 h;倾去封闭液,按1∶ 100 稀释比加入一抗200 μl (兔抗OX-42 IgG,一抗稀释液为含3% BSA 的TBS,pH 7.2,含0.02% NaN3),37 ℃孵育60 min,PBS(含0.3% TritonX-100)冲洗5 min×3;滴加荧光素标记的二抗(1%BSA-PBS 1∶ 100稀释)200 μl,37 ℃孵育45 min,PBS 冲洗5 min×3;滴加三抗200 μl(羊抗MMP-9 IgG,稀释比为1 ∶100)和荧光素标记的四抗200 μl(1% BSA-PBS 1∶100 稀释)并重复上述孵育及PBS 冲洗步骤。异硫氰酸荧光素(FITC,显绿色荧光)标记OX-42,Cy3 荧光素(显红色荧光)标记MMP-9。甘油封片,激光共聚焦显微镜下观察。
1.2.6 脑组织含水量检测 病毒感染后第3天、第7 天,将各组小鼠各3 只深度麻醉后断头,取右侧大脑半球,精密电子天平称湿重(wwt);置80 ℃烤箱中,连续烘烤48 h 至恒重(最后两次质量差≤0.2 mg)后称干重(dw)。按Elliott 公式计算脑组织含水量(%)。脑组织含水量(%)=(wwt -dw)/wwt×100%。
1.2.7 脑组织血脑屏障通透性的测定 各组鼠3 只在相应时间点麻醉后,经尾静脉注入4% EB(160 mg/kg),观察小鼠眼球结膜、四肢,于注射后几秒钟变蓝,表明注入成功。2 h 后开胸通过左心室灌注生理盐水,直至右心房流出无色液体。断头取右侧大脑半球,称重后加入2 ml 甲酰胺,54 ℃恒温水浴箱中,孵育24 h。将溶有EB 的甲酰胺溶液过滤,用分光光度计(λ=610 nm)检测光密度值。根据EB 标准曲线计算脑组织EB 含量(ng/mg)。
1.3 统计学分析 采用SPSS 13.0 统计软件进行统计学分析,采用One-Way ANOVA 法进行检验。数据均以均数± 标准差(χ ± s)表示,以P <0.05为差异有统计学意义。
2 结果
2.1 小鼠生存状况 各组小鼠在HSV-1 感染后14 d 内作生存率观察,对照组至第14 天结束时均存活,病毒组小鼠于病毒感染后第3 天开始发病,表现为消瘦、耸毛、蜷缩、肢体麻痹、低反应性、衰竭和死亡。感染后第5~6 天症状达高峰,并多于2 d内死亡,14 d 结束时病死率为100%。
2.2 HSV-1 感染后脑组织MMP-9、MMP-2 表达活性 明胶酶谱实验显示,在相对分子质量标准92 kb、72 kb 处均出现明显的透明酶解带,分别为MMP-9、MMP-2 对应条带。对条带进行扫描分析(条带吸收峰值),结果以对照组脑组织明胶酶活性水平标准化,分析数据显示,HSV-1 病毒感染后3 d和7 d,脑组织中有较高MMP-9 活性水平,分别为对照组的1.98 ±0.22、2.18 ±0.16 倍。而脑组织中MMP-2 活性水平在病毒感染后无显著改变(见图1A、1B)。
2.3 免疫荧光观察脑组织MMP-9 表达 免疫荧光共聚焦显示,MMP-9 主要在OX-42 阳性细胞中表达,表明单纯疱疹病毒性脑炎中激活的小胶质细胞是MMP-9 的主要来源(见图2)。
2.4 病毒感染后脑组织水含量及血脑屏障通透性的变化 HSV-1 感染后破坏血脑屏障,与对照组比较,脑组织水含量与血脑屏障通透性在感染后第3 天和第7 天均显著增加(P <0.05),MMP-9 抑制剂BB-94 处理组可见血脑屏障通透性较病毒组降低,脑组织水含量亦下降(见表1)。
表1 脑组织血脑屏障通透性及水含量的变化(,n=3)
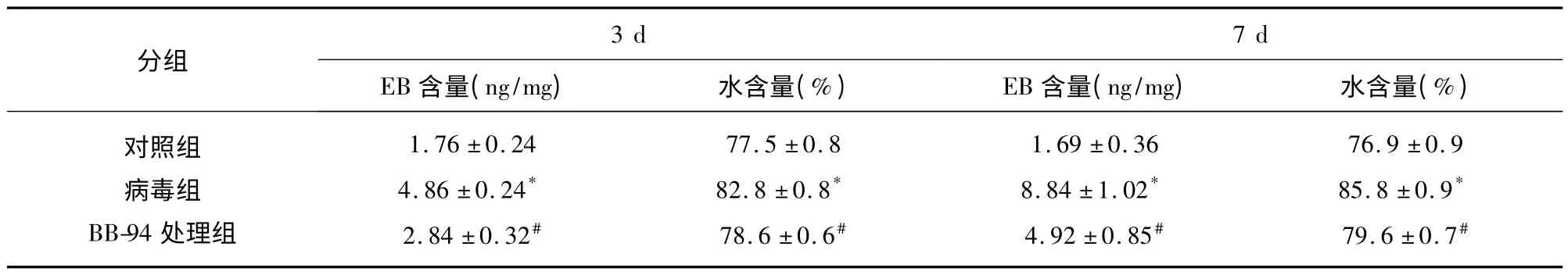
表1 脑组织血脑屏障通透性及水含量的变化(,n=3)
注:与对照组比较* P <0.05;与病毒组比较#P <0.05
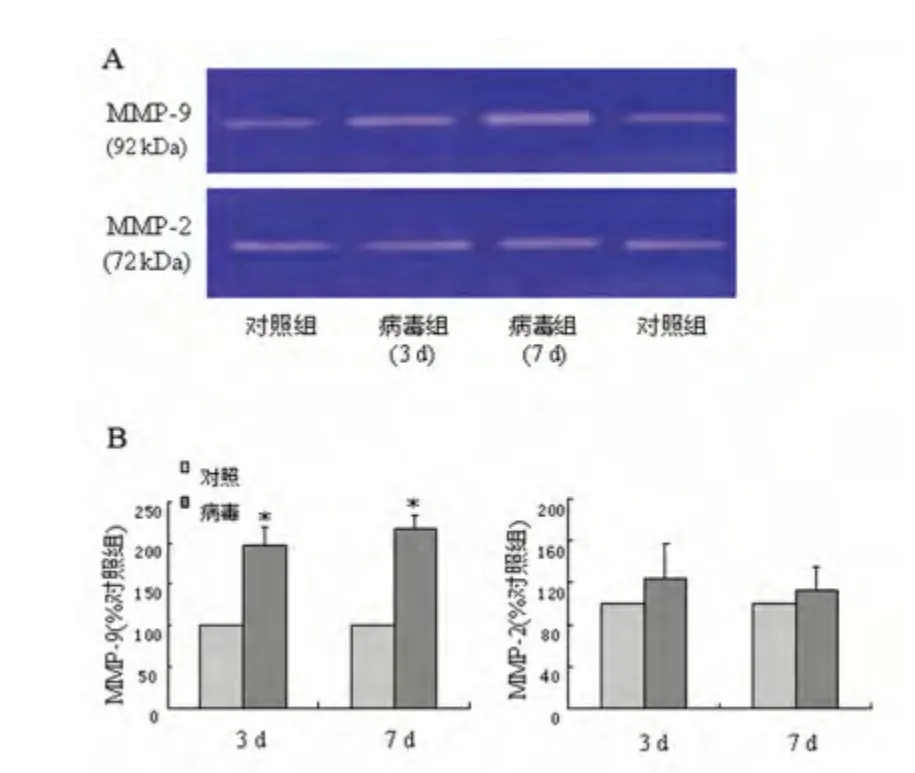
图1 HSV-1 感染后脑组织MMP-9、MMP-2 表达活性与对照组比较* P <0.01
3 讨论
HSV-1 所致单纯疱疹病毒性脑炎目前病死率仍高达20%,半数以上的患者常遗留严重的神经功能缺损[5]。研究发现,HSV-1 主要从两个方面造成神经损害:(1)病毒复制增殖直接造成神经细胞和神经胶质细胞的损害;(2)病毒激活了颅内的免疫炎症过程,并不断扩大,引起脑组织的免疫病理损伤,包括脑水肿、颅内压增高和出血坏死。HSE 患者长期存在免疫激活反应,与患者不良的预后和严重后遗症相关[6],即使早期给予抗病毒治疗,预后仍不佳。因此,较之病毒的直接损害作用,病毒感染后继发的炎性反应在病理过程中可能起着关键作用。
单纯疱疹病毒性脑炎后血脑屏障破坏导致脑炎后脑水肿、颅内高压及相关并发症的产生,直接影响到患者的生存率和神经功能的恢复。基质金属蛋白酶(MMPs)破坏血脑屏障、影响神经血管单位的完整性,在促进炎性损害过程中起着重要的作用[7,8]。神经血管基质的破坏,外周炎性细胞侵入中枢神经系统,可进一步触发脑血管并发症,加重继发性病理损伤[9]。Ⅳ型胶原、层粘连蛋白以及纤维结合素是血管细胞外基质骨架的主要组成部分,基质金属蛋白酶中明胶酶A(MMP-2)和明胶酶B(MMP-9)是破坏血脑屏障的主要成分,在病毒性脑膜炎患者脑脊液及血清中MMP-9 水平均增加[10,11]。但MMPs 在单纯疱疹病毒性脑炎病理损伤中的作用尚不明确。
本研究发现,在病毒感染后第3 天,即单纯疱疹病毒性脑炎早期,MMP-9 表达明显增高,到第7 天时活性水平更高,相应的血脑屏障的通透性增高,脑组织水含量增加,脑水肿加重。但MMP-2 的表达在病毒感染后第3 天、第7 天并未见明显改变。表明单纯疱疹病毒性脑炎中,MMP-9 而非MMP-2 在其病理机制中发挥重要作用。进一步我们观察到使用MMP-9 抑制剂BB-94 组小鼠脑组织EB 含量及水含量均较病毒组明显降低,说明BB-94 可以保护血脑屏障的通透性,从而减轻脑水肿。
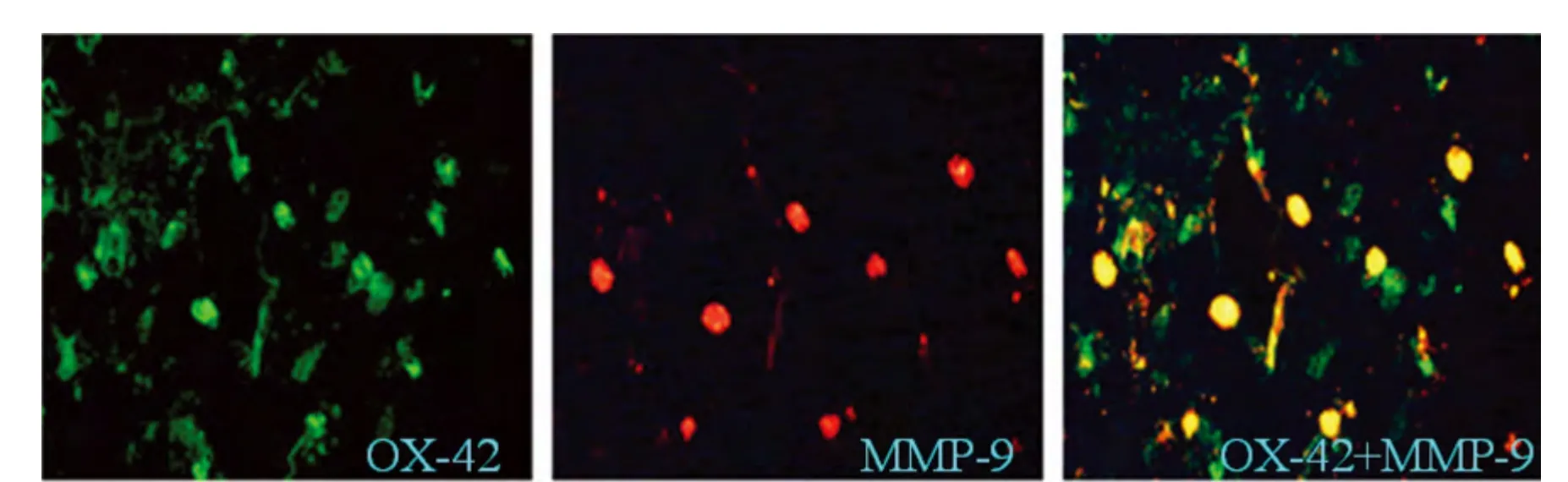
图2 脑组织MMP-9、OX-42 免疫荧光共聚焦
小胶质细胞作为存在于脑中的单核细胞,被认为具有抗原提呈、分泌细胞因子及吞噬作用,在多种病毒性脑炎中的作用受到日益关注[12]。小胶质细胞激活在病毒性脑炎中具有双重作用(抗病毒或免疫损伤),在HSE 中病毒可促发小胶质细胞产生一系列强有力的免疫炎性反应,但并不能保护小鼠的发病与死亡[13]。HSV-1 可通过Toll 样受体2(Tolllike receptor 2,TLR-2)诱发颅内的炎性反应,TLR-2基因敲除小鼠病毒感染后炎症因子表达减少,并显著提高了小鼠的存活率[14]。本实验中我们发现MMP-9 主要在OX-42 阳性细胞中表达,表明激活的小胶质细胞是MMP-9 的主要来源。我们推测病毒感染后激活脑内小胶质细胞,表达MMP-9 及系列炎性因子,破坏脑实质的神经血管基质结构,形成典型的出血坏死性病理改变。
通过本实验的初步研究表明,小胶质细胞激活表达的MMP-9 在单纯疱疹病毒性脑炎发病机制中起着重要作用,通过抑制MMP-9 的表达有可能为治疗单纯疱疹病毒性脑炎提供新的治疗策略。
[1]Wang JP,Bowen GN,Zhou S,et al.Role of specific innate immune responses in herpes simplex virus infection of the central nervous system[J].J Virol,2012,86(4):2273-2281.
[2]Conrady CD,Zheng M,van Rooijen N,et al.Microglia and a functional type I IFN pathway are required to counter HSV-1-driven brain lateral ventricle enlargement and encephalitis[J].J Immunol,2013,190(6):2807-2817.
[3]Vilalta A,Sahuquillo Barris J,Poca MA.Matrix metaloproteinases inneurological brain lesions:a new therapeutic target[J].Rev Neurol,2010,51(2):95-107.
[4]Min H,Hong J,Cho IH,et al.TLR2-induced astrocyte MMP9 activation compromises the blood brain barrier and exacerbates intracerebral hemorrhage in animal models[J].Mol Brain,2015,8:23.
[5]Andrei G,Snoeck R.Herpes simplex virus drug-resistance:new mutations and insights[J].Curr Opin Infect Dis,2013,26(6):551-560.
[6]Marques CP,Cheeran MC,Palmquist JM,et al.Prolonged microglial cell activation and lymphocyte infiltration following experimental herpes encephalitis[J].J Immunol,2008,181(9):6417-6426.
[7]Cunningham LA,Wetzel M,Rosenberg GA.Multiple roles for MMPs and TIMPs in cerebral ischemia[J].Glia,2005,50 (4):329-339.
[8]Yang Y,Thompson JF,Taheri S,et al.Early inhibition of MMP activity in ischemic rat brain promotes expression of tight junction proteins and angiogenesis during recovery[J].J Cereb Blood Flow Metab,2013,33(7):1104-1114.
[9]Sashindranath M,Sales E,Daglas M,et al.The tissue-type plasminogen activator-plasminogen activator inhibitor 1 complex promotes neurovascular injury in brain trauma:evidence from mice and humans[J].Brain,2012,135(11):3251-3264.
[10]Candelario-Jalil E,Yang Y,Rosenberg GA.Diverse roles of matrix metalloproteinases and tissue inhibitors of metalloproteinases in neuroinflammation and cerebral ischemia[J].Neuroscience,2009,158(3):983-994.
[11]Kolb SA,Lahrtz F,Paul R,et al.Matrix metalloproteinases and tissue inhibitors of metalloproteinases in viral meningitis:upregulation of MMP-9 and TIMP-1 in cerebrospinal fluid[J].J Neuroimmunol,1998,84(2):143-150.
[12]Hanisch UK,Kettenmann H.Microglia:active sensor and versatile effector cells in the normal and pathologic brain[J].Nat Neurosci,2007,10(11):1387-1394.
[13]Lundberg P,Ramakrishna C,Brown J,et al.The immune response to herpes simplex virus type 1 infection in susceptible mice is a major cause of central nervous system pathology resulting in fatal encephalitis[J].J Virol,2008,82(14):7078-7088.
[14]Kurt-Jones EA,Chan M,Zhou S,et al.Herpes simplex virus 1 interaction with Toll-like receptor 2 contributes to lethal encephalitis[J].Proc Natl Acad Sci USA,2004,101(5):1315-1320.
