血清PSA、PSAD检测在前列腺癌骨转移诊断中的价值
2015-03-10刘妍徐勇刘冉录张志宏杨阔
刘妍,徐勇,刘冉录,张志宏,杨阔
(1天津市泌尿外科研究所,天津300211;2天津医科大学第二医院)
随着人均寿命的延长,人口老龄化的加剧以及饮食结构的改变,前列腺癌(PCa)发生率在我国呈现逐年上升趋势[1,2]。PCa早期症状不典型,首次就诊时约有2/3患者已有明显的远处转移,其中骨转移占多数。PCa骨转移的确诊对临床分期、选择合理的治疗方案及判断预后有重要意义[3]。本文回顾分析238例PCa患者的病历资料,应用受试工作者特征曲线(ROC)进行分析,旨在探讨血清前列腺特异性抗原(PSA)、前列腺特异性抗原密度(PSAD)与PCa骨转移的关系。
1 资料与方法
1.1 临床资料 收集2003年12月~2010年2月与本所共同完成多中心课题研究的合作医院收治的238例PCa患者,年龄50~83岁;PCa诊断均经前列腺穿刺活检或手术后病理证实,PSA、PSAD及其相关病理分级等临床资料完整。其中低分化癌90例,中分化癌110例,高分化癌38例。PCa骨转移经ECT、X线、CT或MRI确定,其中PCa骨转移组112例、非骨转移组126例。
1.2 方法
1.2.1 血清PSA检测 空腹取静脉血3 mL,分离血清于-20℃冰箱冻存,采血前2周避免前列腺直肠指诊、膀胱镜检查。血标本采集均先于骨显像检查,但时间不超过8 d。血清PSA采用酶联免疫分析法检测,严格按试剂盒说明书操作。PSA的正常参考值为0~4 ng/mL。
1.2.2 血清PSAD检测 患者膀胱充盈,经腹部行B超检查前列腺横切面及纵切面,分别记录最大横径、前后径及纵径,了解前列腺内有无可疑病灶或结节,体积测量遵循Terris的公式:体积(cm3)=横径(cm)×前后径(cm)×纵径(cm)×0.52。PSAD= PSA/前列腺体积(cm3)。
1.2.3 骨转移诊断标准 全身骨扫描显像图中见2个或2个以上部位散在放射性异常浓聚或缺损灶,或X线、CT、MRI片中见有骨质破坏灶,并排除骨骼外伤、感染、关节炎、退行性变等良性病变。
1.2.4 统计学方法 应用SPSS15.0统计软件,计量数据以s表示,两组间比较采用t检验。敏感性、特异性、阳性预测值与阴性预测值以百分比表示,不同指标间比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 PCa骨转移组与非骨转移组血清PSA和PSAD水平比较 骨转移组中,血清PSA 20 ng/ mL以上者86例,占76.79%;非骨转移组PSA值低于20 ng/mL者104例,占82.54%。PCa骨转移组血清PSA及PSAD高于非骨转移组(P均<0.05)。见表1。
2.2 血清PSA及PSAD检测对PCa骨转移的诊断价值 以PSA≥10 ng/mL为PCa骨转移诊断标准,两组骨转移阳性率差异无统计学意义(P>0.05),不能诊断骨转移。以PSA>20 ng/mL为诊断标准,两组骨转移阳性率差异有统计学意义(P<0.05),有诊断骨转移的价值。血清PSA不同水平诊断骨转移的价值见表2。以血清PSAD≤0.40 ng/(mL· cm3)为PCa骨转移诊断标准,不能诊断骨转移。以PSAD>0.40 ng/(mL·cm3)为PCa骨转移诊断标准,两组骨转移阳性率差异有统计学意义(P<0.05),有诊断骨转移的价值。血清PSAD不同水平诊断骨转移的价值见表3。
表1 PCa骨转移组与非骨转移组血清PSA和PSAD水平比较(s)

表1 PCa骨转移组与非骨转移组血清PSA和PSAD水平比较(s)
注:与非骨转移组比较,*P<0.05。
组别 n PSA(ng/mL) PSAD[ng/(mL·cm3)]骨转移组 112 81.23±39.19* 2.04±4.95*非骨转移组126 12.81±16.36 0.31±0.38
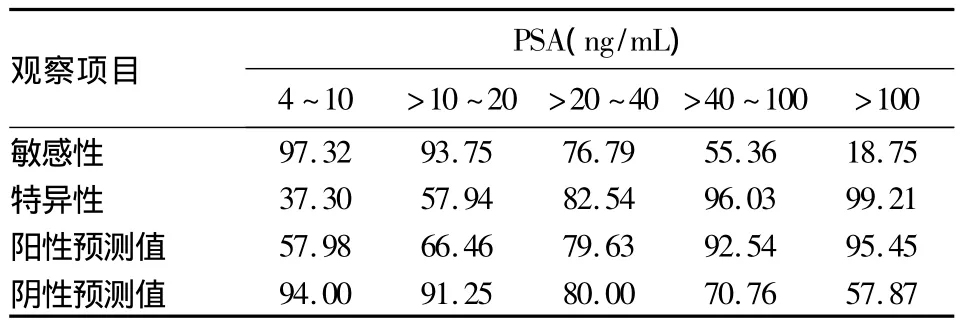
表2 血清不同水平PSA诊断骨转移的敏感性、特异性、阳性预测值、阴性预测值(%)
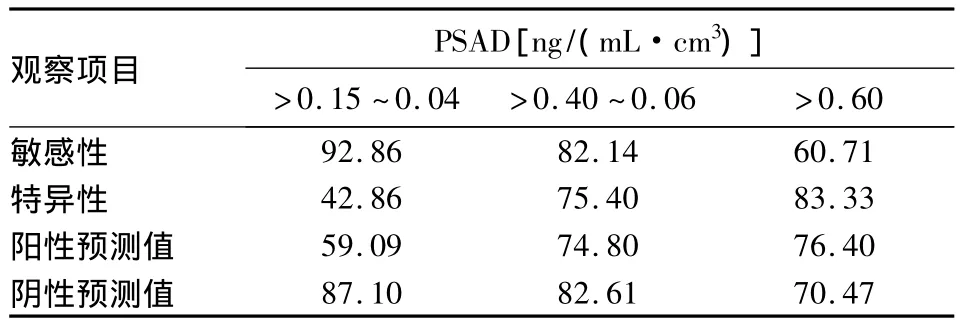
表3 血清不同水平PSAD诊断骨转移的敏感性、特异性、阳性预测值、阴性预测值(%)
2.3 血清PSA及PSAD检测诊断PCa骨转移的ROC曲线 应用ROC曲线确定诊断PCa骨显像敏感指标的临界值,PSA ROC下的面积为0.870,PSAD ROC下面积为0.847,见图1。根据敏感性和特异性之和最大点为最佳诊断临界值,本次研究ROC曲线诊断PCa骨转移的PSA最佳临界值为20 ng/ mL,敏感性为76.79%,特异性为82.54%;PSAD最佳临界值为 0.40 ng/(mL·cm3),敏感性为82.14%,特异性为75.40%。
2.4 血清PSA和PSAD联合检测对PCa骨转移的诊断价值 以PSA>20 ng/mL联合PSAD>0.40 ng/(mL·cm3)为临界值,其诊断PCa骨转移的敏感性、特异性、阳性预测值及阴性预测值分别达到82.14%、84.13%、82.14%、84.13%,PSA和PSAD联合检测的特异性优于PSA单独测定(P<0.05)。
3 讨论
骨骼是PCa最常见的转移部位,是否有骨转移对选择治疗方案有重要意义[4]。目前骨转移的诊断主要通过放射性核素骨扫描和X线成像,骨扫描与X线成像技术相比具有明显优势[5,6]。本研究中238例PCa患者中有112例在首次就诊时已有骨转移,骨转移阳性率为47.06%,与邓守真等[7]报道的阳性检出率61.4%差别不大。
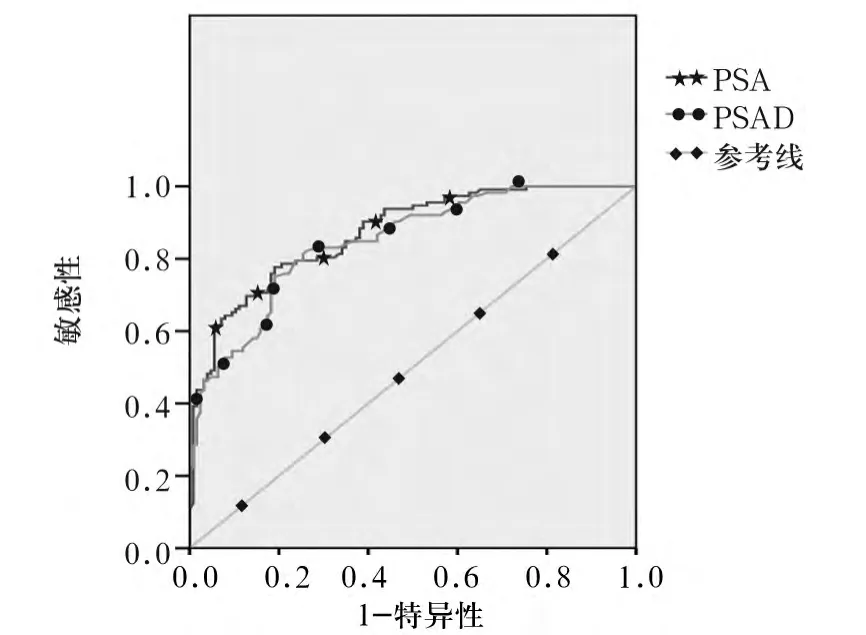
图1 PSA、PSAD的ROC曲线图
血清PSA是人前列腺上皮细胞分泌的一种丝氨酸蛋白酶,是诊断PCa最常用的标志物,但是PSA水平升高除由PCa引起外,还可由前列腺增生、前列腺炎、急性尿潴留以及有关前列腺的各种检查(直肠指检、经直肠B超检查等)所致[8]。Sershon等[9]发现,当PSA<20 ng/mL时,骨转移的发生机会极小。欧洲泌尿外科学会指南指出PSA>10 ng/ mL为局部进展的PCa患者应进行骨转移评估[10]。Briganti等[11]筛选了853例影像评估的癌患者,将患者分为低风险(穿刺活检Gleason评分≤7,cT1~cT3,PSA<10 ng/mL)、中等风险(穿刺活检Gleason评分≤7,cT2~cT3,PSA>10 ng/mL),高风险(穿刺活检Gleason评分>7)。当PSA<10 ng/mL而且患者无骨痛时,骨转移的可能性极低,因此不必要行常规骨扫描。本研究将PSA分成4~10、>10~20、>20~40、>40~100、>100 ng/mL来探讨PSA变化对预测PCa骨转移的可能性。骨转移阳性率随着PSA值升高而升高,提示PSA越高,预测骨转移可能性越大。以PSA>20 ng/mL,骨转移的敏感性达到76.79%,特异性为82.54%,有诊断骨转移的价值;PSA>100 ng/mL,特异性达到99.21%,表示高于该值的患者中大多都已发生骨转移。
血清PSAD即血清PSA浓度与经直肠超声波测定的前列腺体积的比值。侯建国等[12]选择明确诊断的26例PCa骨转移患者作为研究对象,分析PSA及PSAD的诊断价值,确定PSAD的临界值为0.1 ng/(mL· cm3)时,应高度怀疑PCa骨转移,并证明PSAD的诊断价值优于单独PSA检测。柴克强等[13]也得出相似结论。本研究结果显示,随着PSAD的增高,骨转移有增加的趋势。PCa骨转移组的PSAD值明显高于非骨转移组,PSAD ROC下面积为0.847,从曲线上得出PSAD最佳临界值为0.40 ng/(mL·cm3),敏感性为82.14%,特异性为75.40%,这说明PSAD也是预测PCa骨转移较好的指标之一。
本研究应用血清PSA和PSAD联合诊断对PCa骨转移进行预测,结果显示PSA与PSAD联合诊断的敏感性、特异性、阳性预测值及阴性预测值分别为82.14%、84.13%、82.14%、84.13%。PSA和PSAD联合检测的特异性优于PSA单独测定。但是,有研究者在评价PCa分期、分级、血清ALP和PSA预测骨扫描诊断时却发现,PSA是预测骨扫描结果最可靠的指标,当其他指标与PSA联合应用时较单用PSA不会增加其预测能力。已有研究表明,PCa细胞分化程度越低,其恶性程度越高,越具有侵袭能力,癌细胞更易造成全身转移;与高分化和中分化患者相比,低分化患者发生骨转移的可能性显著增高[14]。
总之,血清PSA及PSAD均为判断PCa患者有无骨转移的可靠指标,这两个指标联合使用更有临床价值。对于PSA>20 ng/mL、PSAD>0.40 ng/ (mL·cm3)、病理分级为低分化或中分化的PCa患者要高度怀疑骨转移的发生,对于此类PCa患者应尽快行骨扫描,以确定和排除PCa骨转移的存在。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]刘明,王建业,万钢,等.1995~2009年北京医院前列腺癌诊断状况变迁[J].中华泌尿外科杂志,2011,32(8):535-538.
[3]孙达.放射性核素骨显像[M].杭州:浙江大学出版社,2000: 94-113.
[4]赵辉,安建平,徐晓红,等.放射性核素骨显像联合PSA、fPSA、fPSA/tPSA评价前列腺癌骨转移[J].放射免疫学杂志,2011,24(2):176-178.
[5]Crawford ED,Stone NN,Yu EY,et al.Challenges and recommendations for early identification of metastatic disease in prostate cancer[J].Urology,2014,83(3):664-669.
[6]Picchio M,Spinapolice EG,Fallanca F,et al.[11C]Choline PET/CT detection of bone metastases in patients with PSA progression after primary treatment for prostate cancer:comparison with bone scintigraphy[J].Eur J Nucl Med Mol Imaging,2012,39 (1):13-26.
[7]邓守真,蒯大禹,方祖军,等.前列腺癌血清PSA、PAP测定与全身骨显像联合应用价值[J].中华核医学杂志,1997,17(4):245.
[8]Kirby RS,Fitzpatrick JM,Irani J.Prostate cancer diagnosis in the new millennium:strengths and weaknesses of prostate-specific antigen and the discovery and clinical evaluation of prostate cancer gene 3(PCA3)[J].BJU Int,2009,103(4):441-445.
[9]Sershon PD,Barry MJ,Oesterlin JE.Serum prostate-specific antigen discriminates weakly between men with benign prostatic hyperplasia and patients with organ-confined prostate cancer[J].Eur Urol,1994,25(4):281-287.
[10]Briganti A,Suardia N,Andrea G,et al.Predicting the risk of bone metastasis in prostate cancer[J].Cancer Treatment Reviews,2014,40(1):3-11.
[11]Briganti A,Passoni N,Ferrari M,et al.When to perform bone scan in patients with newly diagnosed prostate cancer:external validation of the currently available guidelines and proposal of a novel risk stratification tool[J].Eur Urol,2010,57(4):551-558.
[12]侯建国,李光辉,钱松溪,等.前列腺特异性抗原密度对前列腺癌骨转移诊断意义的回顾性研究[J].中华泌尿外科杂志,1995,16(6):357-359.
[13]柴克强,凡杰,夏术阶,等.PSA及其相关参数在前列腺癌骨转移中的预测作用[J].中国男科学杂志,2006,20(2):22-25.
[14]Sanjaya IP,Mochtar CA,Umbas R.Correlation between low Gleason score and prostate specific antigen levels with incidence of bone metastases in prostate cancer patients:When to omit bone scans[J].Asian Pacific J Cancer Prev,2013,14(9):4973-4976.
