Wnt5a、β-Catenin在子宫内膜腺癌中的表达及意义
2015-01-21梁利丹袁红瑛何涛刑鲁奇米建强张新蔡阳阳
梁利丹,袁红瑛,何涛,刑鲁奇,米建强,张新,蔡阳阳
(河南科技大学第一附属医院,河南洛阳471003)
研究显示,Wnt信号传导通路(包括经典Wnt通路和非经典Wnt/Jnk通路及Wnt/Ca2+通路等)在肿瘤发生及胚胎形成过程发挥重要作用,信号转导通路出现异常导致肿瘤生成[1~5]。β连环蛋白(β-Catenin)是Wnt信号传导通路的关键激活因子,它是一种细胞黏附因子,作为一种癌基因,其与乳腺癌、肺癌等恶性肿瘤的发生、发展及侵袭转移等密切相关[6,7]。为此,本文对 Wnt5a 和 β-Catenin 在子宫内膜腺癌中的表达情况进行了检测。
1 资料与方法
1.1 临床资料 收集本院2007~2009年刮宫或者手术切除标本的存档蜡块,其中正常增殖期子宫内膜13例(增殖期内膜组)、子宫内膜不典型增生18例(不典型增生组)、子宫内膜腺癌56例(子宫内膜腺癌组),均经病理检查确诊。子宫内膜腺癌FIGO(2009年)分期:Ⅰ~Ⅱ期38例、Ⅲ期18例;组织学分级:G1级12例、G2级31例、G3级13例。子宫内膜腺癌患者手术前均未接受过放、化疗或性激素治疗,且未合并其他恶性肿瘤。
1.2 方法
1.2.1 Wnt5a、β-Catenin 检测 DAB 酶底物显色剂购自福建迈新生物工程有限公司,兔抗人Wnt5a多克隆抗体购自北京博奥森生物工程有限公司,SP免疫组化试剂盒购自武汉博士德生物工程有限公司,鼠抗人β-Catenin单克隆抗体及SP免疫组化试剂盒购自北京中杉金桥生物工程有限公司。采用免疫组化方法将石蜡组织制作成4 μm切片,经二甲苯梯度脱蜡、梯度乙醇脱苯至水化,进行热修复抗原,然后行免疫组化染色。Wnt5a结果判断标准:其阳性表达位于胞质,根据染色程度和阳性细胞数综合计算评分。a为染色程度:未染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;b为阳性细胞数:10个随机高倍镜视野下无阳性细胞为0分,阳性细胞百分数<25%为1分,25% ~50%为2分,51% ~75%为3分,>75%为4分。最后计算a+b之和,0~3分为阴性,≥4分为阳性;β-Catenin结果判断标准:以染色呈棕黄或棕褐色为阳性。β-Catenin在正常上皮细胞中为胞膜连续染色,阳性表达时为胞膜表达缺失或胞质染色;在10个随机高倍镜视野下,胞膜连续表达缺失或胞质染色细胞数>10%为阳性,≤10%为阴性(不考虑胞膜染色情况)。
1.2.2 统计学方法 采用 SPSS16.0统计软件,Wnt5a和β-Catenin与临床病理资料间的关系分析采用四格表χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 三组 Wnt5a、β-Catenin阳性表达比较 见表1。
2.2 Wnt5a、β-Catenin阳性表达与子宫内膜腺癌临床病理特征的关系 Wnt5a和β-Catenin表达均与组织学分级有关(P均<0.05),β-Catenin表达与淋巴结转移有关(P<0.05);Wnt5a和β-Catenin表达与年龄、FIGO分期无关。见表2。
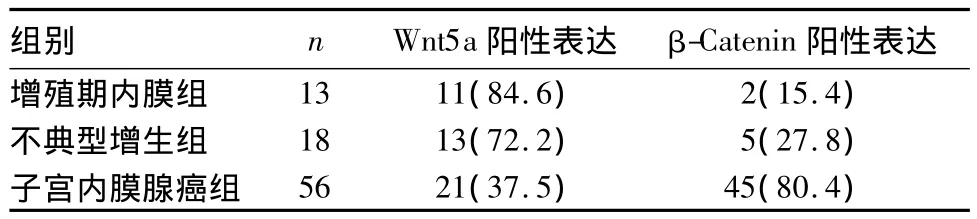
表1 三组Wnt5a、β-Catenin阳性表达比较[例(%)]
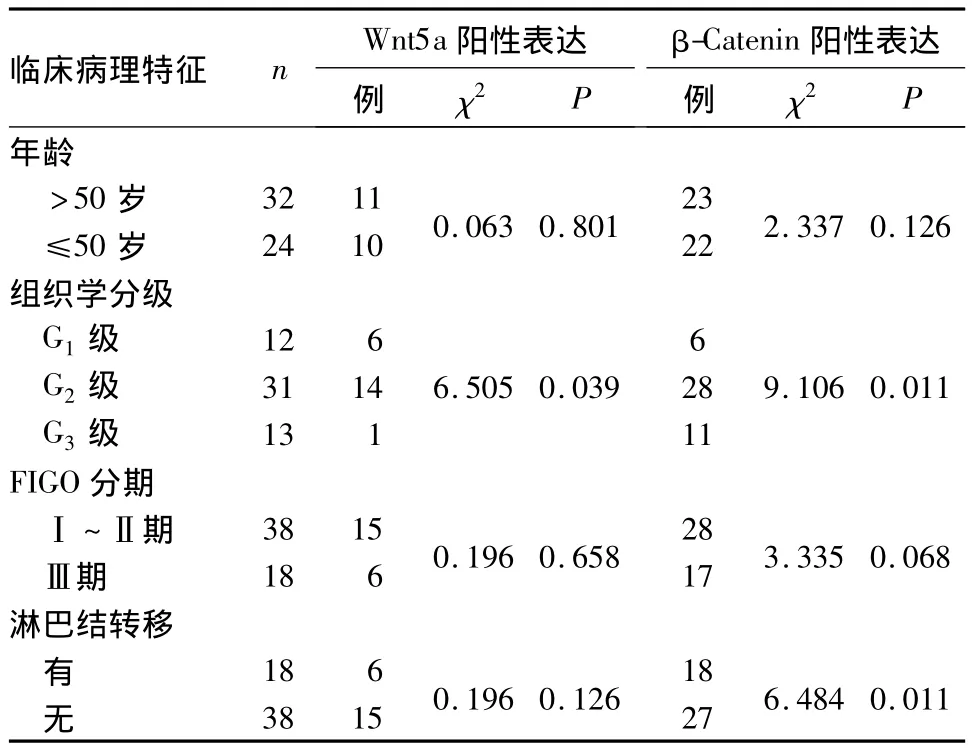
表2 β-Catenin、Wnt5a阳性表达与子宫内膜腺癌临床病理特征的关系
3 讨论
目前,子宫内膜癌的确切发生原因与机制仍不十分清楚,其发生可能与雌激素长期刺激并缺乏孕激素的拮抗有关[8]。肿瘤的发生是多种癌基因、抑癌基因等共同参与并引发细胞增殖与凋亡失衡长期累积的结果,目前研究认为Wnt/β-Catenin经典通路是与肿瘤发生有密切关系的通路。许多学者认为,子宫内膜腺癌中β-Catenin基因突变可能导致β-Catenin异常聚集,进一步导致子宫内膜腺癌的发生。Pijnenborg等[9]发现在子宫内膜腺癌中有38%的患者存在β-Catenin异常聚集,另有学者研究显示子宫内膜腺癌患者β-Catenin异常聚集率为53%、47%[10,11]。本研究发现 β-Catenin 子宫内膜腺癌中的阳性表达率为80.4%。
近年来研究表明,在肿瘤细胞中存在经典Wnt信号转导途径,其激活可能由通路中各成分包括β-Catenin、APC蛋白、GSK-3β及CyclinD1突变所致,异常Wnt信号传导途径使β-Catenin在胞质内积聚,并进入细胞核与Tcf结合,激活相关转录过程。已有研究报告显示直肠癌及乳腺癌患者正常生理状态细胞没有Wnt信号情况下,几乎没有游离的β-Catenin。多数情况下β-Catenin与钙黏着蛋白(介导依赖于钙的细胞间黏着作用的一类跨膜蛋白)结合形成复合体定位于细胞膜上。即使胞质内有少量 β-Catenin,亦被由 GSK-3β、APC、AXIN形成的降解复合体磷酸化而降解。当不同机制导致Wnt通路被激活,β-Catenin在胞质内聚集并转运至核内,与转录因子TCF/LEF结合调节靶基因如CMYC、CyclinD1、CD44、MMP-7 等癌基因的转录,导致肿瘤发生及转移[12]。
在子宫内膜腺癌中,有关Wnt/β-Catenin通路异常及相互关系的报道尚少。我们通过免疫组化染色方法检测56例子宫内膜腺癌的β-Catenin蛋白表达情况,发现组织分化程度越低,β-Catenin阳性表达率越高。提示β-Catenin所介导的Wnt通路促进肿瘤细胞的增殖分化,可能与子宫内膜腺癌的发生及进展程度有关。在子宫内膜腺癌中,β-Catenin的表达是因为降解机制的丧失,还是β-Catenin本身突变所造成,是否还有其他机制的参与,β-Catenin在子宫内膜腺癌的侵袭转移中到底通过何种机制发挥作用尚待进一步深入研究。Wnt5a是一类特殊类型的Wnt蛋白,主要介导非经典钙通路。有研究表明,在某些肿瘤中Wnt5a可通过非经典钙通路或其他机制抑制Wnt/β-Catenin通路,在肿瘤的发生、发展中起抑癌基因的作用。本研究显示,Wnt5a的表达与组织学分级有关,随肿瘤恶性程度的增加,Wnt5a呈低表达趋势。本研究还发现,在肿瘤间质新生血管内皮细胞中及平滑肌细胞有Wnt5a的表达,说明Wnt通路可能通过影响新生血管生成从而影响肿瘤的预后和治疗,其作用机制尚需进一步探讨和研究。
[1]Wei W,Sun HH,Li N,et al.Wnt5a modulates cell cycle progression and contributes to the chemoresistance in pancreatic cancer cells[J].Hepatobiliary Pancreat Dis Int,2014,13(5):529-538.
[2]Murdoch CE,Bachschmid MM,Matsui R.Regulation of neovascularization by S-glutathionylation via the Wnt5a/sFlt-1 pathway[J].Biochem Soc Trans,2014,42(6):1665-1670.
[3]Huynh N,Beutler JA,Shulkes A,et al.Glaucarubinone inhibits colorectal cancer growth by suppression of hypoxia-inducible factor 1α and β-catenin via a p-21 activated kinase 1-dependent pathway[J].Biochim Biophys Acta,2014,1853(1):157-165.
[4]Yao M,Wang L,Shi Y,et al.Intervention of glypican-3 genetic transcription on anti-proliferative effect of hepatoma cells with high metastatic potentiality[J].Zhonghua Yi Xue Za Zhi,2014,94(32):2544-2548.
[5]Kurayoabi M,Oue N,Yamamoto H,et al.Expression of Wnt5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion[J].Cancer Res,2006,66(21):10439-10448.
[6]Lugli A,Zlobec I,Minoo P,et al.Prognostic significance of the wnt signalling pathway molecules APC,beta-catenin and E-cadherin in colorectal cancer:a tissue microarray-based analysis[J].Histopathology,2007,50(4):453-464.
[7]Xu HT,Wang L,Lin D,et al.Abnormal beta-catenin and reduced in expression are associated with poor differentiation and progression in non-small cell lung cancer[J].Am J Clin Pathol,2006,125(4):534-541.
[8]Huynh N,Beutler JA,Shulkes A,et al.Glaucarubinone inhibits colorectal cancer growth by suppression of hypoxia-inducible factor 1α and β-catenin via p-21 activated kinase 1-dependent pathway[J].Biochim Biophys Acta,2014,1853(1):157-165.
[9]Pijnenborg JM,Kisters N,van Engeland M,et al.APC,betacatenin,and E-cadherin and the development of recurrent endometrial carcinoma[J].Int J Gynecol Cancer,2004,14(5):947-956.
[10]Kariola R,Abdel-Rahman WM,Ollikainen M,et al.APC and beta-catenin protein expression patterns in HNPCC-related endometrial and colorectal cancers[J].Fam Cancer,2005,4(2):187-190.
[11]Jochem AS,Holmes KE,Stein TJ.C-Myc and transforming growth factor α enhance the development of hepatic lesions due to mutant β-cateninin transgenic mice[J].Comp Med,2014,64(5):351-359.
[12]Liang H,Chen Q,Coles AH,et al.Wnt5a inhibits B cell proliferation and functions as a tumor suppressor in hematopoietic tissue[J].Cancer Cell,2003,4(5):349-360.
